左侧偏瘫患者上肢运动脑激活区与健康人对比的功能磁共振研究1)
董 培,崔方圆,谭中建,蒋根娣,张 华,邹忆怀
临床上,脑梗死有很高的致残率,但同时也发现,在梗死发生后的一段时间,受损的神经功能会有一定程度的恢复。现代基础研究将这种脑自行修复的能力归结为脑的可塑性,其机制很复杂,与年龄、功能康复训练、梗死位置等诸多因素相关。本研究通过对健康人与脑梗死后痉挛期患者左侧上肢运动的BOLD-fMRI对照研究,试图说明在运动通路损伤后,肢体运动所反应的激活脑区的特异性改变,进而初步探讨脑梗死后脑功能重塑在痉挛期的特点及其机制。
1 资料与方法
1.1 临床资料 偏瘫组:偏瘫患者6例,均为2008年3月—2009年3月于北京中医药大学附属东直门医院神经内科住院患者。其中男5例,女1例,年龄43岁~85岁。均为左侧痉挛性偏瘫者。经头颅CT或磁共振成像(MRI)诊断为脑梗死,病程2周至6个月,均为首次发作脑血管病,病灶均在右侧基底节和(或)放射冠,无意识障碍及视听障碍,Brunnstrom分级在1级~4级(上肢)。另设正常组为对照组。以上两组受试在试验前均无不适,除偏瘫组1例男性患者在试验过程中出现烦躁、压抑感而脱落外,余受试在试验过程中均未出现明显不适,配合完成试验任务。受试前均签署知情同意。
1.2 试验方法 应用东直门医院Simens Novus 1.5T超导磁共振扫描仪采用组块设计模式进行扫描。在试验前被告知试验目的与方法,讲解左上肢运动的方法、力度、幅度及频率,
Brunnstrom分级在1级~2级的患者进行被动运动,Brunnstrom分级在3级~4级的患者进行主动运动,受试者主动或被动左上肢运动的频率为从平台上匀速自然抬起角度约45°~60°,经过前期训练30 s内约运动 8次。受试者静息休息10 min~15 min后进入核磁室,平卧位,视听封闭状态,线圈固定,保持头位不动。首先进行结构像扫描,然后进行连续不间断的左上肢主动或被动运动任务的fMRI的扫描。三维结构成像扫描采用 T1WI序列,扫描全脑。
1.3 Bold fMRI图像处理及分析 采用BrainVoyager软件对fMRI数据进行随机效应模式统计处理。首先进行头动校正,对处理过的图像进行统计学分析,计算各像素的t值,P<0.05同时 voxel≥4的像素被认为有统计学意义。
2 结 果
2.1 正常组随机效应模式分析 可见左上肢主动运动的激活脑区在小脑的分布以左侧为主,包括小结、蚓部、后叶;右小脑激活区域以前叶、小脑扁桃体为主。在大脑皮层的激活区域以右侧中央前回(BA4)、中央后回(BA2,3,4,5,40)为主,而左侧大脑皮层未见明显激活簇。详见表1。
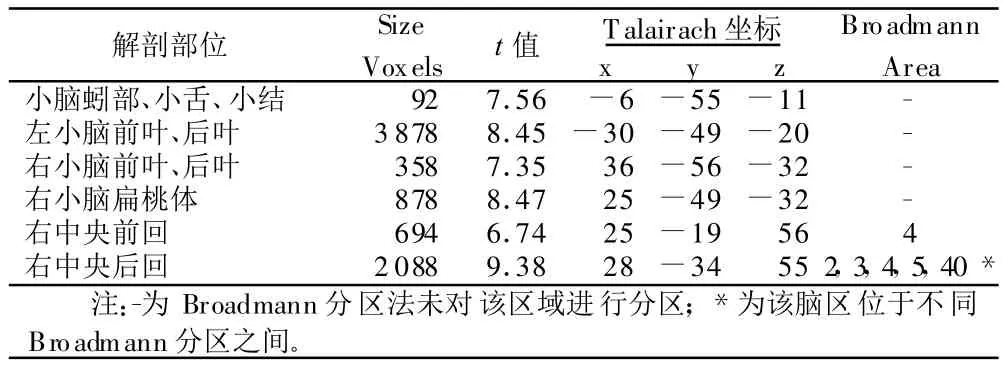
表1 正常组左上肢运动脑激活区像素数与t值
正常组左上肢主动运动脑功能抑制区以左右两侧边缘系统为主,包括前扣带回(BA24)、扣带回(BA23,31,32)、后扣带回(BA23,29,30,31)、海马(BA19,27,34,35,36,37,38)、杏仁核;左侧大脑皮层分布包括额下回(BA8,9)、中央前回(BA6,9)、顶枕楔前叶(BA7,23,31,39)、顶叶角回(BA39)、枕叶楔叶(BA18,30)、枕颞内侧回(BA19,22)、颞叶(BA13,20,21,22,41)、岛叶(BA13,22),激活簇较小;右侧大脑皮层包括额中回(BA6,8)、顶枕楔前叶(BA 23,31)、颞上回(BA 38),激活簇较小。详见表2。
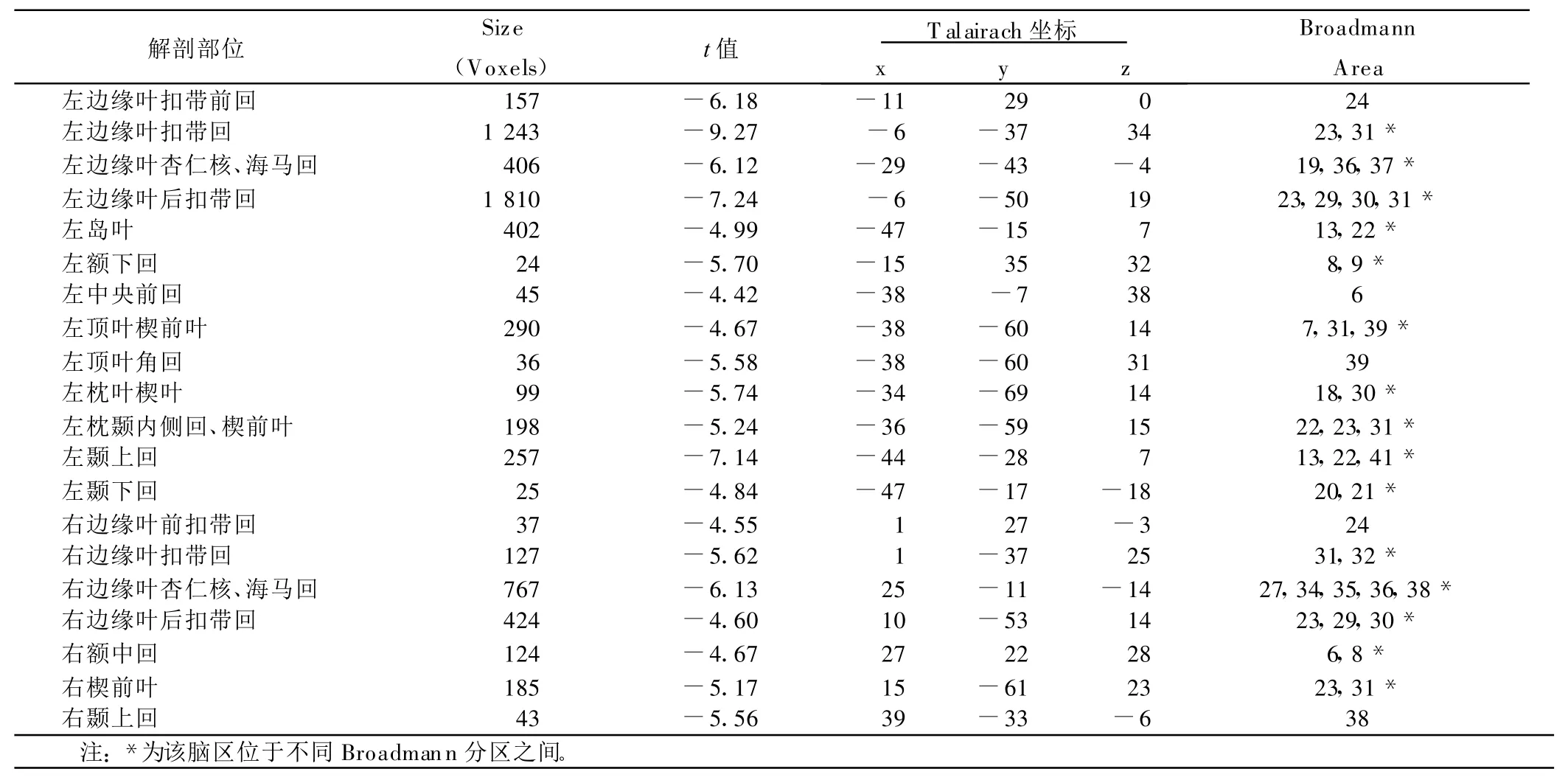
表2 正常组左上肢运动脑抑制区像素数与t值
2.2 对偏瘫组随机效应模式分析 可见左上肢运动的激活区包括:小脑蚓部、左小脑前后叶有明显激活,右小脑后叶有较小激活簇;边缘叶扣带回有较小激活簇;左右苍白球、壳核、左右丘脑及左岛叶(BA13)有明显激活;左侧大脑皮层激活簇分布于左中央前回、中央后回(BA2,3,4)、顶下小叶(BA40)、枕叶楔叶(BA17,18,19,23)、颞叶上、中回(BA21,22);右侧大脑皮层分布区为顶下小叶(BA40)、顶叶下部(BA40),上述区域激活程度较高,右枕叶楔叶和舌回(BA17,18)有少量激活。详见表3、图3。

表3 偏瘫组左上肢运动脑激活区像素数与t值
对偏瘫组左上肢活动抑制区分析可见,脑干髓质、左尾状核体和左岛叶(BA13)有少量负激活簇。详见表4。

表4 偏瘫组左上肢运动脑抑制区像素数与t值
两组受试在执行左上肢运动任务在中央前回、后回(BA3,4区)有共同激活簇。应用BrainVoyager软件中的ANOVA random effects analysis(F检验),对两组的脑激活体素与两组的刺激和静息基线进行统计学分析发现,激活区分布于每组内分析结果相符合。详见表5~表7。

表5 两组左上肢运动共同脑激活区

表6 两组左上肢运动兴奋脑区

表7 两组左上肢运动抑制脑区
3 讨 论
正常组左上肢主动运动脑激活区主要分布在右侧初级感觉运动皮层(SM1)及左侧小脑。另外,次级躯体感觉皮层(BA5区)及后顶叶皮层(BA40区)亦见大面积激活簇。本试验中,左上肢主动运动在右侧SM1有明显激活,并且沿中央前后回中上1/3分布,符合已知的皮层躯体定位排列方式。位于优势半球的BA5区属于次级躯体感觉皮层的一部分,其作用是整合到达初级感觉皮层的信息,并与原有记忆信息对比而成为经验的一部分。由于本试验设计为组块设计,此区的激活可能与运动任务的重复性相关。顶叶皮层的BA40区在优势半球被认为是较高的第三级联合区,推测运动觉、触觉、前庭觉、视觉、听觉在此进行最高水平的整合,并且此区可发出纤维直接投射到运动前区(BA6区),从而形成与锥体系和锥体外系的直接和间接联系[1]。这与已有研究认为的一些原来只参与运动准备的次级运动区,如辅助运动区(SMA)、前运动皮层(PMC)、次级运动区(PPC)也参与运动的执行[2]的结果相符。在小脑激活区中以左侧旧小脑为著。旧小脑主要接受来自脊髓小脑通路的传入冲动,而其传出的冲动可以调节抗重力肌群的活动,提供运动时维持平衡的肌张力强度。由于本试验采用左上肢抬举运动,并要求运动保持一定的频率和速度,因而肢体运动过程中需要维持一定的肌张力,这可能是旧小脑激活的原因。
虽然多数研究表明同侧半球运动皮层在运动协调和运动控制方面起作用,如SMA在利手和非利手运动时都表现双侧激活[3],同侧半球可能有控制精确运动的作用[4],并且左侧优势半球的作用更强[5]。更有研究发现右利手者即使在左手运动时左脑的激活程度强于右脑。这与本试验结果略有差异,考虑原因:首先不同于其他试验,本试验任务为左上肢的抬举运动,而非精细的对指运动,因此优势半球没有发挥较强的协调作用;其次,为了避免单个人的左侧半球激活簇小而且分散的情况,本试验分析采取严格的组群随机效应的方法,从而造成左侧大脑激活效应被剔除。
偏瘫组左上肢主动运动引起双侧大脑运动皮层的明显激活,激活区包括双侧初级感觉运动皮层、运动前区和次级运动区,双侧丘脑、小脑蚓部、右侧小脑、右侧岛叶、壳核,以及健侧大脑的苍白球、扣带回。与正常组相比,偏瘫组的激活区域出现明显泛化的情况,而且为双侧激活。这与以往的研究结果相符,如Kim等[6]发现卒中患者患侧手运动会引起双侧初级感觉运动皮层的激活。Butefisch等[7]发现卒中患者患肢运动时引起双侧运动前区和初级运动皮层的激活。两组左上肢主动运动时还出现了一些负激活的脑区,分布于扣带回后部(BA31)、楔前叶(BA7)、左侧 BA39、左侧 BA19、左额叶背外侧(BA8)等脑区。以上脑区被认为是静息态脑活动网络的一部分[8-10],其确切功能尚不清楚,但与大脑对内外环境的监测、情节记忆及自我意识相关。
由于大脑是个复杂的联络体系,各功能区间存在功能以及解剖结构上的联系,因此,当某一脑区受损后,大脑皮层出现动态的功能重组以适应这一变化。目前研究认为主要存在三种皮层重组的类型:一是患侧受累及的主要运动区发生移位;二是患侧未受累及的主要运动区仍有激活;三是非主要运动区的功能明显激活[11]。结合本研究分析其原因:脑梗死后患者运动功能的恢复有赖于锥体系以及锥体外系的共同作用,在随意运动恢复的过程中,张力、运动协调、控制能力起到关键作用。本研究中偏瘫组均为痉挛性偏瘫患者,与正常组相比,偏瘫组在执行运动任务时需要中枢神经系统更多的协调、控制作用,因此相应的脑区出现较多激活;本研究中偏瘫组的运动激活区出现了何运动感觉皮层后方移动的现象,根据Ziemann等[13]的研究,这可能与本研究选取的病灶部位均在皮层下相关。
脑梗死后脑功能的重塑依赖于皮层功能的有机重组,受到多方面因素的影响。本研究发现偏瘫组较正常组出现更多的锥体外系及次级运动区的激活,从而推测脑梗死后脑功能重塑的机制在于通过功能区的转移和次级功能区的功能代偿,这与以往的研究结果相符。但研究中也出现了一些无法用已有知识解释的激活或负激活区域,如静息态脑网络相关的脑区,这需要大样本的研究以阐明其机制。
[1] Cavada C,Goldman-Rakic PS.Posterior parietal cortex in rhesus monkey,Ⅱ:Evidence for segregated corticocortical networks linking sensory and limbic areas with the frontal lobe[J].Comp Neurol,1989,287:422.
[2] Weng XC,Li EZ,Zang YF,et al.Neural co rrelates of sequential finger movements revealde by event-related fMRI[J].Neuro Image,2000,11:920-927.
[3] Hlustikp,Solodkin A,Gullapallir P,et al.Functional lateralization of the human premotor cortex during sequential movements[J].Brain Cogn,2002,49(1):54-62.
[4] Ehrsson HH,Fagergren A,Jonsson T,et al.Cortical activity in precision-versus power-grip tasks:An fMRI study[J].Neurophy siol,2000,83(1):528-536.
[5] Jancke L,Specht K,Mirzazade S,et al.T he effect of finger movement speed of the dominant and the subdominant hand on cerebellar activation:A functional magnetic resonance imaging study[J].Neuro Image,1999,9(5):497-507.
[6] Kim YH,Jang SH,Byun WM,et al.Ipsilateral motor pathway confirmed by combined brain mapping of a patient with hemiparetic stroke:A case report[J].Arch Phy s Med Rehabil,2004,85(8):1351-1353.
[7] Butefisch CM,Kleiser R,Korber B,et al.Recruitment of contralesional motor cortex in stroke patients with recovery of hand function[J].Neurology,2005,64(6):1067-1069.
[8] Raichle M E,MacLeod AM,Snyder AZ,et al.A default mode of brain function[J].PNAS,2001,98(2):676-682.
[9] Mazoyer B,Zago L,Mellet E,et al.Cortical network fo r working memory and executive function sustain the conscious resting state in man[J].Brain Res Bull,2001,54(3):287-298.
[10] Greicius MD,K rasnow B,Resis AL,et al.Functional connectivity in the resting brain:A network analysis of the default mode hypothesis[J].PNAS,2003,100(1):253-258.
[11] Alkadhi H,Kollias SS,Crelier GR,et al.Plasticity of the humanmotor cortex in patients with arteriovenous malformations:A functional MR imaging study[J].AJNR,2000,21:1423-1428.
[12] Ziemann U,Iliac TV,Pauli C,et al.Learning modifies subsequent induction of long-term potentiation-like and long-term depressionlike plasticity in human motor cortex[J].Neuroscience,2004,24:1666-1672.

