东方田鼠胚胎成纤维细胞的分离培养及生物学特性
成钢,盖楠,熊德慧,胡维新
(中南大学生物科学与技术学院分子生物学研究中心,长沙 410078)
研究报告
东方田鼠胚胎成纤维细胞的分离培养及生物学特性
成钢,盖楠,熊德慧,胡维新
(中南大学生物科学与技术学院分子生物学研究中心,长沙 410078)
目的对影响东方田鼠胚胎成纤维细胞(M fEF)分离和培养的因素进行探索,并观察其生物学特性。方法取室内繁殖饲养不同胎龄的东方田鼠胚胎分离成纤维细胞,通过原代和继代培养,分析比较不同胎龄、不同血清浓度、不同胰蛋白酶浓度等因素对M fEF分离及培养的影响,观察M fEF的生长形态及其生物学特性。结果
M fEF为贴壁型生长,细胞形态多样,呈梭形、不规则多边形;采用0.125%的胰蛋白酶室温消化12~13 d胚胎组织5 min,以DMEM培养基添加15%小牛血清分离培养M fEF的效果最佳;M fEF2~7代增殖最旺盛。结论获得了实验室分离、培养M fEF的有效方法,为进一步深入研究东方田鼠抗日本血吸虫机制以及开展不同动物成纤维细胞间比较研究奠定了基础。
东方田鼠;胚胎成纤维细胞;生物学特性
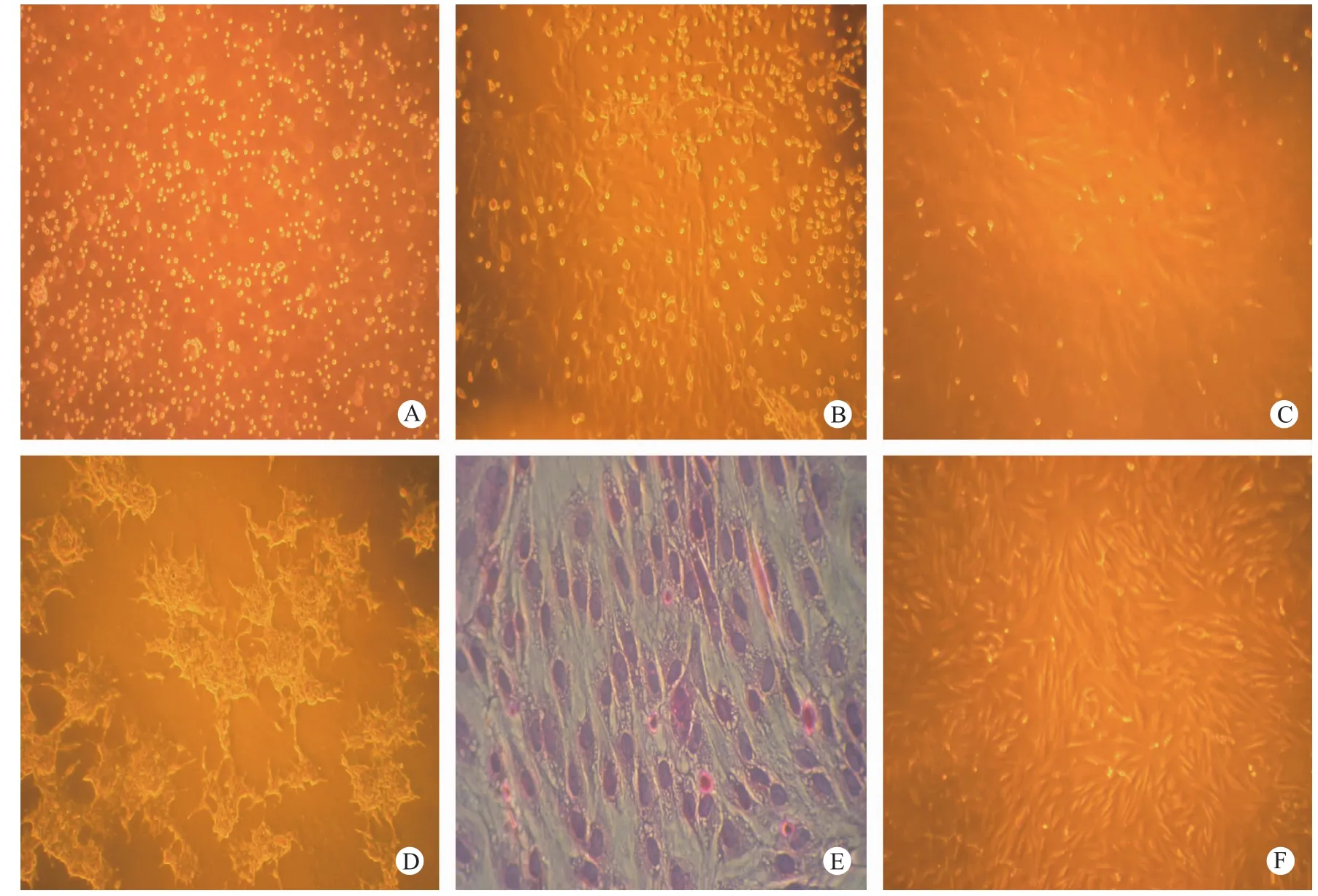
A. 0.125%胰酶消化分离的原代12 d MF胎儿MfEF;B. 12 d MF胎儿原代组织块培养第6 天;C. 12 d MF胎儿第3代MfEF培养48 h;D. 12 d MF胎儿MfEF培养第9代;E. MfEF第3代,HE染色;F. 复苏的第3代MfEF培养72 h。图1MfEF生长形态A. MfEF isolated by 0.125% tryPsin from day 12 embryo; B. MfEF cultured from day 12 embryo tissue for 6 d; C. The 3rd Passage MfEF isolated from a day 12 embryo and cultured for 48 h; D. The 9th Passage MfEF isolated from a d12 embryo; E. 3rd Passage MfEF, HE staining; F. The recovered MfEF were cultured for 72 h.Fig.1The morPhology of Microtus fortis embryonic fibroblasts at different growth stages
东方田鼠(Microtus fortis,M f)是我国日本血吸虫病流行区洞庭湖湖州广泛分布的一种优势鼠种,是迄今发现的唯一对日本血吸虫病有天然抗性的啮齿类哺乳动物[1]。从60年代初发现M f可抗日本血吸虫感染到目前人们对M f展开广泛深入的研究已近50年,但至今还没有相关M f细胞系的报道。胚胎成纤维细胞是相对容易培养的细胞系,用途广泛。建立M f胚胎成纤维细胞(Microtus fortis embryonic fibroblasts,M fEF)系,是寻求M f发挥抗日本血吸虫作用的重要基础,不仅可以缓解试验用M f的不足,而且还能深入挖掘和利用我国特有的物种遗传资源。目前,对小鼠和人胚胎成纤维细胞相关研究较多[2~5],M fEF的分离和培养尚为首次报道。M fEF有何生物学特性,是否与抗日本血吸虫作用相关,与人和小鼠胚胎成纤维细胞分离培养有何异同等都值得深入研究。本研究探讨了影响实验室M fEF分离和培养的因素,并对M fEF的生物学特性进行研究探索,为实验室分离培养M fEF细胞和深入研究M f抗日本血吸虫机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 胚胎来源:20周龄(70~80 g)怀孕东方田鼠(长江亚种人工封闭繁育第3代),中南大学湘雅医学院实验动物学部提供。
1.1.2 主要试剂:胰蛋白酶(上海生工有限公司),DMEM(低糖)培养基(invitrogen公司),新生牛血清(FBS)(杭州四季青生物工程有限公司),青霉素、链霉素购自华北制药股份有限公司;台盼蓝(Sigma公司),其余常用试剂均为国产分析纯。
1.2 方法
1.2.1 原代M fEF的培养:取妊娠6~7 d、12~13 d的孕鼠,乙醚麻醉后无菌取出子宫,用PBS漂洗3次,弃除表面血污,剪开子宫,取出带有胎膜的胚胎,用镊子撕破胎膜,取出胎鼠,剔除胎盘、胚头、内脏和四肢,无菌PBS漂洗3次,剔除可能附带的脂肪组织、被膜结缔组织、坏死组织以及红细胞,将鼠胚躯干剪成约1 mm3的碎块,放入离心管后用培养液反复吹打,静置沉淀5 min,吸取上清于培养瓶内培养,沉淀的组织块分别采用组织块贴壁法和胰蛋白酶消化法在含15%FBS、100 U/m L青霉素、100 U/m L链霉素的DMEM,37℃,5%CO2条件下培养,实时观察记录不同培养方法细胞的状态。
1.2.2 继代M fEF的培养:原代M fEF铺满培养瓶的80%~90%时,0.25%胰蛋白酶消化传代,培养条件同上。
1.2.3 不同胎龄胚胎对分离M fEF的影响:分别对6~7 d、12~13 d胎龄的M f分离培养成纤维细胞,观察不同胎龄细胞的生长状况及增殖情况。
1.2.4 不同血清浓度对M fEF生长的影响:取12~13 d胎儿的第3代M fEF接种至48孔板,每孔接种10 000个细胞,分别以10%和15%不同浓度血清培养,每种浓度重复3孔,用血球计数板每天计数取平均值,连续7 d,绘制细胞生长标准曲线。
1.2.5 传代次数对M fEF生长及传代的影响:对不同胎龄的M fEF原代培养成功后,进行继代培养,对传代次数,细胞形态变化等进行记录,照相和HE染色。
1.2.6 不同胰蛋白酶浓度对分离M fEF的影响:选择0.125%和0.25%不同浓度的胰蛋白酶在室温条件下消化12~13 d胎儿组织,观察不同酶浓度和消化时间对分离原代M fEF的影响。
1.2.7 M fEF的冻存与复苏:采用冻存体系分别为90%完全培养基+10%DMSO及90%血清+10%甘油,按常规冻存程序冻存第2和第3代M fEF,冻存2周后取出细胞复苏培养,台盼蓝染色计算细胞活率。
1.2.8 M fEF培养上清杀伤日本血吸虫童虫实验: M fEF长满培养瓶95%时,无菌收获第3和第4代M fEF培养液,2000 r/min离心10 min,取上清,以50%的浓度加到含脱尾尾蚴的24孔培养板中,尾蚴每孔100±20尾,每个样本设立平行三孔,20%浓度的M f血清为阳性对照,以小鼠胚胎成纤维细胞NIH/3T3培养上清为阴性对照,于37℃、5%CO2培养,96 h内作连续体外杀伤日本血吸虫童虫效果观察。
2 结果
2.1 M fEF生长形态观察
M fEF在体外为贴壁生长型细胞,原代培养细胞体积较小(图1,A),杂细胞较多,培养12 h后部分细胞开始贴壁,48h后大部分细胞仍悬浮于培养液中,贴壁细胞胞质向两端伸出伪足呈长梭形,细胞体积逐渐增大,边界清晰,立体感强,呈火焰状、漩涡状排列生长(图1,B),随着培养时间的延长,胞质向培养瓶底部铺展,细胞间界限模糊,无立体感,折光性强。M fEF继代培养贴壁性能极佳,传代1 h后即可牢固贴壁,传代3次后可得到较纯净的M fEF(图1,C),HE染色M fEF胞核大呈椭圆形,约占细胞体积的三分之一(图1,E)。图1见彩插8。
2.2 不同胎龄对分离M fEF的影响
实验比较了6~7 d和12~13 d胎龄对分离培养M fEF的影响,6~7 d M f的胚胎(每胚约0.1 g),组织柔嫩,采用剪碎后机械吹打即可获得单细胞悬液,不必使用胰酶消化,但原代细胞长满培养瓶需要7 d以上;12~13 d胎龄胚胎(每胚约0.4 g)宜采用胰酶消化,细胞培养4 d后即可传代培养,细胞数量多,纯度好(图1,A)。对不同胎龄胚胎组织,采用组织块贴壁法均可培养出M fEF(图1,B),细胞长满培养瓶所需天数与胚胎日龄呈反比。
2.3 不同血清浓度对M fEF生长的影响
在15%与10%血清浓度培养基中,M fEF分别在培养第2天和第3天进入指数增长期,培养第4、第5天达到生长高峰,随培养时间延长细胞逐渐衰亡,数量迅速减少,二者均没有稳定的平台期。实验表明:10%和15%血清浓度的培养基均可用于M fEF的培养,但前者M fEF增殖相对缓慢,15%血清浓度的培养基更适宜M fEF生长(图2)。
2.4 传代次数对M fEF生长的影响
对M fEF继代培养后发现:6~7 d胎龄胚胎2~5代增殖较为旺盛,约3~4 d即可传代一次,从第6代起,细胞已不能随着培养天数的增加而增殖;12~13 d胎龄胚胎2~7代增殖较为旺盛,第8代以后,细胞形态呈不规则多边形,细胞内颗粒增多,细胞间黏度增大;传至第9代时,细胞成簇叠加生长,细胞间界限模糊,胞质收缩,出现衰亡特征(图1,D)。
2.5 不同胰蛋白酶浓度对分离M fEF的影响
本实验分别采用0.125%和0.25%两种浓度的胰蛋白酶在室温条件下消化12~13 d M f胎儿组织后发现:在组织量和消化时间均相同的情况下0.125%较0.25%胰蛋白酶分离的细胞密度大,活力好,贴壁细胞多,速度快,是实验室分离M fEF合适的胰蛋白酶浓度(图1,A)。
2.6 M fEF的冻存与复苏
对10%DMSO和10%甘油冻存2周后的第2、第3代M fEF分别进行复苏培养,台盼蓝染色细胞活率均达90%以上,镜下观察,细胞不着色,折光性强,形态完整。接种培养后4 h开始贴壁,24 h后呈典型的M fEF形态,两种冻存体系在细胞活率、贴壁时间、传代时间等指标没有明显差别,都适用于M fEF的冻存(图1,F)。
2.7 M fEF培养基杀伤日本血吸虫童虫
第3和第4代M fEF培养上清液与日本血吸虫童虫共培养96 h后,童虫死亡率分别达到15.1%和 13.3%,与小鼠胚胎成纤维细胞NIH/3T3培养上清和阳性对照的童虫死亡率9.3%与45.6%相比没有明显的杀伤效果(图3)。

图2 不同血清浓度对M fEF生长的影响Fig.2 Influence of different serum concentrations on the growth of M fEF
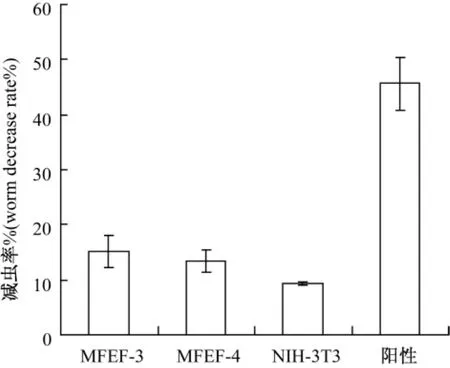
图3 M fEF培养上清与童虫共培养96 h后减虫率Fig.3 The killing effect of M fEF culture supernatant on the co-cultured schistosomulum for 96 h
3 讨论
通过对M fEF进行初步分离培养,并对M fEF的生物学特性进行观察,发现与小鼠胚胎成纤维细胞特性许多不同。与小鼠相比M fEF维持传代时间更长,而且传代次数与M f胚胎胎龄相关,胎龄越小传代次数越少,12~13 d胎龄胚胎可稳定传代8次以上;M fEF传代1 h后即可牢固贴壁,用吸管吹打不易脱落;M fEF透光性较好,长满培养瓶后镜下观察不易分辨细胞轮廓,以上特性可能由于M f与小鼠的染色体数目差别较大,种属差异有关。已报道胚胎成纤维细胞可以向培养液中分泌成纤维细胞生长因子(fibroblast grow th factor,FGF),白血病抑制因子(leukemia inhibitory factor,LIF),胰岛素样生长因子结合蛋白-4(insulin-like growth factor-binding protein 4,IGFBP-4),色素上皮衍生因子(pigment epithelium derived factor,PEDF)等诸多蛋白成分,参与信号转导、细胞外基质生成、转录调节、细胞分化与凋亡等作用[6]。基于以上考虑,我们把第3和第4代M fEF培养上清液与日本血吸虫童虫共培养后发现,与阴性对照相比M fEF培养上清液对日本血吸虫童虫有一定的杀伤作用,但杀伤效果不显著,以上结果与申群喜等[7]将日本血吸虫童虫与M f心脏、肝、肺、肾、脾和肌肉的匀浆上清液混合培养结果相一致,实验提示M f抗日本血吸虫作用的主效分子主要存在于血清中,应重点从M f血清中筛选抗性成分。M fEF系的建立可为M f的相关研究提供细胞、蛋白质、DNA、RNA样本,与活体样本相比,细胞系可以连续培养,反复冻存,便于管理和使用,而且不会因为个体遗传差异和生理状态影响实验的可重复性,还可完成如蛋白质的亚细胞定位、转基因、免疫荧光、RNA干扰等相关实验。由于M fEF不能在体外长期培养,我们已展开对M fEF永生化筛选的工作,并已取得一定进展。
(本文图1见彩插8。)
[1]刘杰生,容寿铭,陈佩玑,等.几种鼠类人工感染日本血吸虫的实验观察[J].中国血吸虫病防治杂志,1992,4(6): 350-351.
[2]Evans MJ,Kaufman MH.Establishment in culture of pluripotent cells from mouse embryos[J].Nature,1981,292(5819):156.
[3]刘民,李柏青.小鼠胚胎成纤维细胞的分离、扩增和抑制[J].中国实验动物学杂志,2002,12(4):215-219.
[4]常万存,窦忠英,高志敏.人胚胎成纤维细胞的冷冻保存[J].西北农业学报,2000,9(1):6-9.
[5]张怡,赵连三,汪成孝,等.人胚胎成纤维细胞与小鼠胚胎成纤维细胞生物学特性比较[J].生物医学工程学杂志,2003,20(2):251-254.
[6]Xie CQ,Lin G,Luo KL.Newly expressed proteins of mouse embryonic fibroblasts irradiated to be inactive[J].Biochem Biophys Res Comm,2004,315:581-588.
[7]申群喜,胡维新,许冰,等.东方田鼠组织、器官体外杀日本血吸虫童虫作用[J].湖南医科大学学报,2002,27(3):198-200.
Isolation,Culture and Biological Characteristics of Em bryonic Fibroblasts from M icrotus fortis
CHENG Gang,GAI Nan,XIONG De-hui,HU Wei-xin
(Molecular Biology Research Center,School of Biological Science and Technology,Central South University,Changsha 410078,China)
ObjectiveThe aim of this study was to isolate,culture,and characterize embryonic fibroblasts from Microtus fortis(M fEF).M ethods The primary embryonic fibroblasts were isolated from Microtus fortis fetus at different gestational ages.According to the influence of different serum and trypsin concentrations and different gestational ages,the growth behavior and the biological characteristics of M icrotus fortis embryonic fibroblasts(M fEF)were studied.ResultsThe M fEF in vitro appeared as adherent cells with good ability for proliferation in passages 2-7.The optimal gestational age for isolation of M fEF was from day 12 to 13.At the temperature of 20℃to 25℃,the optimal time for digestion of fetal tissue to obtain fibroblasts was 5 min with a digestion solution containing 0.125%of trypsin.The M fEF were cultured in DMEM(low glucose)supp lemented with 15%FBS.ConlusionEmbryonic fibroblasts of M icrotus fortis have been successfully isolated and cultured,which lay the foundation for further studies on Microtus fortis against Schistosma japonicum infection and for comparative study of fibroblasts between different animals.
M icrotus fortis;Embryonic fibroblasts;Biological characteristics
Q25
A
1005-4847(2010)03-0254-04
2009-11-2
湖南省研究生科研创新项目资助(No.2340-74236000001)。
成钢(1976-),男,讲师,博士研究生,研究方向:东方田鼠抗日本血吸虫抗性相关基因筛选。E-mail addresses:chenggang876@ 126.com
胡维新(1950-),男,教授,博士生导师。E-mail addresses:weixinhu@yahoo.com.cn

