羊骨酶解发酵液钙鳌合物对骨质疏松大鼠骨密度和骨代谢生化指标的影响
霍乃蕊,马俪珍,忻欣,孔保华,陈红芳,卢军
(1.山西农业大学食品科学与工程学院,太谷 030801;2.天津农学院食品科学系,天津 300384; 3.东北农业大学食品学院,哈尔滨 1500302)
研究报告
羊骨酶解发酵液钙鳌合物对骨质疏松大鼠骨密度和骨代谢生化指标的影响
霍乃蕊1,马俪珍2,忻欣3,孔保华3,陈红芳2,卢军3
(1.山西农业大学食品科学与工程学院,太谷 030801;2.天津农学院食品科学系,天津 300384; 3.东北农业大学食品学院,哈尔滨 1500302)
目的探讨羊骨酶解发酵液钙螯合物(SBEF-Ca)对雌激素缺乏造成的骨质疏松的防治作用。方法
40只3.5 月龄的Sprague-Daw ley大鼠,按体重随机分为正常组(假手术+蒸馏水)、模型对照组(去卵巢+蒸馏水)和高、中、低3个剂量组(去卵巢+SBEF-Ca)。术后12 d,持续灌胃11周后,测定股骨密度、长度以及血清中反映骨代谢的主要生化指标。结果模型对照组大鼠股骨密度和长度显著减小,各剂量组均可扭转这种减小趋势并使股骨密度和长度维持在正常组水平,其中高剂量组的股骨密度显著大于中、低剂量组;各剂量组的股骨长度差异不显著;所有大鼠的血Ca、血P水平差异无显著性;模型对照组的血清碱性磷酸酶(ALP)、骨钙素(BGP)水平明显升高,而各剂量组的ALP、BGP水平与正常组差异不显著,且高剂量组ALP水平显著低于中、低剂量组,中、高剂量组的BGP水平(P>0.05)显著低于低剂量组。结论低、中、高剂量的SBEF-Ca对绝经后骨质疏松症有预防作用。
羊骨酶解发酵液;去卵巢大鼠;骨密度;生化指标

注: A为正常子宫(左)和去卵巢大鼠子宫(右);B依次为低、中、高剂量组大鼠子宫图1 各组大鼠的子宫形态Note: Picture A shows the uteri of a normal grouP rat (left) and model grouP rat (right); Picture B shows the uteri from rats of low-dose, medium-dose and high-dose grouPs in sequence.Fig.1The gross aPPearance of the uteri in the rats of different grouPs
近20年来的研究证实了Ca在许多疾病防治中潜在作用,这些疾病包括骨质疏松、高血压、结肠癌、乳腺癌、肾结石、卵巢癌、经前综合征、多囊性卵巢综合征,胰岛素抵抗综合征、肥胖症以及铅中毒等[1]。钙质缺乏是全球性问题,我国尤为严重[2]。
骨质疏松症是一种复杂的,由多种因素引起的以骨量减少,骨微观结构退化,脆性增加以及易于发生骨折为特征的一种非特异性骨代谢障碍疾病[3]。骨质疏松的发生与低钙摄入有关[1]。骨质疏松对发病率和死亡率的影响巨大[4]。中年期,骨吸收大于骨形成,骨量持续丢失,妇女在绝经后的5~15年由于雌激素分泌减少,骨量减少尤为突出[3]。在美国,骨质疏松已达到了流行的比例[5]。
我国是世界畜产大国,畜骨资源丰富,但缺乏深度开发利用。骨的营养价值很高,骨骼中80%~90%的矿物质为Ca和P[5]。占骨骼总蛋白90%的胶原蛋白呈三螺旋结构,生物利用度很低,酶解可将其水解为极易被机体吸收的小分子多肽,而使其生物利用度大幅提高。蛋白肽的制备方法有生物提取、酸碱水解、化学合成、酶法生产和发酵提取法。酶解法是目前生产活性肽的最主要的方法,发酵提取法兼有酸解、酶解和生物转化的共同作用,可以有效增加蛋白质水解率和骨钙的转化率,目前较多用于补钙剂的开发[6]。
去卵巢大鼠模型一直用于绝经后骨质疏松症的研究,利用老龄大鼠和成年大鼠均可建立骨质疏松模型。利用这个模型,筛选出了许多治疗骨质疏松的有效药物或疗法,包括雌激素、雌激素受体调节剂、双磷酸盐、降钙素、合成类固醇[7]等。上述各种药物虽可有效预防和治疗绝经后骨质疏松和降低骨折的危险性,但具有一些不可避免的不良反应[8]。因此安全的、无毒副作用的,可以长期使用的骨质疏松防治药物或钙制剂的开发具有现实意义。
本研究联用酶解和发酵方法,制备羊骨酶解发酵液钙螯合物(sheep bone enzymatic fermentationcalcium chelate,SBEF-Ca),以卵巢摘除大鼠为骨质疏松模型,研究SBEF-Ca对骨代谢、骨密度等的影响,探讨SBEF-Ca对雌激素缺乏引起的骨质疏松症的防治作用,为畜骨的深度开发利用、安全的补钙保健产品或食品添加剂的开发和商品化生产提供可靠的依据。
1 材料与方法
1.1 实验动物及分组
40只未交配过的健康雌性SD大鼠,3.5月龄,体质量250~280 g,遗传背景明确,来源于中国医学科学院放射医学研究所实验动物中心【SCXK(京) 2005-0001】,使用时遵循减少、替代和优化的3R原则。每饲养箱5只,环境温度(24±2)℃,相对湿度40%~60%,光照为12 h光/12 h暗,自由采食和饮水。饲料为天津市华荣实验动物科技有限公司提供的基础饲料。按体重随机分为5组(每组8只):正常组(假手术);模型对照组(去卵巢)和高、中、低剂量组(去卵巢并灌喂SBEF-Ca)。麻醉后由腰椎旁两侧切口入腹腔,用镊子将卵巢牵拉至腹腔外,正常组将卵巢牵拉后再送回,其余大鼠均结扎去除双侧卵巢,切口局部涂碘伏后止血缝合。术后康复12 d,给予各组大鼠不同的处理,连续11周。正常组和模型对照组灌胃给予蒸馏水[10 m L/(kg·d),ig];各剂量组以同样方式给予SBEF-Ca:高剂量组[5000 mg/(kg·d),ig];中剂量组[3000 mg/(kg·d),ig];低剂量组[1000 mg/(kg·d),ig]。
1.2 SBEF-Ca制备
新鲜羊骨洗净、高压、去油、烘干、粉碎,用胃蛋白酶酶解:酶添加量为1900 U/g,骨粉底物浓度0.2 kg/L,pH 3.0,37℃酶解6 h后,90℃灭酶10 m in。冷却至室温,添加葡萄糖(3.93%),植物乳杆菌和戊糖片球菌(1∶1)的接种比例为8.7%,发酵18.9 h。发酵后离心,喷雾干燥,制得SBEF-Ca。经测定其中的粗蛋白含量为42.4%,钙含量为21.1%,总糖含量为8.06%,灰分(不包括Ca)为10.9%。使用时以蒸馏水将样品分别配成500、300、100 mg/m L的溶液,然后按照10 m L/(kg·d)分别给予高、中、低三组实验动物。
1.3 观察指标及方法
1.3.1 一般指标:实验开始后每日观察动物的一般情况,如食欲、精神状态、死亡情况等,每周称一次体重。
1.3.2大鼠子宫形态的观察:第90天,处死大鼠,取出子宫进行形态比较和称重。
1.3.3 血清生化指标:第90天,各组大鼠经股动脉采血,离心制备血清,用试剂盒(南京建成生物工程研究所)测定其中的Ca、P、碱性磷酸酶(alkaline phosphatase,ALP)、骨钙素(bone gla protein,BGP)水平。
1.3.4 股骨物理量的测定:一侧股骨用双能X线骨密度仪测定其密度;另一侧用游标卡尺测定长度。
1.4 统计学处理方法
所有数据以均数±标准差表示,采用SPSS10.0统计软件包进行方差分析。组间比较采用LSD法(least significant difference)。
2 结果
2.1 一般观察
受试大鼠在实验期间生长发育状况良好;模型对照组在去卵巢40 d后出现明显烦躁不安、多动等症状。
2.2 子宫形态变化
从图1可以看出:与正常组相比,模型对照组子宫明显萎缩(图A),而补充了SBEF-Ca的低、中、高剂量组的子宫(图B),其重量和大小明显大于模型对照组子宫。图1见彩插4。
2.3 各组大鼠的股骨密度和长度见表1。
表1 各组大鼠的股骨密度和长度(±s,n=8)Tab.1 Femur density and length of tested rats(±s,n= 8)
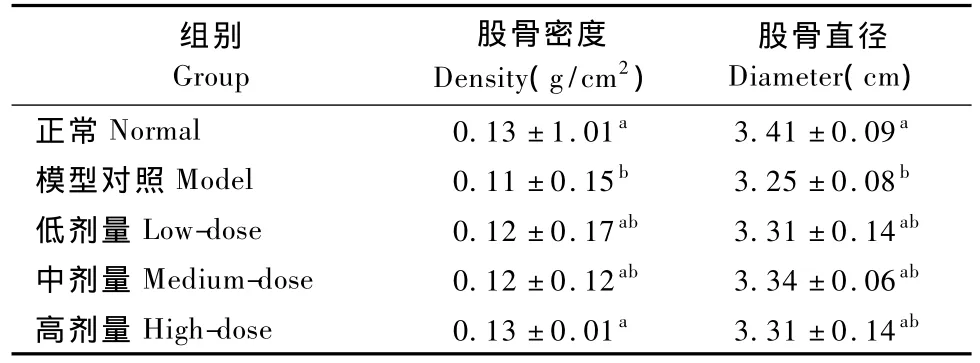
表1 各组大鼠的股骨密度和长度(±s,n=8)Tab.1 Femur density and length of tested rats(±s,n= 8)
注:相同字母代表组间比较差异无显著性(P>0.05),不同字母代表组间比较差异有显著性(P<0.05),其他表格相同。Note:The same letter means no significant difference(P>0.05),and vice versa(P<0.05).The same in other tables.
组别Group股骨密度Density(g/cm2)股骨直径Diameter(cm)正常Normal 0.13±1.01a3.41±0.09a模型对照Model 0.11±0.15b3.25±0.08b低剂量Low-dose 0.12±0.17ab3.31±0.14ab中剂量Medium-dose 0.12±0.12ab3.34±0.06ab高剂量High-dose 0.13±0.01a3.31±0.14ab
由表1可知,摘除卵巢可使大鼠股骨密度显著减小(模型对照组与正常组相比,P<0.05)。各剂量组大鼠的股骨密度与正常组相比差异无显著性,且高剂量组的股骨密度显著高于模型对照组和低、中剂量组。说明SBEF-Ca可抑制卵巢摘除造成的股骨密度降低趋势,并使其维持在正常水平,并且高剂量SBEF-Ca的效果优于低、中剂量。同理,卵巢摘除造成模型大鼠的股骨长度显著变短,而SBEFCa可扭转这种变短的趋势,并使股骨长度维持在正常水平,但各剂量组之间差异不显著。因此卵巢摘除使大鼠股骨密度降低,长度变短,骨量减小,导致骨质疏松,而补充SBEF-Ca,可有效防止骨质疏松的发生。
2.4 血清生化指标测定结果
2.4.1 血钙、血磷测定结果:由表2结果显示,各组大鼠的血Ca和血P水平与正常组相比,差异不显著,故卵巢摘除和SBEF-Ca对血钙和血磷水平没有影响。
表2 各组大鼠的血钙和血磷水平(±s,n=8)Tab.2 The serum Ca,P levels of the rats(±s,n=8)

表2 各组大鼠的血钙和血磷水平(±s,n=8)Tab.2 The serum Ca,P levels of the rats(±s,n=8)
组别Groups血钙serum Ca(mmol/L)血磷Serum P(mmol/L)正常Normal 1.60±0.19a1.46±0.34a模型对照Model 1.79±0.98a1.49±0.14a低剂量Low-dose 1.77±0.23a1.37±0.26a中剂量Medium-dose 1.70±0.10a1.26±0.26a高剂量High-dose 1.62±0.07a1.50±0.10a
2.4.2 ALP、BGP测定结果:从表3可以看出,模型对照组血清ALP水平显著高于正常组;中、低剂量组ALP水平与模型对照组相比有降低趋势,并趋近正常组水平(P>0.05);高剂量组ALP水平则显著低于模型对照组和中、低剂量组,并与正常组相比差异无显著性;可见卵巢摘除会引起大鼠ALP水平显著增加,各剂量的SBEF-Ca均可使ALP水平下降到正常水平,并且高剂量组的效果要优于低、中剂量组。
同理,卵巢摘除也使血清BGP水平显著升高;而各剂量组都保持在正常水平,并且高、中剂量组的效果(P>0.05)要优于低剂量组。
表3 大鼠血清中的碱性磷酸酶水平和骨钙素水平(±s,n=8)Tab.3 The serum ALP and BGP levels in the rats(±s,n=8)
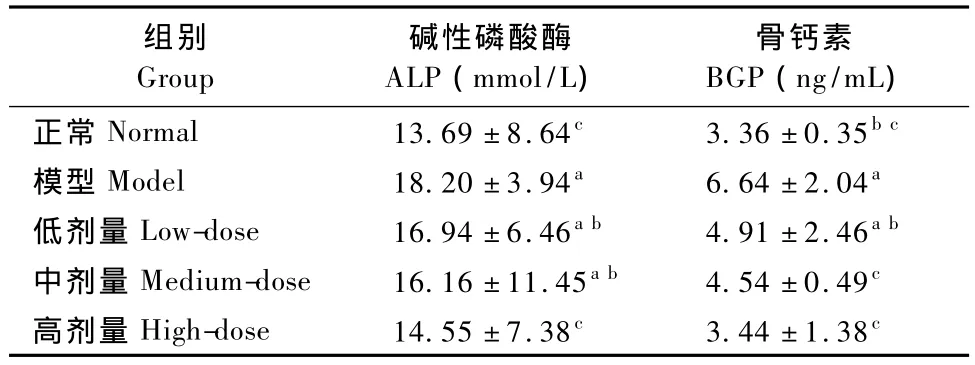
表3 大鼠血清中的碱性磷酸酶水平和骨钙素水平(±s,n=8)Tab.3 The serum ALP and BGP levels in the rats(±s,n=8)
组别Group碱性磷酸酶ALP(mmol/L)骨钙素BGP(ng/mL)正常Normal 13.69±8.64c3.36±0.35bc模型Model 18.20±3.94a6.64±2.04a低剂量Low-dose 16.94±6.46ab4.91±2.46ab中剂量Medium-dose 16.16±11.45ab4.54±0.49c高剂量High-dose 14.55±7.38c3.44±1.38c
3 讨论
3.1 骨质疏松动物模型的复制
雌二醇在骨代谢过程中发挥重要作用,具有抑制破骨细胞活性,减少骨吸收,促进骨形成和骨生长的作用。卵巢摘除后,大鼠体内雌激素骤然缺乏,导致破骨细胞溶解骨质形成骨洞的作用超过成骨细胞形成骨质填充骨洞的作用,引起骨质疏松。骨质疏松的诊断以骨密度减小为主要依据。大鼠切除卵巢后,股骨密度降低尤为明显[9]。本研究大鼠去卵巢后90 d时,模型对照组大鼠股骨骨密度显著低于正常组。雌激素直接影响子宫重量,子宫萎缩是卵巢成功切除的典型标志[10],本研究中模型对照组子宫明显萎缩,子宫重量也显著减小,说明动物骨质疏松模型复制成功。
3.2 反映骨代谢的生化指标
钙、磷平衡受甲状旁腺素(PTH)、降钙素(CT)、VD等多种因素的调节和控制。本研究建立了骨质疏松模型并证实了SBEF-Ca对骨质疏松的防治作用,但各组大鼠的血Ca和血P水平差异不显著,故血清Ca、P水平不能作为反映骨代谢的特异性指标。
成骨细胞分泌ALP并释放入血,当肝和胎盘等功能正常时,血清ALP可作为骨形成的有效特异性指标。血清BGP是由非增殖期成骨细胞特异合成和分泌的一种非胶原骨蛋白,其主要功能是维持骨的正常矿化速率,抑制异常的羟基磷灰石结晶的形成,是反映骨更新(骨形成和骨再建)的一项特异性生化指标。一般认为ALP的升高是伴随着骨吸收的亢进而出现的代偿性骨形成增加引起的。模型对照组ALP和BGP水平明显升高,说明骨吸收亢进,骨更新加速,代偿性骨形成增加;补充SBEF-Ca后,伴随着骨密度恢复到正常水平,ALP和BGP水平也恢复到正常水平,故而ALP和BGP可作为反映骨代谢的特异性指标。
3.3 SBEF-Ca对骨质疏松的防治作用
本研究证实SBEF-Ca可有效抑制和扭转绝经后骨质疏松症的发生和病变进程。其作用与雷诺昔酚(raloxifene,RAL)、三苯氧胺(tamoxifen,TAM)以及萘氧啶(nafoxidine,NAF)相似,Sato等[11]发现这三种雌激素受体调节剂具有阻止去卵巢大鼠骨密度降低的作用并呈剂量依赖关系。SBEF-Ca对骨密度的影响虽无剂量依赖性,但高剂量组的防治作用显著优于低剂量组和中剂量组。RAL不增加去卵巢大鼠的子宫重量,而雌激素和TAM则使去卵巢大鼠的子宫重量显著增加[12,13]。Hidaka等[7]报道蜂王浆(royal jelly,RJ)和蛋白酶处理过的蜂王浆(pRJ)能有效防治骨质疏松,其效果可与17β-雌二醇相比,其机制为促进了肠道对钙的吸收,而不是通过对PTH的直接拮抗作用。与本研究不同的是,RJ和pRJ都没有使子宫重量增加,说明二者对雌激素和雌激素受体的活性没有影响[7]。SBEF-Ca使去卵巢大鼠子宫重量明显增加,因而其对骨质疏松的防治机理除促进肠道对钙的吸收外,还可能同时改变了雌激素或雌激素受体的活性[14],或者其中含有雌激素样的活性肽。
Hidaka等[7]用蛋白酶水解RJ是为了促进肠道对Ca的吸收,结果证实pRJ的骨质疏松防治效果优于RJ。大量研究证实蛋白质并非在肠道内彻底分解为游离氨基酸才被人体吸收利用,大多是以小肽形式消化吸收,而以游离氨基酸形式吸收的比例很小,并且小肽的吸收比游离氨基酸的吸收更为迅速。SBEF-Ca中,蛋白肽含量约为42.4%,钙含量为21.1%,并且大部分为氨基酸螯合钙的形式。在其制备过程中植物乳杆菌和戊糖片球菌发酵使羊骨胶原的胃蛋白酶水解产物进一步水解,并可吸收再利用产生的游离氨基酸。短肽中的丝氨酸磷酸和氨基酸能够选择性地与Ca结合,提高了Ca的生物利用度并有助于Ca的肠道转运和吸收。
钙的充足摄入并不能有效预防骨质疏松的发生,还需要有骨胶原的补充,因为骨组织是由骨基质和骨矿物质构成的复杂有机体,80%~90%的骨矿物质为钙和磷,骨基质主要是骨胶原蛋白[5]。Jung等[15]利用酶法制备的钙螯合肽有效提高了去卵巢大鼠对钙的生物利用率。营景颖[16]也证实胶原多肽螯合钙是一种优良的功能性补钙制剂,其壮骨作用以及对骨质疏松的防治作用均优于葡萄糖酸钙和碳酸钙。
王玲[17]研究表明:高浓度的强骨丸有明显抑制骨吸收的作用,低浓度的强骨丸抑制效果不显著。本实验参照此实验设计不同灌胃剂量,并且低剂量的SBEF-Ca(1000 mg/kg·d,ig)对骨质疏松就具有了防治作用。
3.4 SBEF-Ca的安全性
目前各种骨质疏松防治药物安全性引起人们的担忧。双磷酸盐可引起肠胃不适和消化不良以及下颌骨易碎。激素替代疗法增加了某些癌症的患病风险,以及容易引起中风和脑血栓,其使用风险要远远高于人们所预想。雌激素受体调节物虽没有严重不良反应,但同降钙素和特立帕肽一样,只能减少脊柱裂,而不能减少股骨骨裂和其他类型的骨裂。每日服用雷洛昔芬容易引起流感综合征、潮红、腿痛性痉挛、外周性水肿等,并且引起高发血栓栓塞性疾病的发病率与雌激素替代疗法相似[18]。各种药物的临床研究还不充分和完善,在药物剂量、用药方案及人群选择方面都值得进一步探讨。理论上,各种疗法的联用将起到协同作用,然而,明胺丁羟磷酸盐会降低特立帕肽的疗效,故这两种药物不能同时使用[19],其他药物能否联用,需要深入研究。
SBEF-Ca制备时,原料为羊骨,加工方式为安全的蛋白酶酶解和微生物发酵,因而是一种天然、安全、有效的制剂,无毒副作用,可替代其他疗法用于骨质疏松的长期防治。
(本文图1见彩插4。)
[1]Nicklas TA.Calcium intake trends and health consequences from childhood through adulthood[J].J Am Coll Nutr,2003,22 (5):340-356.
[2]田惠光,张兵.保健食品实用指南[M].北京:化学工业出版社,2002.19-25.
[3]Ilich JZ,Kerstetter JE.Nutrition in bone health revisited:A story beyond calcium[J].J Am Coll Nutr,2000,19(6):715-737.
[4]Karly AH,Anisa SF,Sheryl LG,et al.New therapies for osteoporosis[J].J Pharm Pract,2009,22(1):53-64.
[5]Looker AC,Orwoll ES,Johnston Jr CC,et al.Prevalence of low femoral bone density in older U.S.adults from NHANES III[J]. J Bone Miner Res,1997,12:1761-1768.
[6]程云辉,文新华.生物活性肽制备的研究进展[J].食品与机械,2001,84(4):4-7.
[7]Hidaka S,Okamoto Y,Uchiyama S,et al.Royal jelly prevents osteoporosis in rats:beneficial effects in ovariectomy model and in bone tissue culture model[J].eCAM,2006,3(3):339-348.
[8]Qaseem A,Snow V,Shekelle P,et al.Pharmacologic treatment of low bone density or osteoporosis to prevent fractures:a clinical practice guideline from the American college of physicians[J]. Ann Intern Med,2008,149(6):404-415.
[9]陈东,王连唐,陈国栋.去卵巢后大鼠不同部位的骨组织计量学与骨密度研究[J].中国骨质疏松杂志,2002,8(3): 208-210.
[10]Hidaka S,Okamoto Y,Nakajima K,et al.Preventive effects of traditional Chinese(Kampo)medicines on experimental osteoporosis induced by ovariectomy in rats[J].Calcif Tissue Int,1997,61:239-246.
[11]Sato M,Rippy MK,Bryant HU.Raloxifene,tamoxifen,nafoxidine,or estrogen effects on reproductive and nonreproductive tissues in ovariectomized rats[J].FASEB J,1996,10(8):905-912.
[12]Sato M,Zeng GQ,Rowley E,et al.LY353381·HCl:An improved benzothiophene analog with bone efficacy comp lementary to parathyroid hormone-(1-34)[J]. Endocrinology,1998,139(11):4642-4651.
[13]Curiel MD,Calero JA,Guerrero R,et al.Effects of LY-117018 HCl on bone remodeling and mineral density in the oophorectomized rat[J].Am J Obstet Gynecol,1998,178(2): 320-325.
[14]Clark RC,Tarttelin MF.Some effects of ovariectomy and estrogen rep lacement on body composition in the rat[J].Physiol Behav,1982,28(6):963-969.
[15]Jung WK,Lee BJ,Kim SK.Fish-bone peptide increases calcium solubility and bioavailability in ovariectomized rats[J].Br J Nutr,2006,95(1):124-128.
[16]营景颖.胶原多肤鳌合钙的制备及其壮骨、骨质疏松防治作用研究[D].河北农业大学,2008.
[17]王玲,哈孝贤,于顺禄.强骨丹对去卵巢大鼠骨质疏松预防作用的实验研究[J].天津中医药,2004,21(5):398-401.
[18]Hulley S,Grady D,Bush T,et al.Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women.Heart and Estrogen/progestin Replacement Study(HERS)Research Group[J].JAMA,1998,280(7):605-613.
[19]Khosla S.Parathyroid hormone plus alendronate—a combination that does not add up[J].N Engl J Med,2003,349(13):1277-1279.
Effect of SBEF-Ca on Bone M ineral Density and Biochem ical Param eters of Bone M etabolism in Rats w ith Osteoporosis
HUO Nai-rui1,MA Li-zhen2,XIN Xin3,KONG Bao-hua3,CHEN Hong-fang2,LU Jun3
(1.Faculty of Food Science and Engineering,Shanxi Agricultural University,Taigu 030801,China; 2.Food Science Department,Tianjin Agricultural College,Tianjin 300384; 3.Food Science department,Northeast Agricultural University,Haerbin 1500302)
Objective The purpose of this study was to investigate the preventive and therapeutic role of sheep bone enzymatic fermentation-calcium chelate(SBEF-Ca)against osteoporosis.M ethods Forty 3.5-month-old Sprague-Daw ley rats were random ly divided into normal group(sham+water,ig),model control group(ovariectomized+water,ig),and three dosage groups(ovariectomized+SBEF-Ca,ig).From 12 days after ovariectomy,the rats were treated with water or SBEF-Ca intragastically,respectively,for 11 weeks.Then the femoral bone mineral density(BMD)and femoral length,as well as the main parameters of bone metabolism were measured.ResultsBoth the femoral BMD and the length were significantly decreased in the model control group,and all the dosage groups reversed the declining tendency and brought them to the level of normal group.BMD of the high-dosage group was markedly higher than that of model group and the other two dosage groups.There were no statistically significant differences in the femur length among dosage groups.The serum Ca and P levels of all rats had no significant differences.An apparent rise of alkaline phosphatase(ALP)and bone gla protein(BGP)occurred in the model control group,but these two parameters of all dosage groups had no significant differences compared with those of the normal group(P<0.05).ALP level of the highdose group was significantly lower than that of the low and medium dosage groups.The BGP levels of the medium and highdosage groups were significantly lower than that of the low dose group.ConlusionAll the low,medium and high dosages of SBF-Ca show preventive effect on the occurrence of postmenopausal osteoporosis in rats.
Sheep bone enzymatic fermentation-calcium chelate;Ovariectomized rats;Bone m ineral density; Biochem ical parameters
R151.4+1
A
1005-4847(2010)03-0216-05
2009-10-26
山西省回国留学人员科研资助项目(2009038);天津市科技攻关项目(No.05ZHGCNC00100)。
霍乃蕊(1972-),女,博士,副教授;研究方向:生物工程。E-mail:tgnrhuo@163.com;
马俪珍,E-mali:malizhen-6329@163.com

