hIL-15-SA双功能融合蛋白的制备
余宏盛,严耀明,茅奇峰,高基民
(1.温州医学院 浙江省模式生物技术与应用重点实验室,浙江 温州 325035;2.深圳第三人民医院,广东 深圳 518020)
hIL-15-SA双功能融合蛋白的制备
余宏盛1,严耀明2,茅奇峰1,高基民1
(1.温州医学院 浙江省模式生物技术与应用重点实验室,浙江 温州 325035;2.深圳第三人民医院,广东 深圳 518020)
目的:对双功能融合蛋白hIL-15-SA的发酵及纯化工艺进行研究。方法:采用发酵罐高密度发酵hIL-15-SA工程菌,通过镍柱亲和层析及阴离子交换层析纯化目的蛋白。免疫印迹分析产物,淋巴细胞增殖试验以及细胞锚定试验检测双功能融合蛋白hIL-15-SA的生物学活性。结果:采用半合成培养基,以3%的接种量,pH值为7.2发酵可得到湿菌47 g/L,21.15 g/L包涵体。经纯化后目的蛋白纯度为97%。细胞增殖试验和细胞表面锚定修饰试验表明,经纯化复性的hIL-15-SA融合蛋白具有双重生物活性。结论:本研究获得了高产量、高纯度的hIL-15-SA双功能融合蛋白,为后续的体内生物学功能研究奠定了基础。
白细胞介素15;链亲和素;融合蛋白;中试工艺
利用基因修饰或细胞表面锚定修饰技术将具有免疫调节作用的细胞因子修饰肿瘤细胞制成肿瘤疫苗是目前研究的热点。白细胞介素-15(interleukin-15,IL-15)是一种重要的免疫调节因子,其生物学效应与IL-2相似,能刺激T细胞、B细胞、NK细胞的增殖和分化[1-2]。链亲和素(streptavidin,SA)是由亲和素链霉菌产生的非糖基化同源四聚体蛋白。它能与生物素非共价紧密结合,由于链亲和素可与生物素快速且几乎不可逆的超强结合[3],以及生物素较容易参入各种生物分子(如蛋白质,核酸和脂多糖)中,即生物素化,故链亲和素-生物素间的强力作用可用于生物医学的许多领域[4-5]。我们利用细胞表面易于生物素化和链亲和素与生物素间特异高效且超强的结合这两个特性,研制了hIL-15-SA双功能融合蛋白,通过链亲和素与表面已生物素化的肿瘤细胞的高效结合,将hIL-15锚定在肿瘤细胞表面,制成hIL-15表面锚定修饰的肿瘤细胞疫苗。
本研究在已成功克隆、表达及实验室小规模制备hIL-15-SA双功能融合蛋白的基础上,采用发酵罐发酵生产,镍柱亲和层析及阴离子交换层析纯化,初步研究了hIL-15-SA双功能融合蛋白的中试制备工艺,并对所制备蛋白进行了双功能的检测。
1 材料和方法
1.1 材料
1.1.1菌株与试剂:大肠杆菌BL21(DE3)、质粒pET21a-hIL15-SA-6His均由本实验室保存;IPTG、氨苄西林、氯霉素、免疫印迹以及MTT检测试剂盒均购自碧云天生物技术研究所。Ni-NTA、DEAE层析柱及填料购自美国GE公司,低分子量蛋白标准品购自大连Takara。
1.2 方法
1.2.1工程菌的筛选:将质粒pET21a-hIL-15-SA转化BL21(DE3)感受态细胞,涂布于LB平板(含50μg/mL氯霉素,50μg/mL氨苄霉素),挑取单克隆菌落于5 mL LB培养基中37 ℃培养,IPTG诱导表达。SDSPAGE电泳鉴定,凝胶扫描分析仪分析,取表达量最高的菌株作为发酵用菌种。
1.2.2hIL-15-SA工程菌的发酵:将筛选得到的菌株接种于LB培养基中培养,制备用于发酵的二级种子,以3%接种量接种于发酵罐中,采用半合成培养基成分:20 g/L蛋白胨,40 g/L酵母抽提物,3 g/L硫酸镁,4 g/L磷酸二氢钠,12 g/L磷酸氢二钠,5 mL/L甘油。通过0.1 mol/L NH3·H2O和0.1 mol/L HCl控制发酵过程的pH值在7.2左右,溶氧量30%,通气量调至6~8 L/min。在37 ℃,500 r/min条件下发酵生产,并添加补料培养基1 L(60 g/L蛋白胨,30 g/L酵母抽提物,6 g/L硫酸镁,4 g/L磷酸二氢钠,12 g/L磷酸氢二钠,40 mL/L甘油),0.3 mmol/L IPTG进行诱导表达。整个发酵过程持续11 h(细菌生长期6 h,诱导期5 h)。
1.2.3hIL-15-SA融合蛋白的纯化:10000 r/min,4 min离心集菌,细胞裂解液(50 mmol/L Tris-HCl,1 mmol/L EDTA,10 mmol/L NaCl pH 8.0)重悬菌体,压力破碎仪破碎细胞。离心收集包涵体-20 ℃保存备用或直接进行纯化制备。
①镍柱亲和层析:8 M尿素,4 ℃搅拌过夜溶解包涵体,离心取上清并于0.22μm滤器过滤后用平衡液(6 mol/L urea,5 mmol/L β-ME,20 mmol/L Tris-HCl,pH 8.4)稀释1倍为上柱前样品。包涵体首先通过Ni-NTA(30 mL,GE公司)亲和层析,通过AKTA纯化仪(美国GE)控制流速在1 mL/min。分别用0,30和100 mmol/L咪唑洗脱目的蛋白。洗脱流速2 mL/min。
②DEAE离子交换层析:将经过Ni-NTA纯化的目的蛋白,进行DEAE离子交换层析,平衡液(6 mol/L urea,20 mmol/L Tris-HCl,pH 8.4)平衡3~5倍柱床体积,并分别用0、50、70、200 mmol/L NaCl洗脱液洗脱。SDS-PAGE分析鉴定产物。
1.2.4hIL-15-SA融合蛋白的复性:将纯化的融合蛋白hIL-15-SA进行梯度尿素透析复性,透析液分别为A(4 mol/L urea,0.2 mol/L NaCl,0.2 mmol/L GSSG,1 mmol/L GSH,20 mmol/L Tris-HCl,pH 8.2);B(2 mol/L urea,0.2 mmol/L GSSG,1 mmol/L GSH,20 mmol/L Tris-HCl,10% glycerine pH 8.2);C(5% glycerine,20 mmol/L Tris-HCl,pH 8.2);D(20 mmol/L Tris-HCl,pH 8.2)和E(PBS),每种透析液透析8 h,每4 h换液一次,复性后蛋白经非还原性SDS-PAGE以及免疫印迹分析鉴定。
1.2.5Western blot:用12% SDS-PAGE电泳,鉴定表达产物的分子量。SDS-PAGE电泳结束后,转移蛋白至PVDF膜上,用含有5%脱脂牛奶的TBST缓冲液封闭2 h。加鼠抗hIL-15一抗4 ℃过夜,用TBST充分清洗3~4次后,加二抗Goat anti-Mouse IgG(1:1000稀释)孵育1 h,最后,用DAB显色液作用1~2 min,直至条带出现。
1.2.6hIL-15-SA双功能融合蛋白的活性检测:
①淋巴细胞增殖试验:取小鼠脾脏,分离鼠淋巴细胞,按每孔1×106/mL细胞密度100μL接种于96孔板。空白组为ConA(5μg/mL)刺激的淋巴细胞。将复性的hIL-15-SA融合蛋白作倍比稀释加入培养板中,每个浓度设3个复孔 (以hIL-15标准品作对照),37 ℃、5% CO2中培养48 h后MTT法检测依赖于IL-15的淋巴细胞增殖情况。
②细胞表面锚定修饰试验:取生长状态良好的RM-1细胞,酒精灭活调整细胞数为5×106/mL,加入Sulfo-NHS-LC-LC-Biotin使终浓度为1 mg/mL,室温作用1 h左右;加入经复性的hIL-15-SA融合蛋白置室温1 h,PBS洗3次;然后加入鼠抗hIL-15抗体于37 ℃孵育1 h,最后加入FITC标记的山羊抗小鼠Ig G二抗1μL室温避光作用30 min,PBS洗3次后,每管取500μL经流式细胞仪检测分析。
1.2.7hIL-15-SA融合蛋白的含量测定:参见文献[6]进行。
2 结果
2.1 工程菌发酵结果采用发酵罐,应用半合成培养基,以3%的接种量接种种子菌,发酵过程中pH值控制在7.2左右,溶氧量30%。工程菌活化6h,IPTG诱导5h。发酵可得到工程菌湿重47 g/L。见表1、图1。

表1hIL-15-SA融合蛋白的制备过程

图1SDS-PAGE鉴定融合蛋白hIL15-SA的表达、纯化和复性
2.2 hIL-15-SA融合蛋白的分离纯化包涵体洗涤后经过Ni-NTA亲和层析,杂蛋白在30 mmol/L咪唑洗脱出,目的蛋白100 mmol/L咪唑浓度下被洗脱,经Ni柱纯化后,纯度达到65.3%(见表1)。同时,收集100 mmol/L咪唑洗脱蛋白再经DEAE离子交换层析,最终目标蛋白在200 mmol/L NaCl浓度下被洗脱,纯度达到97%(见图1-2)。

图2免疫印迹鉴定hIL15-SA融合蛋白
2.3 hIL-15-SA双功能融合蛋白的活性检测该融合蛋白的生物学活性包括hIL-15和SA的生物学活性。经ConA刺激后的小鼠脾细胞,在加入复性后的不同浓度的hIL-15-SA双功能融合蛋白后,脾细胞的增殖与融合蛋白的浓度呈剂量依赖关系(见图3)。同时,用FITC标记的二抗,经流式细胞仪对锚定在已生物素化的RM-1前列腺癌细胞表面的hIL-15-SA融合蛋白进行检测,结果显示:hIL-15-SA融合蛋白能高效锚定修饰在已生物素化的肿瘤细胞表面,修饰效率为99%(见图4)。
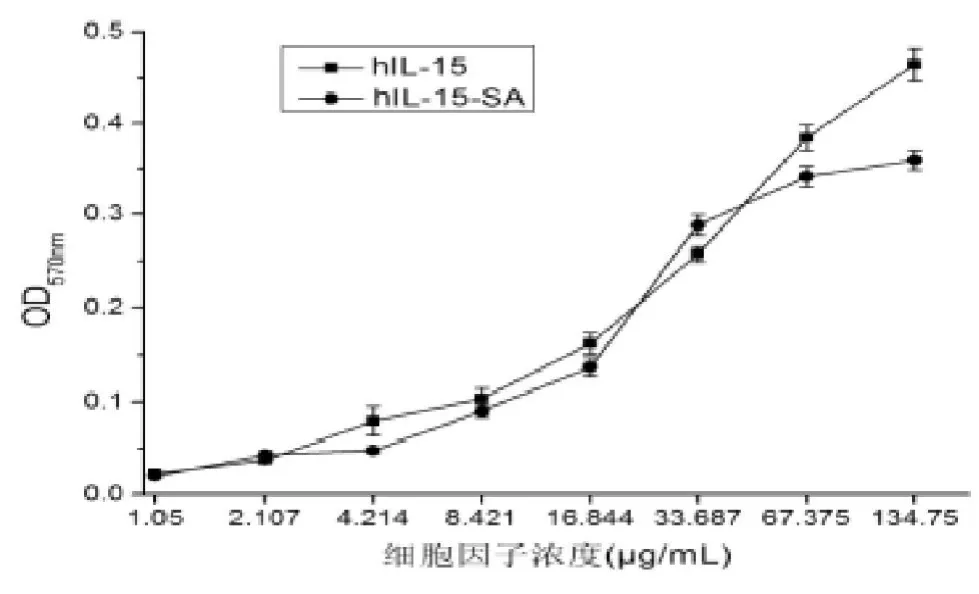
图3MTT法检测hIL-15-SA的淋巴细胞增殖效应

图4细胞锚定率检测
3 讨论
发酵罐高密度发酵的目标是提高目的蛋白表达量和工程菌的产量。对于hIL-15-SA工程菌,本研究应用半合成培养基,以3%的接种量接种种子菌,发酵过程中pH值控制在7.2左右,溶氧量30%。发酵可得到工程菌湿重47 g/L,基本能满足中试制备的需要。重组hIL-15的纯化过程分为三步:第一步是进行包涵体的处理以初步纯化;第二步是采用镍柱亲和层析纯化,蛋白纯度达到65.3%;第三步是根据DNAStar软件分析,表明蛋白hIL15-SA的等电点5.42,故选取DEAE离子交换法进一步纯化,采用阴离子交换层析纯化,蛋白的纯度达到97%。由于蛋白质本身的复杂性和多样性,蛋白质的复性方法也各不相同[7-8],Ward等[9]通过稀释复性法将hIL-15缓慢逐滴地加入复性液中进行复性,我们通过加入氧化还原对(GSH/GSSG),以增加二硫键的正确配对率,从而提高目的蛋白复性效率。从SDS-PAGE图中可以看出,经复性后的重组蛋白100 kD左右出现多聚体条带,同时,经依赖于hIL-15的淋巴细胞增殖试验以及细胞表面锚定修饰试验,验证了本研究制备的hIL-15-SA双功能融合蛋白具有hIL-15和SA的双重活性。
总之,本研究在成功表达hIL-15-SA融合蛋白的基础上,进行中试制备研究,最终获得了高纯度的hIL-15-SA双功能融合蛋白,为后续动物实验以及工业化生产奠定基础。
[1]Waldmann TA. The biology of interleukin-2 and interleukin-15: implications for cancer therapy and vaccine design [J]. Nat Rev Immunol,2006,6(8):595-601.
[2]Bodnar A, Nizsaloczki E, Mocsar G, et al. A biophysical approach to IL-2 and IL-15 receptor function: Localization, conformation and interactions [J]. Immunology Letters, 2008,116(2):117-125.
[3]Laitinen OH, Hytonen VP, Nordlund HR, et al. Genetically engineered avidins and streptavidins[J]. Cell Mol Life Sci, 2006,63(24):2992-3017.
[4]Gao J, Huang S, Li M, et al. GM-CSF-surface-modified B16. F10 melanoma cell vaccine [J]. Vaccine,2006,24(25):5265-5268.
[5]Lesch HP, Kaikkonen MU, Pikkarainen JT, et al. Avidinbiotin technology in targeted therapy [J]. Expert Opin Drug Deliv,2010,7(5):551-564.
[6]张姝,王敏,韩梅琳,等. 基因重组大肠杆菌表达HrpNEcc蛋白的发酵条件及诱导条件优化[J]. 中国生物工程杂志,2009,29 (10):44-49.
[7]Singh SM, Panda AK. Solubilization and refolding of bacterial inclusion body proteins [J]. J Biosci Bioeng,2005,99(4): 303-310.
[8]Zhang T, Xu X, Shen L, et al. Modeling of protein refolding from inclusion bodies [J]. Acta Biochim Biophys Sin (Shang hai),2009,41(12):1044-1052.
[9]Ward A, Anderson M, Craggs RI, et al. E. coli expression and purification of human and cynomolgus IL-15 [J]. Protein Expr Purif,2009,68(1):42-44.
(本文编辑:吴健敏)
Preparation of hIL-15-SA fusion protein
YU Hongsheng*,YAN Yaoming,MAO Qifeng,GAO Jimin1. *Zhejiang Provincial Key Laboratory for Model Organisms,Wenzhou Medical College,Wenzhou,325035
Objective: To study the fermentation and purification of bifunctional fusion protein hIL-15-SA. Methods:The target protein was orified through the application of affinity chromatography and anion exchange chromatography using high-density fermentation of hIL-15-SA from E.coli. Immunoblotting analysis was used to analyze the hIL-15-SA. Lymphocyte cell proliferation assay and cell-surface-modification assay were performed to analyze the bi-functionalities of the fusion protein. Results:Using the semi synthetic medium,the optimal inoculum size was 3% and pH value was 7.0,47 g/L wet cells and 21.15 g/L inclusion bodies were collected. The purity of target protein reached 97% after purification. Cell proliferation and cell-surface-modification assays demonstrated that the purified and refolded hIL-15-SA fusion protein retained both hIL-15 and streptavidin bioactivities. Conclusion:The work presented an efficient way to prepare hIL-15-SA bifunctional fusion protein with large quantity and good purity, thus will allow us to perform further studies in vivo.
interleukin-15;streptavidin;fusion protein;pilot scale
book=7,ebook=18
Q816
A
1000-2138 (2010)04-0326-04
2010-02-28
浙江省重大科技专项科研基金资助项目(2008C 14082);浙江省自然科学基金杰出青年团队资助项目(R20 80407);温州市科技局科研基金资助项目(G20090142)。
余宏盛(1983-),男,湖北咸宁人,硕士生。
高基民,教授,博士生导师,Email:jimingao@ yahoo.com。

