EGF-IL-18在毕赤酵母中的表达
张欢,蔡小波,施晓琴,王震,吕建新
(温州医学院 浙江省医学遗传学重点实验室,浙江 温州 325035)
EGF-IL-18在毕赤酵母中的表达
张欢,蔡小波,施晓琴,王震,吕建新
(温州医学院 浙江省医学遗传学重点实验室,浙江 温州 325035)
目的:在甲醇营养型毕赤酵母表达系统中分泌表达人表皮生长因子受体干扰基序和白细胞介素-18(EGF-IL-18)融合蛋白。方法:PCR扩增EGF-IL-18基因,克隆到表达载体pPIC9K,重组质粒经线性化后用电转化导入毕赤酵母GS115,筛选重组子,经摇瓶培养,用甲醇诱导表达EGF-IL-18融合蛋白。结果:序列分析表明,克隆到pPIC9K载体中的EGF-IL-18基因与设计相符,SDS-PAGE电泳分析显示表达产物EGFIL-18以可溶性分子存在于酵母培养基中,Western印记表明表达产物EGF-IL-18具有良好的抗原性。结论:重组蛋白EGF-IL-18在毕赤酵母GS115中成功分泌表达。
重组融合蛋白质类;EGF-IL-18;克隆,分子;毕赤酵母
白细胞介素-18(interleukin-18,IL-18)又称为IFN-γ诱导因子,于1996年由Ushio等克隆,其前体含193个氨基酸,成熟肽为157个氨基酸,以单体形式发挥作用。IL-18能促进T细胞和NK细胞增殖活化[1-2]。动物实验表明,IL-18具有明显的抗肿瘤作用[3],但由于IL-18的效应细胞——Th1和NK细胞广泛分布于人体各部位,容易激发炎症反应,产生副作用[4],因此,需要一种导向序列来加强IL-18对肿瘤细胞的靶向性。
另一方面,人表皮生长因子受体(EGFR)配体的第三个环状结构保守基序(C-loop)可特异性结合肿瘤细胞表面的EGFR但并无活化EGFR的功能,被称为EGF受体干扰基序[5]。这样融合EGF受体干扰基序和IL-18成熟肽分子,能够得到一个具有肿瘤细胞靶向性和抗肿瘤效应的多功能融合蛋白(EGFIL-18)[6-8]。
本研究通过构建pPIC9K-EGF-IL-18真核表达载体,转化毕赤酵母,筛选获得稳定表达EGF-IL-18蛋白的工程菌,为融合蛋白EGF-IL-18的下一步研究和应用打下良好的基础。
1 材料和方法
1.1 菌株与质粒菌株E.coli DH-5α,质粒pFUSEGF-IL-18由本实验室保存。pPIC9K,GS115购自invitrogen。
1.2酶与试剂EcoR I内切酶、Not I内切酶、Sac I内切酶、Ex Taq酶、T4DNA连接酶、Plasmid Mini Kit、Gel Extraction Kit购自Takara。引物由Takara合成。Tryptone、Yeast extract购自英国OXOID公司。YNB、生物素、G418 购自上海生工。核酸分子量标准、蛋白质分子量标准购自碧云天。鼠抗人IL-18单克抗隆抗体购自MBL公司,ECL发光试剂盒购自珠海百奥公司。PVDF膜为美国BIO-RAD产品。
1.3 目的基因EGF-IL-18的扩增以含有EGF-IL-18基因的重组质粒pFUS-EGF-IL-18为模板,用引物primer1:5’-CCGGAATTCATGCGCTGCTCCCATG-3’(下划线部分为EcoR I酶切位点)和primer2:5’-ATT TGCGGCCGCCTAGTCTTCGTTTTG-3’(下划线部分Not I酶切位点)扩增EGF-IL-18基因。反应体系为25μL:模板1μL、引物各0.5μL、Ex Taq 酶0.2μL、MgCl22μL、dNTP 2μL,ddH2O 18.8μL。反应条件:94 ℃ 预变性5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s,25个循环;最后72 ℃ 延伸10 min。
1.4 表达质粒的构建PCR扩增产物经1%琼脂糖凝胶电泳,胶回收约600 bp处条带。EcoR I、Not I双酶切后,经T4DNA连接酶连接于同样酶切的表达载体pPIC9K,转化感受态的大肠杆菌DH-5α,通过含氨苄青霉素的LB平板筛选,挑取单菌落于LB液体培养基培养,收集细菌,抽提重组质粒pPIC9KEGF-IL-18,进行酶切和PCR鉴定并测序(由Takara公司完成)。
1.5 表达质粒转化酵母菌株按照Invitrogen公司毕赤酵母试剂盒操作指南的方法,将酵母菌GS115制备成感受态,取出80μL感受态细胞与5~10μg Sac I单酶切线性化的重组表达质粒混合,转入0.2 cm电转杯,冰浴5 min,于1500 V,25μF,200 Ω条件下进行电转化。将电转化后的酵母细胞涂布于基本葡萄糖培养基(MD)选择平板上,置于30 ℃培养2~3 d,观察转化子的生长。
1.6 多拷贝EGF-IL-18基因整合转化子的筛选将MD培养基平皿中长出的最初His+转化子,用影印法依次接种到含G418浓度梯度为0.25、0.5、0.75、1.0 mg/mL的YPD平板上,逐级筛选高G418抗性菌株。
1.7 转化子的PCR检测取筛选得到的高G418抗性单菌落中少量菌于沸水中煮5 min后作为模板,用引物5AOX1(5’-GACTGGTTCCAATTGACAAGC-3’)和3AOX1(5’-GCAAATGGCATTCTGACATCC-3’)PCR扩增鉴定整合到酵母染色体上的目的基因,PCR条件:94℃预变性5 min;94 ℃ 1 min,54 ℃ 1 min,72℃ 1 min,共30个循环;最后72 ℃延伸10 min。
1.8 EGF-IL-18在毕赤酵母中的诱导表达挑取抗高浓度G418抗性的pPIC9K-EGF-IL-18的毕赤酵母转化子,接种到BMGY培养液中30 ℃,200 r/min培养至OD600=6,离心收集酵母细胞,用BMMY培养液重悬培养,每隔24 h加甲醇至终浓度为1%,72 h后离心取培养基上清。
1.9 表达产物的Western blot检测将培养基上清超滤浓缩后,用12% SDS-PAGE电泳鉴定表达产物的分子量。SDS-PAGE电泳结束后,转移蛋白至PVDF膜上,用含有5%脱脂牛奶的TBST缓冲液封闭2 h。加一抗鼠抗人IL-18单克隆抗体4 ℃过夜,用TBST充分清洗3次后,加二抗HRP-conjugated Goat anti-Mouse IgG孵育2 h,然后用ECL法进行曝光。
2 结果
2.1 EGF-IL-18基因扩增以pFUS-EGF-IL-18质粒为模板进行PCR扩增。电泳后可见一条清晰的特异性扩增带,扩增片段位于600 bp处左右与预计580 bp相符(见图1)。

图1EGF-IL-18基因PCR扩增图
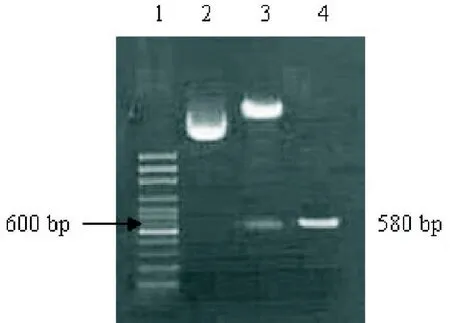
图2重组质粒PCR及酶切鉴定图
2.2重组质粒pPIC9K-EGF-IL-18的鉴定重组质粒pPIC9K-EGF-IL-18的EcoR I、Not I双酶切产物以及PCR鉴定产物在约600 bp处出现条带与预期EGFIL-18(580 bp)基因片段大小一致(见图2)。对重组质粒进行测序分析,结果所克隆的基因序列与已知序列(Genebank:AF454397)的同源性为100%。
2.3 毕赤酵母高拷贝表达菌的筛选和转化子的鉴定重组质粒pPIC9K-EGF-IL-18经Sac I酶酶切线性化,电穿孔转化酵母GS115感受态细胞,筛选获得抗1 mg/mL G418的酵母转化子3个。PCR鉴定证实3个转化子都整合含有目的基因,3个重组酵母菌株GS115/pPIC9K-EGF-IL-18都可扩出约1072 bp大小的片段,而重组酵母菌株GS115/pPIC9K只扩出约492 bp的条带(如图3所示)。
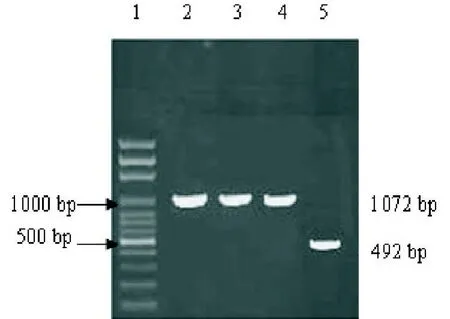
图3毕赤酵母转化子的PCR鉴定图

图4EGF-IL-18蛋白的SDS-PAGE和Western blot鉴定图
2.4 融合蛋白诱导表达和Western blot鉴定重组酵母菌株GS115/pPIC9K-EGF-IL-18经甲醇诱导,离心收集培养基上清,超滤浓缩后,分别经12% SDSPAGE电泳,考马斯亮蓝染色,结果表明甲醇诱导24、48、72 h的重组酵母菌株GS115/pPIC9K-EGF-IL-18的表达产物在相对分子质量约21 kD处有一明显的染色条带,而重组酵母菌株GS115/pPIC9K的表达产物无该条带(见图4a)。Western blot结果进一步显示,该21 kD处的蛋白条带可与鼠抗人IL-18单克隆抗体发生抗原抗体反应(见图4b),证实EGFIL-18蛋白在重组酵母菌株GS115/pPIC9K-EGF-IL-18中成功分泌表达。
3 讨论
本课题组首次合成EGF-IL-18融合基因,并已成功在昆虫杆状病毒系统和原核系统中表达EGF-IL-18融合蛋白[7-8]。与本次实验中利用酵母表达系统表达相比而言,昆虫杆状病毒系统同样也是真核表达系统,但其EGF-IL-18蛋白产业化成本高于酵母表达系统。而利用原核表达系统表达EGF-IL-18融合蛋白时,目的蛋白产量最高,但是需经过较复杂的复性过程,且目的蛋白比活性低于真核表达的目的蛋白。本实验尝试利用酵母表达系统,希望在保持较高的目的蛋白比活的同时,提高真核系统的表达量,获得较高产量、高比活的EGF-IL-18蛋白。
另外,利用酵母表达系统表达EGF-IL-18融合蛋白时,分泌性的表达质粒pPIC9K具有酿酒酵母信号肽α因子,当培养体系以甲醇为唯一碳源时,可强烈介导天然EGF-IL-18蛋白分泌到胞外,而信号肽α因子自身被信号肽酶识别切割,加之酵母自身分泌蛋白比较少,这样就非常适合天然EGF-IL-18融合蛋白的分离,有效地降低了纯化成本。
目前,毕赤酵母表达系统已广泛应用于外源蛋白的表达[9]。某些细胞因子采用毕赤酵母表达系统表达后,蛋白分子量会大于实际分子量,比如IL-10经毕赤酵母分泌表达后其分子量为20.2 kD大于实际的18.5 kD[10]。而GS115/pPIC9K-EGF-IL-18的表达产物经SDS-PAGE电泳检测,在约21 kD处有特异性条带,与实际分子量21 kD相符。这是由于EGFIL-18蛋白不像IL-10等细胞因子那样含有糖基化位点,因而通过毕赤酵母表达系统表达后不会出现蛋白糖基化而导致蛋白分子量增大现象。
分析SDS-PAGE结果,发现重组酵母菌经甲醇诱导24 h即可观察到目的蛋白条带,而经甲醇诱导72 h目的蛋白条带未见明显加深。这可能是由于随着培养体系中酵母菌浓度的增加,其他一些细胞内物质如蛋白水解酶分泌表达也相应增多,从而导致重组蛋白逐渐被降解,最终蛋白表达量无法随时间增加而提高。
总之,本实验通过毕赤酵母表达系统,有效地表达了EGF-IL-18融合蛋白,为EGF-IL-18蛋白进一步研究奠定了良好基础。
[1]Li W, Yamamoto H, Kubo S, et al. Modulation of innate immunity by IL-18[J]. J Reprod Immunol,2009,83(1-2): 101-105.
[2]Schneider BE, Korbel D, Hagens K, et al. A role for IL-18 in protective immunity against Mycobacterium tuberculosis [J]. Eur J Immunol,2010, 40(2):396-405.
[3]Lian H, Jin NY, Li X, et al. Induction of an effective antitumor immune response and tumor regression by combined administration of IL-18 and Apoptin [J]. Cancer Immunol Immunother,2007,56(2):181-192.
[4]Dinarello CA. Interleukin-18 and the pathogenesis of in
flammatory diseases [J]. Semin Nephro,2007,27(1):98-114. [5]Lutsenko SV, Feldman NB, Severin SE. Cytotoxic and antitumor activities of doxorubicin conjugates with the epidermal growth factor and its receptor-binding fragment [J]. J Drug Target,2002,10(7):567-571.
[6]彭颖,吕建新. 人EGF受体干扰序列-ILl8融合基因构建及其表达产物结构预测[J]. 温州医学院学报,2003,33(5):289-291.
[7]Lu JX , Peng Y , Meng ZF, et al. Rational design of an EGFIL18 fusion protein: implication for developing tumor theraeutics [J]. Biochem Biophys Res Commun,2005,334(1):157-161.
[8]潘建华,彭颖,郑昭暻,等. 重组人EGF-IL-18 融合蛋白的表达纯化及复性[J]. 细胞生物学杂志,2006,28(5): 711-716.
[9]Li P, Anumanthan A, Gao XG, et al. Expression of recombinant proteins in Pichia pastoris [J].Appl Biochem-Biotechnol,2007,142(2):105-124.
[10]井申荣,邹全明,曾韦锟,等. 重组人白细胞介素10在毕赤酵母中的表达及生物活性测定[J]. 中华微生物学和免疫学杂志, 2005,25(9):773-776.
(本文编辑:吴健敏)
Expression of EGF-IL-18 in pichia pastoris
ZHANG Huan,CAI Xiaobo,SHI Xiaoqin,WANG Zhen,LV Jianxin.Zhejiang Provinicial Key Lab of Medical Genetics,Wenzhou Medical College,Wenzhou,325035
Objective: To express human epidermal growth factor receptor interferential motif and interleukin-18(EGF-IL-18)fusion protein in the methylotrophic pichia pastoris expression system. Methods:EGF-IL-18 gene was amplified by PCR, and then cloned into the expression vector of pPIC9K. The pPIC9K-EGF-IL-18 was linearized and electrotransformed into Pichia pastoris GS115. The recombinants were screened and then induced by methanol in shake flask cultures. Results: DNA sequencing analysis showed that the sequence of cloned EGF-IL-18 was accorded with that of designment. The recombinant EGF-IL-18 protein was detected in the culture medium by SDS-PAGE. Western blot results indicated that the recombinant EGF-IL-18 protein exhibited high antigenicity. Conclusion:The recombinant protein of EGF-IL-18 is successfully secretory expressed in Pichia pastoris GS115.
recombinant;fusion protein;EGF-IL-18;cloning molecular;pichia pastoris
book=7,ebook=14
Q78[
]A
]1000-2138 (2010)04-0322-05
2010-03-02
浙江省科技厅重大科技专项和优先主题计划资助项目(2009C13038);浙江省教育厅2008年度大学生科技创新活动计划立项资助项目。
张欢(1984-),男,浙江温州人,硕士生。
吕建新,教授,博士生导师,Email:jxlu313@163. com。
tected in the culture medium by SDS-PAGE. Western blot results indicated that the recombinant EGF-IL-18 protein exhibited high antigenicity. Conclusion:The recombinant protein of EGF-IL-18 is successfully secretory expressed in Pichia pastoris GS115.
recombinant;fusion protein;EGF-IL-18;cloning molecular;pichia pastoris
book=7,ebook=14
Q78
A
]1000-2138 (2010)04-0322-05
2010-03-02
浙江省科技厅重大科技专项和优先主题计划资助项目(2009C13038);浙江省教育厅2008年度大学生科技创新活动计划立项资助项目。
张欢(1984-),男,浙江温州人,硕士生。
吕建新,教授,博士生导师,Email:jxlu313@163. com。

