护牙素对人口腔鳞状细胞癌细胞系细胞增殖的影响
丁小军 龚逸明 张萍 沈毅 郭雪华 余优成 顾章愉
(1.复旦大学附属中山医院口腔科,上海 200032;2.上海交通大学医学院附属第九人民医院,口腔医学院口腔颌面外科,上海 200011;3.上海市口腔医学研究所,上海市口腔医学重点实验室,上海 200011)
富士(GC)护牙素是近年来研制出的主要用于釉质再矿化治疗的产品,在口腔正畸临床被常规用于预防托槽周围牙齿表面的脱矿,预防龋齿的发生。其主要成分是酪蛋白磷酸多肽-无定形磷酸钙(casein phosphopeptide-amorphouscalcium phosphate,CPP-ACP)。CPP-ACP主要是通过释放大量的活性钙离子来促进釉质的再矿化[1]。但现有的研究[2]结果表明,生理状况下,细胞外钙浓度的增加是诱导角质形成细胞脱离细胞周期进行终末分化的主要原因。在口腔矫治过程中由于矫治器的刺激,口腔溃疡的发生率大为增高,如果溃疡发生的同时应用GC护牙素,是否会通过钙的释放增加细胞外钙浓度影响以上皮增殖为主的口腔溃疡的愈合过程,尚无学者对此作相关研究。本研究通过GC护牙素对口腔黏膜来源的口腔鳞状细胞癌细胞系NB和NT细胞[3]增殖的影响来对此问题进行初步探讨。
1 资料与方法
1.1 材料与仪器 BP-800酶联免疫标记仪,GC护牙素(GC公司,日本),FACS Calibur流式细胞仪,PI/RNase Staining Buffer,Annexin V:FITC Apoptosis Detection Kit I,RPMI 1640细胞培养液,胎牛血清。
1.2 细胞培养 人口腔鳞状细胞癌细胞系NB和NT由中国口腔组织培养和收集中心提供。选用含有10%胎牛血清的RPMI1640培养液,置于37℃、5%CO2孵箱中培养。待细胞融合达80%~90%后,用0.25%胰酶消化成单个细胞,传代培养。取对数生长期的细胞进行实验。
1.3 四甲基偶氮唑盐比色(MT T)法检测GC护牙素对NB和NT细胞增殖的影响 取对数生长期NB和NT细胞,胰蛋白酶消化,接种细胞于96孔板中,接种密度为1×104◦mL-1,每孔接种0.2 mL。24 h后,分别换用GC护牙素浓度为0(对照组)和10-3(实验组0.05 g GC护牙素溶解于100 mL培养液中)的含10%胎牛血清的RPMI 1640培养液继续培养。每3天换培养液1次,每天采用MTT比色法于490 nm处测定细胞吸光值,连续测定8 d。每组每天设5个复孔。
1.4 流式细胞仪检测GC护牙素对NB和NT细胞细胞周期的影响 取对数生长期NB和NT细胞,胰蛋白酶消化,接种细胞于培养瓶中,接种密度为1×105◦mL-1。24 h后,分别换用GC护牙素浓度为0和10-3的含10%胎牛血清的RPMI 1640培养液继续培养。处理24 h后,分别消化、收集各组细胞,每个样本至少有1×106个细胞。PBS洗2次,1 mL 70%的PBS冰乙醇固定,4℃过夜后,PBS洗 2次,加入 0.5 mL PI/RNase Staining Buffer,常温避光孵育15 min。上机测定各组细胞 DNA含量。重复实验3次,取平均值。
1.5 流式细胞仪检测GC护牙素对NB和NT细胞凋亡的影响 细胞培养及处理同细胞周期检测。消化后的细胞用PBS洗2次,Binding Buffer重悬细胞,并转移到流式管内(每管内液体总体积为100μL)。加入 Annexin V-FITC 5μL,避光常温孵育30 min后加入PI 5μL,避光常温孵育5 min。加入400μL Binding Buffer补足体积。上机检测细胞凋亡情况。重复实验3次,取平均值。
1.6 统计学分析 所有数据采用SPSS11.0软件包进行统计分析,P<0.05为差异有统计学意义。
2 结 果
2.1 GC护牙素对NB和NT细胞增殖的影响 从细胞生长曲线可以看出,与对照组相比,10-3浓度的GC护牙素对NB和NT细胞的生长有轻度抑制作用(图1和图2)。
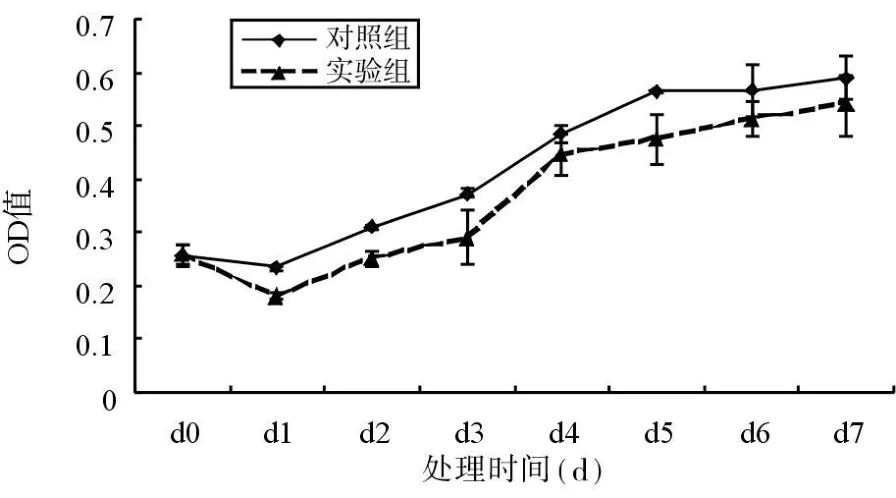
图1 GC护牙素对NB细胞生长的影响
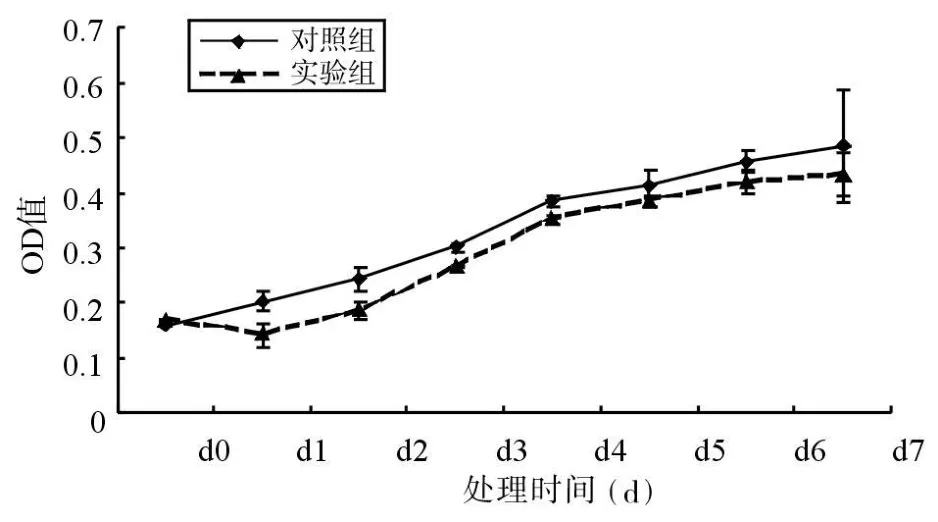
图2 GC护牙素对NT细胞生长的影响
2.2 GC护牙素对NB和NT细胞细胞周期的影响 与对照组相比,GC护牙素处理24 h后,NB和NT细胞的G0G1期和S期百分比有显著差异。实验组G0G1期细胞百分比明显高于对照组,而S期细胞百分比则略有减少,见表1。
2.3 GC护牙素对NB和NT细胞凋亡的影响 与对照组相比,10-3浓度的GC护牙素处理24 h后,NB和NT细胞的凋亡率无显著差异,见表2。
表1 GC护牙素对NB和NT细胞细胞周期的影响(,%)
注:与对照组比较,*P<0.05
表2 GC护牙素对NB和NT细胞凋亡的影响(,%)

表2 GC护牙素对NB和NT细胞凋亡的影响(,%)
组别(GC护牙素浓度)n NB细胞 NT细胞对照组 3 6.24±2.38 6.86±1.97实验组 3 7.95±1.92 9.10±2.61
3 讨 论
CPP-ACP同时具有抑制牙釉质脱矿和促进牙釉质再矿化的作用。CPP黏附在牙面和菌斑上,抑制菌斑中变链菌的繁殖,减少酸的产生,同时与钙离子和磷酸盐离子作用并使之稳定地保持在水溶非结晶状态;处于水溶状态下ACP中的活性钙离子和磷酸盐离子可以渗入牙面,补充牙釉质下龋损区的矿物质,生成羟基磷灰石或氟化羟基磷灰石,这样不但限制了脱矿区的扩展,同时也修复了已受损的牙体结构,有效地防止了牙面上的白斑形成和促使已生成的白斑消失[4-6]。近年来,为更好的发挥 CPPACP的防龋效果,CPP-ACP已经被加入一些产品中。这些产品包括市场上可购买到的无糖口香糖、薄荷糖、凝胶以及实验测试用的玻璃离子水门汀和运动饮料等[7]。GC护牙素目前已被广泛用于正畸后白斑的预防和美白、洁治后的脱敏以及常规的口腔保健等。
Cehreli等[8]曾经用不同稀释浓度(10-3、10-4、10-6、10-8和 10-12)的 GC护牙素处理 L929细胞(小鼠肺成纤维细胞),以探讨GC护牙素作为外伤离体牙转运介质的可能性。结果发现,除了10-3和10-4浓度处理外,其他浓度处理的细胞均有不同程度的增殖;经10-3和10-4浓度的GC护牙素处理的细胞迅速凋亡,经10-6和10-8浓度的GC护牙素处理的细胞凋亡相对较少,而经10-12浓度的GC护牙素处理的细胞则没有发生凋亡反应。本研究结果表明,高浓度的GC护牙素对口腔鳞状细胞癌细胞的增殖确实具有一定的抑制作用。进一步的细胞周期分析和凋亡检测的结果显示,经10-3浓度的GC护牙素处理24 h后,无论是NB还是NT细胞,G0G1期细胞的百分比都有少量的增加,S期细胞的百分比则明显下降。但GC护牙素对细胞的凋亡并无明显的影响,说明GC护牙素对口腔鳞状细胞癌细胞的生长抑制作用并非是通过诱导凋亡发生。
口腔溃疡特别是复发性口腔溃疡是一种常见病、多发病[9-11]。而在口腔矫治过程中,由于矫治器的刺激,口腔溃疡的发生率大为上升。上皮细胞的增殖是口腔溃疡愈合机制中的一个重要组成部分。在矫治器刺激导致的溃疡愈合过程中,如果在局部应用GC护牙素防龋,CPP-ACP中释放的活性钙可能会使细胞外的钙浓度持续提高。而根据Bikle等[2]的研究,细胞外钙浓度的升高,会通过激活一系列的通路,最终使上皮中的角化形成细胞脱离细胞周期,停止增殖,表达分化指标而发生终末分化。我们研究[12]的另一项结果也证实,细胞外钙浓度的增加确实可以促使口腔鳞状细胞癌细胞的分化。这样,应用GC护牙素就可能通过升高口腔上皮细胞外的钙浓度来影响溃疡的愈合过程。尽管本研究的结果提示10-3浓度的GC护牙素有轻度抑制口腔鳞状细胞癌细胞增殖的作用,由于临床使用GC护牙素是以原产品1日1次或数次直接涂于牙面,初始作用浓度很高,之后由于唾液的稀释浓度逐渐降低。本研究中,因为GC护牙素10-3浓度是我们所能制备的最高浓度,与实际应用的情况并非完全一致,口腔鳞状细胞癌细胞也不是真正的口腔溃疡处的口腔黏膜基底细胞,所以,本研究只是对此作了初步的探讨,最终的结论仍有待进一步的动物实验或临床实验证实。
1 Reynolds EC.Anticariogenic complexes of amorphous calcium phosphate stabilized by casein phosphopeptides:a review[J].Spec Care Dentist,1998,18(1):8-16.
2 Bikle DD,Ng D,Tu CL,et al.Calcium-and vitamin D-regulated keratinocy te differentiation[J].Mol Cell Endocrinol,2001,177(1-2):161-171.
3 Zhang P,Zhang Y,Mao L,et al.Side population in oral squamous cell carcinoma possesses tumo r stem cell phenotypes[J].Cancer Lett,2009,277(2):227-234.
4 Yamaguchi K,Miyazaki M,T akamizawa T,et al.Effect of CPP-ACP paste on mechanical properties of bovine enamel as determined by an ultrasonic device[J].J Dent,2006,34(3):230-236.
5 Rose RK.Effects of an anticariogenic casein phosphopeptide on calcium diffusion in streptococcal model dental plaques[J].A rch O ral Biol,2000,45(7):569-575.
6 Iijima Y,Cai F,Shen P,et al.Acid resistance of enamel subsurface lesions remineralized by a sugar-free chewing gum containing casein phosphopeptide-amorphous calcium phosphate[J].Caries Res,2004,38(6):551-556.
7 Cross KJ,Huq NL,Reynolds EC.Casein phosphopeptides in oral health--chemistry and clinical applications[J].Curr Pharm Des,2007,13(8):793-800.
8 Cehreli SB,Gurpinar AO,Onur AM,et al.In vitro evaluation of casein phosphopeptide-amorphous calcium phosphate as a potential tooth transport medium:viability and apoptosis in L929 fibroblasts[J].Dent T raumatol,2008,24(3):314-319.
9 刘宗响,周正国.肿痛安联合地塞米松治疗复发性阿弗他溃疡的疗效评价[J].上海口腔医学,2006,15(5):555-556.
10 Munoz-Corcuera M,Esparza-Gómez G,González-Moles M A,et al.Oral ulcers:clinical aspects.A tool for dermatologists.Part II.Chronic ulcers[J].Clin Exp Dermatol,2009,34(4):456-461.
11 Munoz-Corcuera M,Esparza-Gómez G,González-Moles M A,et al.Oral ulcers:clinical aspects.A tool for dermatologists.Part I.Acute ulcers[J].Clin Exp Dermatol,2009,34(3):289-294.
12 丁小军,孙坚,王丽珍,等.舌鳞癌SENP5的表达及其临床意义[J].中国口腔颌面外科杂志,2009,7(4):342-346.

