钾通道 Kv1.2与致痫大鼠发病相关性的研究
曾常茜, 李冬平, 唐 伟, 王 葳, 曹平安, 邹飒枫
癫痫是一组由多种病因引起的以脑部神经元过度放电所致的突然、反复和短暂的中枢神经系统功能失常为特征的慢性临床综合征。现已证明大多数遗传性特发性癫痫与离子通道基因突变有关。钾通道在调节神经元的兴奋性方面起着重要的作用,其主要功能是促进细胞膜尽快恢复静息状态,控制细胞的兴奋性水平和放电频率。钾通道 Kv1.2是瞬时外向钾通道,其特点是去极化时通道暂时开放,产生短暂外向电流即 IA电流。IA电流是动作电位复极化早期外向电流的主要成分,当 A型钾通道异常失活时,常导致动作电位长时程延长。钾通道 Kv1.2与癫痫发病机制的关系是近年来的研究热点。本实验通过检测戊四唑致痫大鼠海马区钾通道 Kv1.2蛋白表达,探讨钾通道Kv1.2与癫痫发病机制的相关性。
1 材料与方法
1.1 材料 SD雄性大鼠 40只(10周龄、体重220±20克)由大连医科大学实验动物中心提供。兔抗鼠 Kv1.2单克隆抗体购自alomone公司,β-actin内参蛋白购自上海硕盟,生物素标记的羊抗兔 IgG抗体、SP试剂和 DAB显色剂购自北京中杉金桥公司;Marker购自 Cell Signaling Technology公司;戊四唑 (PTZ)购自 Sigma公司;NP-40、SDS、PMSF、BSA、丙烯酰胺、Tris碱 、TEMED、过硫酸胺、澳酚蓝 、甘氨酸、DTT、考马斯亮蓝 R-250,均为 Amresco公司产品。POWERLAB电生理记录仪(ADinstruments/澳大利亚);DU640紫外分光光度计(BECKMAN);蛋白电转仪、垂直电泳仪和凝胶成像系统(Bio-Rad)。
1.2 方法
1.2.1 癫痫模型的制作 SD雄性大鼠 40只分成实验组 30只,对照组 10只。对 30只实验组大鼠,首先给予大鼠腹腔注射 1%PTZ溶液 40mg/kg,10min后注射 20mg/kg,然后每 10min注射 10mg/kg。大鼠惊厥的行为表现采用 Racine 6级评价标准:0级,无任何反应;I级,湿狗样抖动、面肌痉挛如眨眼、动须及节律性咀嚼;Ⅱ级,颈部肌肉痉挛,表现为点头和(或)甩尾;Ⅲ级,一侧前肢阵挛;Ⅳ级,双侧前肢阵挛伴站立;V级,全身阵挛,失去平衡,跌倒。当大鼠达 4~5级、重复的惊厥发作达10min以上以及脑电监测为尖波、慢波、尖慢复合波时认定大鼠致痫成功,分别在 1h、24h、48h时间段取材进行以下实验。
1.2.2 脑电的引导与分析 从实验组中随机抽取 6只、从对照组中随意抽取 2只大鼠行脑电监测。电极安装在右额及右枕(右额坐标为:前囟前3.0mm,中线旁 2.0mm,硬膜下 0.5mm;右枕坐标为:前囟后 5.8mm,中线旁 3.0mm,硬膜下 0.5mm)。通过 powerlab生理记录仪进行脑电记录,参数:高通0.03s,低通 30Hz,量程 500μv~3mv。在注射前后监测 EEG,每 5min记录一次至 150min。通过对脑电图的形态、频率、波幅进行痫样放电的判断。
1.2.3 分组 实验组共 30只,成功致痫后在1h、24h、48h时间段各取 8只大鼠脑组织行电压门控钾通道 Kv1.2检测。对照组共 10只,随机抽取 8只正常大鼠脑组织行电压门控钾通道 Kv1.2检测。
1.2.4 脑片制作及组织冻存 大鼠在 10%水合氯醛(350mg/kg)腹腔麻醉下,经左心室灌注生理盐水 150ml,随后灌注含 4%多聚甲醛 0.1mol/L PB(p H7.4,4℃)300ml。取出大脑,将脑组织分成两半。一半用 4%多聚甲醛固定 24h,4℃。常规脱水、透明、石蜡包埋。约位于海马区层面连续冠状切片,厚 3μm,每隔 5片取 2片,行免疫组化染色。另一半分离出海马并迅速放置于液氮罐中低温保存,以备行 Western Blot检测。
1.2.5 免疫组化染色检测钾通道 Kv1.2的表达 钾通道 Kv1.2抗原表达检测采用 ABC染色方法:各组大鼠做石蜡切片后常规脱蜡,微波修复抗原,自然凉至室温。抑制内源性过氧化物酶活性后,用山羊免疫正常血清封闭非特异性结合位点,室温孵育 30min。加兔抗鼠 Kv1.2单克隆抗体 (1∶200),4℃过夜。PBS洗涤,5min×3次。加生物素标记的羊抗兔 IgG抗体,37℃1h后,PBS洗涤,5min×3次。滴加 SP试剂,室温作用 20min,PBS洗涤,5mim×3次。加 DAB显色 2min后,用苏木精复染1min。脱水、透明,中性树胶封片。显微镜下(×400)观察结果。用 Image pro plus图像分析软件测定海马 CA1、CA3、齿状回(DG)Kv1.2蛋白表达的平均光密度(IOD/area),并进行统计分析。
1.2.6 Western Blot检测钾通道 Kv1.2蛋白水平用 RIPA裂解液提取脑组织全细胞蛋白、紫外光分光光度计测定蛋白浓度及计算上样量;在 100℃水浴中煮5 min使蛋白充分变性;用蛋白垂直电泳仪进行 SDS-聚丙烯酰胺凝胶电泳分离蛋白;利用蛋白电转仪装置进行转膜;NC膜放入封闭液中 4°C过夜;在 NC膜上均匀加入抗鼠 Kv1.2单克隆抗体(1∶200),37℃孵育 1h,用TTBS洗去未结合的一抗;在 NC膜上均匀滴入生物素标记的羊抗兔 IgG抗体,37℃孵育 1h,TTBS洗 3×10min;加入辣根酶标记的链霉亲和素工作液,37℃孵育1h,TTBS洗 3×10min;滴加 DAB液,避光显色。用Lannch Doc-Itis软件对图片条带行光密度测定,取各条带累积光密度(IOD)与相对应的 β-actin内参蛋白 IOD之比,即 Kv1.2蛋白的相对量作统计分析。
1.3 统计学方法 用 SSPS 11.5软件对免疫组化检测电压门控钾通道 Kv1.2蛋白表达的平均光密度进行方差分析和 LSD检验。Kv1.2蛋白表达的IOD与 β-actin蛋白的 IOD比值作为蛋白表达相对量,对此进行方差分析和 LSD检验。
2 结 果
2.1 痫样行为及脑电图检测结果 实验组 30只大鼠均于 2次注射 PTZ 20mg/kg后出现抖动、动须、点头及节律性咀嚼,然后每 10min注射 10mg/kg 1~2次后,27只大鼠出现全身阵挛、角弓反张、四肢强直、跌倒,达到 Racine标准 4~5级,持续约 10~20min后逐渐停止抽搐。在大鼠抽搐发作中,脑电图明显异常,表现为大量的高尖波及尖慢复合波,节律不规则,平均波幅 120μV最大波幅达 260μV,频率达 30Hz。随着大鼠抽搐的停止,高尖波及尖慢波逐渐减少,波幅下降,直至停止监测仍有散在尖波。另外 3只大鼠均无全身痉挛出现,未达到 Racine标准 4~5级,剔除出实验组。对照组大鼠脑电图呈细小 α波,波幅较均一,最大波幅 <10,频率 8Hz(见图1)。
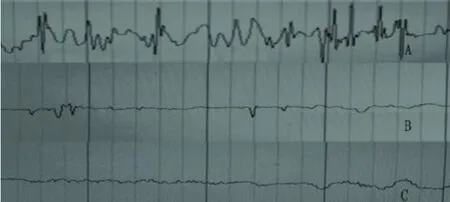
图1 实验组与对照组大鼠脑电图检测结果
2.2 大鼠 Kv1.2蛋白表达结果 Kv1.2蛋白在对照组和实验组大鼠海马均有分布,以锥体细胞层、齿状回颗粒细胞层为主。高倍镜下可见阳性细胞一般为梭形或星形,胞浆及细胞膜上有棕黄色阳性反应颗粒,以 CA3区最为明显。各时间段(1h、24h、48h)的实验组大鼠海马阳性细胞数均较对照组少,阳性细胞着色较浅,少有突起,未见明显胶质细胞增生。各时间段(1h、24h、48h)的实验组大鼠海马 CA1、CA3、DG区的平均光密度值均较对照组显著减少(P<0.05);实验组 3个时间段(1h、24h、48h)的各海马区平均光密度值无显著性差异(P>0.05)(见表1)(见图2~图4)。
2.3 大鼠 Kv1.2蛋白相对浓度的检测结果在 57kd处有明显的蛋白条带。对照组与各实验组相比蛋白条带明显宽厚,而各实验组蛋白条带之间基本相同。42kd处内参蛋白条带在对照组与各实验组之间基本相同。结果提示,海马神经元有 Kv 1.2表达,实验组大鼠海马区 Kv1.2表达下降,这与免疫组化染色检测的结果一致。致痫后 1h、24h、48h大鼠海马区 Kv1.2蛋白相对浓度与对照组相对浓度均有明显差异(P<0.01)(见表2)。

表1 免疫组化法检测 Kv1.2蛋白表达结果
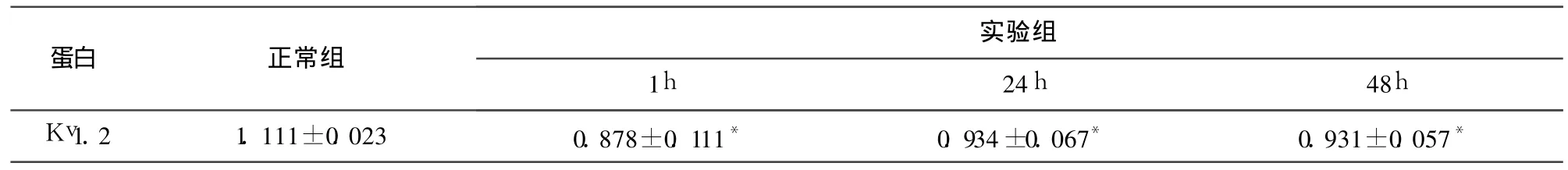
表2 Western blot检测大鼠海马 Kv1.2蛋白结果
3 讨 论
癫痫的功能失常可表现为运动、感觉、意识、行为、自主神经功能等不同障碍。神经元静息电位的维持,动作电位的发生、发展均与钾离子在细胞内外正常分布密切相关。当钾离子分布发生异常改变时,常伴发脑电生理中阵发性去极化飘移,神经元出现异常电生理活动。在动物癫痫和癫痫性发作模型中,发现在发作前或发作中细胞外钾离子浓度均有升高。钾离子分布主要通过钾离子通道途径来调节,钾通道开放时促进 K+外流,引起细胞膜复极化和超极化,从而降低细胞的兴奋性。因此钾离子通道功能的改变是引起神经元内在兴奋性不平衡的物质基础,癫痫的发病机制与电压门控钾离子通道密切相关。
神经元的活动、信息传递无不通过动作电位来完成,动作电位发放的调节主要是通过电压门控钾离子通道外向电流来实现。在神经细胞从超极化向去极化阈电位过度时首先受到电压门控钾通道 Kir2抑制性调节,随着电位向阈电位的上升,Kir2钾通道逐渐失活关闭[1,2]。当电压接近 -60mV时另一电压门控钾通道被激活,对神经细胞和神经突触的去极化进行抑制调节作用。这种钾通道在低于阈电位时开始被激活,Bekkers等[3]对此类通道进行分子结构及门控特性的研究,认定其为 Kv1型钾通道。与神经细胞异常放电密切相关的癫痫是否会因 Kv1通道功能异常引发很值得探讨。
戊四唑能引起动物抽搐迅速发生,短时间内达到高峰,持续较短时间后自动停止,因此戊四唑被认为是复制急性全身强直阵挛发作癫痫模型的理想药物。本实验通过对大鼠腹腔注射戊四唑建立了癫痫的急性全身强直阵挛发作癫痫模型,在此模型上对 3组不同时间致痫大鼠海马 CA1、CA3、DG区钾通道 Kv1.2进行检测并与对照组大鼠比较,结果表明:致痫组大鼠海马区钾通道 Kv1.2蛋白表达水平在致痫后 3个时间段(1h、24h、48h)均明显低于对照组(P<0.05)。各致痫组大鼠海马区钾通道 Kv1.2蛋白表达水平在致痫后3个时间段(1h、24h、48h)之间均无明显差异(P>0.05)。因此认为大鼠海马区钾通道 Kv1.2表达的减少与全身强直阵挛发作大鼠癫痫发病密切相关。这与 Tsaur[4]在实验中检测到致痫鼠海马区 Kv1.2 mRNAs表达明显减少相一致。而致痫大鼠在 48h之内钾通道 Kv1.2的表达并无明显差异,推测在此时间段神经元内钾通道蛋白合成仍未完全恢复。在实验组和对照组大鼠海马区均可见阳性细胞表达,主要集中于海马颗粒细胞层,颗粒细胞层细胞异常放电可能是大鼠癫痫发作的主要因素。这与 Park等[5]实验发现戊四唑致痫鼠 Kv1.2免疫反应异常增强主要位于海马颗粒细胞层的结果相一致。
电压门控钾通道亚家族 Shaker(Kv1.1-Kv1.8)为四聚体通道,由 Kcna1-Kcna 8基因编码,其中编码Kv1.1、Kv 1.2的基因具有最高同源性。 Kv1.1、Kv1.2两通道的四聚体构成基本相同,因此功能上也表现为很多的相同性。这两种钾通道共同表达于神经细胞内,通过该通道的钾离子形成一瞬时外向性钾电流即 A-型钾电流(IA)。这种钾通道在低于阈电位时开始被激活,产生外向 IA并抵消刺激电流,去极化几乎被抑制,延长,膜电位去极化。动作电位的时程决定功能依赖性钙的进入并调节钙依赖的后续进程,增加 Ca2+内流入神经末端,触发神经递质大量释放并介导兴奋性突触后电位,增强神经元兴奋性。因此 A通道作为一个阻尼器,在动作电位之间插入一个间歇时间,动作电位峰峰间隔延长,使重复爆发性放电变成缓慢放电,调节神经细胞的复极化,降低膜的兴奋性。有外国学者 Shen[6]等对此类钾通道进行分子结构及门控特性的研究时发现,虽然 Kv1.1、Kv1.2和 Kv1.6 mRNA在神经细胞内均有表达,但药理学上表明此类通道主要是由 Kv1.2构成。在阈下钾电流中通过 Kv1.2的钾电流占有近一半。因此作者认为 Kv1.1,Kv1.2虽均参于复极化电位调节,但 Kv1.2是影响锋电位阈值以及重复放电的主要机制,因而钾通道 Kv1.2表达的减少必然增强神经细胞的兴奋性并引发癫痫。钾通道 Kv1.2由 α核心亚基及 β辅助亚基组成,除了其核心亚基表达减少可引起癫痫外,Connor[7]发现删除编码 β辅助亚基基因同样可引发大鼠抽搐。通过本实验我们更深一步地认识到电压门控钾通道 Kv1.2功能的异常是全身强直阵挛发作癫痫的重要发病机制,这为开发新的治疗癫痫药物-钾通道 Kv1.2开放剂,提供了进一步的理论基础和实验依据。
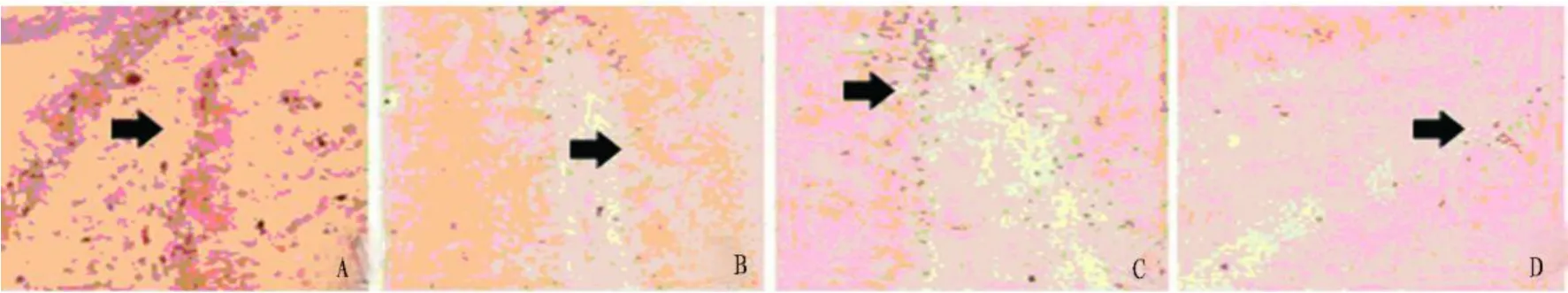
图2 大鼠海马齿状回 Kv 1.2的表达(免疫组化法,40×)

图3 大鼠海马CA 1区 Kv1.2的表达(免疫组化法,200×)

图4 大鼠海马 CA 3区 Kv1.2的表达(免疫组化法,400×)
[1] Nisenbaum ES,Wilson CJ.Potassium currents responsible for inward and outward rectification in rat neostriatal spiny projection neurons[J].JNeurosci,1995,15(6):4449-4463.
[2] Mermelstein PG,Song WJ,Tkatch T,et al.Inwardly rectifying potassium(IRK)currents are correlated with IRK subunit expression in rat nucleus accumbensmedium spiny neurons[J].J Neurosci,1998,18(17):6650-6661.
[3] Bekkers JM,Delaney AJ.Modulation of excitability by alpha-dendrotoxin-sensitive potassium channels in neocortical pyramidal neurons[J].J Neurosci,2001,21(17):6553-6560.
[4] Tsaur ML,Sheng M,Lowenstein DH,et al.Differential expression of K+channel mRNAs in the rat brain and down-regulation in the hippocampus following seizures[J].J Neuron,1992,8(6):1055-1067.
[5] Park KH,Chung YH,Shin C,et al.Immunohistochemical study on the distribution of the voltage-gated potassium channels in the gerbil hippocampus[J].JNeurosci Lett,2001,298(1):29-32.
[6] Shen W,Hernandez-Lopez S,Tkatch T,et al.Kv1.2-containing K+channels regulate subthreshold excitability of striatal medium spiny neurons[J].J Neurophysiol,2004,91(3):1337-1349.
[7] Connor JX,McCormack K,Pletsch A,et al.Genetic modifiers of the Kv beta2-null phenotype in mice[J].J Genes Brain Behav,2005,4(2):77-88.
——从一道浙江选考生物学试题谈起

