β阻滞剂对急性期实验性脑出血大鼠的神经保护作用
王 岩, 闫丽儒, 纪 辉, 张纯慧, 李 丹, 董艳波
脑出血是一种高发病率和高死亡率的脑血管疾病,约 1/3患者伴有神经损伤,并直接影响患者预后,因而目前脑出血的治疗重点在于减轻出血周围脑组织损伤。神经细胞内钙超载被认为是引起细胞死亡及脑组织损伤的中心环节[1]。内皮素(Endothelin,ET)和降钙素基因相关肽(Calcitonin gene-related peptide,CGRP)是器官局部血流调节因子,ET具有强烈缩血管作用,也能对神经元和胶质细胞造成直接损害;而 CGRP是已知最强的扩血管物质之一[2,3],并有引起细胞内 Ca2+浓度下降的作用。正常情况下两者保持相对稳定,维持动态平衡,病理情况时两者平衡失控。有报道[4]表明脑出血患者的CGRP及 ET的动态变化规律与脑出血脑水肿病程变化及预后有关。因此,若能在脑出血早期抑制Ca2+内流并维持ET和 CGRP动态平衡,则受损的神经细胞可望得到恢复,这可能是今后治疗脑出血的一条可行途径。本实验拟在研究美托洛(β-阻滞剂)对大鼠实验性脑出血后神经细胞内钙离子浓度以及CGRP和 ET水平的影响,进而验证其对脑出血的脑保护作用。
1 材料与方法
1.1 实验材料 选择健康雄性成年 Wistar大鼠 84只,体重 200~230g,由哈尔滨医科大学实验动物中心提供。β-阻滞剂选用酒石酸美托洛尔片;CGRP、ET放免试剂盒由天津九鼎医学生物工程有限公司提供;肝素钠、30%水合氯醛、微量进样器、脑立体定位仪、低温离心机、微量注射器、手术器械由哈尔滨医科大学解剖学教研室提供。
1.2 实验方法
1.2.1 实验分组 Wistar大鼠 84只随机分为正常对照组(12只)、模型组(36只,24h、48h、72h各12只 )、药物治疗组(36只,24h、48h、72h各 12只)。
1.2.2 脑出血模型制备 模型组及药物治疗组大鼠称重后按 0.4mg/100g剂量给予水合氯醛腹腔麻醉,俯卧位固定于立体定位仪,鼠尾用 40℃水浴 10min,头皮下中切口约 1cm,于颅骨背侧前囟后0.2mm中线向左旁 2.9mm处钻孔,大鼠尾尖约 5cm断尾取血 40μl,固定于立体定位仪上并沿钻孔垂直进针,深约 6mm,缓缓注入鼠血,留针 1min后退针,缝合头皮。病理证实造模是否成功:按各组预定时间取尾状核部脑组织 2块,制备光、电镜标本。
1.2.3 给药方法 模型组造模后即刻给予0.9%生理盐水 1.5ml灌胃,药物治疗组造模后即刻给予美托洛尔100g/kg(溶于0.9%生理盐水1.5ml)灌胃。
1.2.4 血浆 ET及 CGRP测定 各组大鼠在相应观察点(造模后 24h、48h、72h)乙醚麻醉,摘除眼球取血约 3ml,置入含 10%EDTA二钠 30μl和抑肽酶 40μl的离心管内,低温 (4℃)高速离心,3000r/min,共 10min,取上清 -70℃冻存待测。CGRP及ET放免试剂盒购自天津九鼎医学生物工程有限公司,操作按试剂盒说明进行。
1.2.5 用 Fura-2/AM荧光探针法测定血肿周围神经细胞内 Ca2+浓度。
1.2.5.1 脑细胞分离 参考曹云鹏方法进行了改进。各组大鼠在相应观察点(造模后 24h、48h、72h)断头后剥离全脑,以冰冷的 D-Hanks液冲洗,去除小脑、脑干及部分白质并仔细剥离脑膜、血管(其中脑出血大鼠清除血肿),再次以 D-Hanks液冲洗 3次后剪碎,置于 20ml含 0.25%胰蛋白酶的 D-hanks液中,在 37℃条件下消化 15min后,以冰冷的含10%小牛血清的适量 Hanks液终止反应。组织块以吸管轻轻吹打后过 200目筛网,滤液以 1000rpm离心 5min,沉淀再次以 Hanks液冲洗 1次,最后将细胞悬浮于 37℃的 Hanks液中。台盼蓝除外试验检查,细胞存活率在 90%以上,将细胞数调整到 2×106个/ml。
1.2.5.2 Fura-2/AM负载 将上述细胞悬液1.5ml于 37℃下预温 5min后,加入用 DMSO配制的0.5mmol/L的 Fura-2/AM溶液(终浓度为 5μmol/L),37℃恒温振荡 45min,负载后的细胞以含 0.2%牛血清白蛋白的 Hanks液冲洗 2次,以 1000rpm离心 5min,最后沉淀用Hanks液悬浮,测前将细胞悬液37℃复温 5min。
1.2.5.3 荧光测定 采用日立 F-4500型双波长荧光分光光度计,发射光波长为 510nm,选定激发光波长为 340nm和 380nm,两狭缝均为 5nm。先测定静息下两波长的荧光值(F340、F380),两波长的最大荧光值由加入浓度为 10%的 TritonX-10020μl测得(Fmax340、Fmax380);最小荧光值由加入浓度为 100mmol/L的乙二醇双四乙酸(EGTA)80μl(pH>8.5)获得 (Fmin340、Fmin380)。根据公式:[Ca2+]i=Kd(R-Rmin)Fmin380/(Rmax-R)Fmax380nmol/L,计算其中 Kd为 224nmol/L,R=F340/F380。
2 结 果
2.1 各组不同时间点血肿周围神经细胞内Ca2+浓度 正常组大鼠相应部位神经细胞内 Ca2+浓度为 216.2±29.8nmol/L。与正常对照组比较,模型组 24h后血肿周围神经细胞内 Ca2+浓度即显著增高(P<0.01),且 72h内逐渐增加。与模型组比较,药物治疗组 24~72h各时间点血肿周围神经细胞内 Ca2+浓度均明显降低(P<0.05),但均高于正常组(P<0.01)(见表1)。
2.2 各组不同时间点血浆 ET、CGRP含量 正常组大鼠血浆 ET含量 98.46±45.47ng/L、CGRP含量为 44.33±6.90ng/L,ET/CGRP比值为 2.22。模型组血浆 CGRP含量高于正常组(P<0.05),且 72h内逐渐增高;ET含量高于正常组(P<0.05),以 48h升高最明显,之后有下降趋势。药物治疗组血浆 ET及 CGRP含量均高于正常组 (P<0.05),且 72h内维持在一定水平;药物治疗组 24h ET与 CGRP含量高于模型组,CGRP含量增高有统计学意义(P<0.05),而 ET含量增高无统计学意义 (P>0.05);药物治疗组 48h、72h ET及 CGRP含量低于模型组(P<0.05)(见表2)。
2.3 各组不同时间点 ET/CGRP比值 模型48h组比正常组 ET/CGRP比值增高明显 (P<0.05),以 ET升高为主;药物治疗 24h组、48h组比正常组、模型组 ET/CGRP比值降低明显 (P<0.05),均以 CGRP升高为主;其余各组与正常组ET/CGRP比值差别不明显(见表3)。
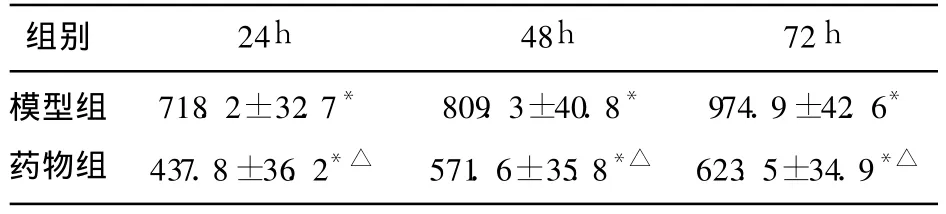
表1 各组不同时间点血肿周围神经细胞内Ca2+浓度变化(nmol/L)
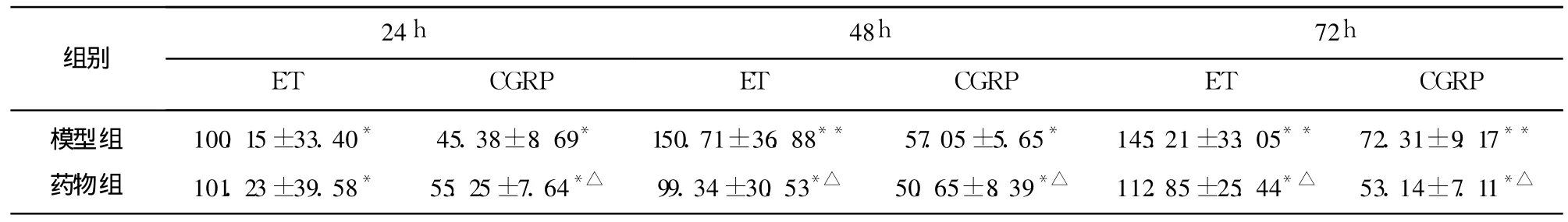
表2 各组不同时间血清CGRP及ET水平变化(ng/L)

表3 各组不同时间点ET/CGRP比值
3 讨 论
Ca2+是细胞内重要的第二信使,是神经细胞发挥正常生理功能不可缺少的因素,主要参与细胞内外信息的传递、神经递质的合成与释放、酶的代谢与调节等。正常细胞中,细胞内外 Ca2+浓度差大致在1万倍,这种浓度差是保证细胞发挥生理功能的前提。细胞内钙离子不仅在正常的细胞功能中起重要作用,而且参与许多疾病的发生和发展过程。
既往研究已明确,Ca2+超载及其所触发的一系列有害代谢是导致神经细胞死亡的最后通路[1],细胞内 Ca2+超载在神经细胞凋亡的发生中起关键作用[5]。Ca2+超载不仅引起神经细胞蛋白质和磷脂代谢紊乱,导致严重的细胞毒性脑水肿,而且也是引起脑血管痉挛、血脑屏障通透性增加、从而使血管源性脑水肿加剧的重要因素。
因此,测定细胞内钙离子浓度对于了解正常细胞功能及与 Ca2+有关疾病的发生机制均有重要意义。ET是一种由 21个氨基酸组成的血管活性多肽,是血管内皮细胞分泌的一种强有力的血管收缩因子,通过激活钙通道、增加钙离子内流、促进血管平滑肌细胞收缩[2],进而引起血管收缩。
CGRP是体内最强的舒血管生物活性多肽,为内源性血管舒张物质。ET与 CGRP二者广泛分布于中枢神经系统和心血管系统中[3]。正常情况下,CGRP与 ET之间处于动态平衡状态维持脑血管的舒缩功能,CGRP对 ET的生物效应能产生拮抗作用、能抑制病理条件下 ET的大量释放[6]。CGRP还可以抑制脂质过氧化的发生,扩张血管,提高脑血流量,有利于侧支循环的开放,减轻缺血缺氧和脑组织损伤的作用,并有引起细胞内 Ca2+浓度下降的作用。
有文献报道[4],脑出血急性期血浆 CGRP及 ET水平高于对照组,以 ET升高尤为显著。
研究认为血浆 ET含量增高原因可能与脑组织缺血、缺氧、应激、内皮细胞损伤及局部凝血酶增加等诸多因素有关,这些因素导致 ET的基因表达增强,从而增加 ET释放。而脑出血时 CGRP水平增高可能是一种代偿机制,CGRP既参与脑损伤的发生发展过程,也在机体病理条件下有防御和代偿作用,与ET在一定范围内保持平衡[7]。
本实验结果表明,大鼠实验性脑出血急性期血肿周围钙离子浓度明显高于正常组,且 3d内逐渐增高;血浆中 ET含量亦高于正常组,以第 2天升高最明显,第 3天血浆 ET含量有所下降,但仍高于正常;血浆中 CGRP含量高于正常组,其变化规律与血浆ET含量变化规律基本一致,但以 ET升高尤为显著。此结果与文献报道[8,9]相符,且与临床上脑出血病情多在 2~3d内恶化相一致,支持脑出血时钙离子浓度、CGRP与 ET的动态变化规律与脑出血、脑水肿病程变化及预后有关。神经细胞内钙超载被认为是引起细胞死亡及脑组织损伤的中心环节,ET可能是脑出血发生、发展及恶化的重要因素[10],而 CGRP在脑出血急性期可代偿性增高,拮抗 ET作用,抑制钙离子内流,发挥其内源性保护作用。
本实验表明:在 β-阻滞剂作用下,钙离子浓度明显下降,从而减轻因细胞内钙超载引起的神经细胞死亡及脑组织损伤;而 ET及 CGRP均有升高,但低于模型组,以 ET降低尤为明显,ET水平高于正常,但稳定在一定水平不持续上升,并且与 CGRP水平相适应,ET/CGRP比值更加接近(略低于)正常,并在一定范围内保持平衡,在这种平衡之中 CGRP略占上风,从而减轻了 ET为主的脑组织损害,为CGRP脑保护作用的发挥创造条件。
本实验仅研究了美托洛尔(β-阻滞剂)对大鼠脑出血后神经损伤的保护作用,并对其作用机制作了简单探讨,认为其神经保护作用可能与抑制钙超载、调控血浆 ET和 CGRP含量有关。神经细胞内钙超载及 ET与 CGRP的动态平衡破坏均参与了脑出血后继发性脑组织的损伤,且各因素间相互联系,互为因果,具体机制尚待进一步探讨。
β-阻滞剂在临床上主要用于高血压病的治疗,而临床上脑出血早期不主张使血压降得过低,以免造成脑灌注压不足,加重脑乏氧,进而加重脑损伤。然而 β-阻滞剂降压作用缓慢且较温和,一般连服 1w方达最高疗效。而且 β-阻滞剂作用结果是使心律减慢、心输出量减少、总外周阻力有所降低,血压不变或略降,但是脑组织血流量并不下降,而是其他组织血流下降。所以 β-阻滞剂并非脑出血治疗的绝对禁忌。
本研究可能为脑出血的辅助治疗提供新的有效途径。
[1] Smaili SS,Hsu YT,Carvalho AC,et al.Mitochondria,calcium and pro-apoptotic proteins as mediators in cell death signaling[J].Braz J Med Biol Res,2003,36:183-190.
[2] Yanagisawa M,Lurihara H,Kimura S,et al.A novel potent vasoconstrictor peptide produced by vascular endothelial cells[J].Nature,1988,332:411-415.
[3] Rosenfeld MG,Mermod JJ,Amara SG,et al.Production of a novel neuropeptide encoded by the calcitonin gene viatissue specific RNA processing[J].Nature,1983,304:129-135.
[4] 温怀凯,应斌宇,倪 莉,等.脑卒中患者血浆内皮素与降钙素基因相关肽含量的变化及意义[J].中华急诊医学杂志,2003,12(10):697-698.
[5] Haughey NJ,Mattson MP.Calcium dysregulation and neuronal apoptosis by the HIV-1proteins Tat and gp 120[J].JAcquir Immune Defic Syndr,2002,31(Suppl 2):55-61.
[6] Mair J,Lechleitner P,Langle T,et al.Plasma CGRP in acute myocardial infarction[J].Lancet,1990,335:168-174.
[7] 陈道文,李作汉.降钙素基因相关肽与脑血管病[J].国外医学脑血管病分册,1996,(4):206-208.
[8] 陈 馥,李露斯.内皮素和一氧化碳与脑血管病[J].国外医学脑血管疾病分册,1997,5(2):84-82.
[9] 温怀凯,邵美娟,应斌宇,等.血浆 ET-1和 CGRP含量测定对脑出血病人的应用价值[J].放射免疫学杂志,2003,16(1):31-32.
[10] 匡洪宇,邹 伟,葛茂振,等.实验性脑出血大鼠急性期血浆内皮素和降钙素基因相关肽含量变化的研究[J].中国危重病急救医学,1999,11(10):627-629.

