神经生长因子对 Aβ致 AD细胞模型中神经元内酸碱度改变及细胞凋亡的影响
李 华, 方伯言, 高 峰
阿尔茨海默病 (Alzheimer's disease,AD)是老年人最常见的神经系统退行性疾病,神经元缺失为其3大病理特征之一,其病因及其发病机制尚不完全清楚。研究[1]证实自发的中枢神经细胞死亡与不可逆转的细胞损伤有关。细胞凋亡被认为与 AD神经元退行性变过程中几个阶段有关,所以有些研究者[2,3]认为 AD中神经细胞死亡是由凋亡介导的。细胞内酸化是细胞凋亡过程中的一种细胞内信号变化,通过影响核酸内切酶的活性、影响原癌基因在凋亡过程中的作用、影响细胞凋亡发生率等途径促进细胞凋亡。本实验利用体外培养大鼠大脑皮质神经元细胞,应用 Aβ25-35诱导大鼠皮层神经元凋亡,检测细胞内 pH值变化及膜上 Na+/H+交换蛋白 1(NHE1)、神经元凋亡的特异标志蛋白钙调蛋白(CaM)表达,阐明细胞内酸化与神经元凋亡的关系。并在制模前后分别加用神经生长因子(nerve growth factor,NGF)干预,明确 NGF可能通过激活 NHE1来抑制神经元凋亡,起到神经保护的作用,从而为NHE1激活剂应用于 AD的治疗提供新的理论依据。
1 材料及方法
1.1 材料及试剂 Aβ25-35、胎牛血清、马血清、DMEM、F12培养基、兔抗 CaM单克隆抗体、兔抗NHE1单克隆抗体,以上药品试剂均购自北京中杉金桥生物技术有限公司;酸碱度荧光探针 2',7'-二(羧乙基)-5(6)羧基荧光黄酯(BCECF/AM)购自Calbiochem公司。
1.2 方法
1.2.1 神经元细胞培养 取出生 24h内的 SD大鼠乳鼠(辽宁医学院动物实验中心提供),75%酒精浸泡消毒,无菌条件下取出大脑皮层,置于培养基中,剔除血管和软脑膜,剪成 1mm3左右的小块。加入 0.125%胰蛋白酶 37℃消化 10min。待细胞分散后,加入含 10%胎牛血清和 10%马血清的 DMEM/F12培养基终止消化。200目筛网过滤,1000转离心 10min,用含 10%胎牛血清和 10%马血清的DMEM/F12制成细胞悬液,调整细胞密度为 1×105~1×106/ml,接种在铺有 L-多聚赖氨酸的 6孔培养板中,置于 37℃、5%CO2培养箱中培养。培养 48h后加入含阿糖胞苷(终浓度为 5mg/L)的培养基,抑制非神经元细胞增殖。以后每 3d换液一次,培养7d后加用 Aβ25-35处理,并按不同的实验分组加用NGF处理。
1.2.2 构建 AD细胞模型 AD组:利用Aβ25-35诱导大脑皮层神经元细胞建立 AD细胞模型,Aβ25-35终浓度为 20μmol/L,接触 24h。 NGF预防组:加用 Aβ25-35前 72h加用 NGF培养,NGF终浓度为50μg/L。 NGF治疗组:加入 Aβ25-35片段接触 24h后加用 NGF继续培养,NGF终浓度 50μg/L。以上各组在 Aβ25-35脱离接触后 12、24、48、72h收集细胞用于实验。
1.2.3 Aβ25-35的孵育 选择 Aβ25-35片段,用三蒸水配制成 100μmol/L,过滤,分装,-20℃冻存,使用前老化处理并配制成所需浓度(将 Aβ25-35溶解在DMSO中,再用 DMEM稀释,置于 37℃下孵育 7~14d,即为老化处理)。
1.2.4 Western印迹分析法测 NHE1及 CaM表达 将收集的细胞用冷的 PBS冲洗,放入预冷的裂解缓冲液中裂解,用 Lowry法测定蛋白质含量,电泳后将 PAGE凝胶中的蛋白质电转移至PVDF(硝酸纤维素膜)上,取出后将膜放入 3%BSA阻断缓冲液中,封闭 60min,TBS洗膜 3次,将膜放入一抗中(1∶500稀释),4℃过夜。TTBS冲洗后,将膜放入二抗(1∶500稀释)中,室温孵育 1~2h,用 TTBS洗膜 3次,最后用 TBS洗膜一次,放入 NBT/BCIP显色液中避光显色,直至染色出现,终止反应。将蛋白印迹显影图扫描,利用凝胶自动分析成像软件 Chem Image 5500对蛋白带进行灰度值分析。以上试验步骤重复 3次。
1.2.5 细胞内 pH值的测定
1.2.5.1 制定标准曲线 用 DMEM培养液清洗细胞 2次,加入终浓度 1μg/ml荧光染料 BCECF/AM,37℃孵育 30min,清洗 3次后重新悬浮于 pH值分别为 6.4、6.6、6.8、7.0、7.2、7.4、7.6的 KCl溶液(25mmol/L HEPES,145mmol/L KCl,0.8mmol/L MgCl2,1.8mmol/L CaCl2,5.5mmol/L葡萄糖),加入1μg/ml尼尔尼亚素,37℃孵育 10min,立即用激光共聚焦显微镜检测,以氩激光 488nm激发细胞内BCECF,检测相应细胞 530nm和 640nm发射荧光,求出荧光比值,做出 pH值与荧光比值之间关系的标准曲线,pH与 530nm/640nm荧光比值之间有良好的线性关系(r>0.995)。
1.2.5.2 细胞内 pH值测定 收集 5×106/ml细胞,用 DMEM培养基清洗 3次,加入 1μg/ml荧光染料 BCECF/AM,37℃孵育 30min,清洗 3次后上机检测,记录 530nm与 640nm发射荧光,求出两者的比值。通过标准曲线推算细胞内 pH值。
1.2.6 统计学处理 实验数据用(均值 ±标准差)表示,实验重复 5次,用 SPSS 11.5软件包进行分析,两组间比较采用 LSD,s post hoc test进行统计学分析,以 P<0.05表示差异有显著性;P<0.01表示差异非常显著。
2 结 果
2.1 各时间点 Western-blot结果比较
2.1.1 与 Aβ25-35组比较 NGF预防组内 NHE1具有高表达性,与 Aβ25-35组有显著差异(P<0.01);与 Aβ25-35组比较,NGF治疗组内 NHE1具有高表达性,与对照组有显著差异(P<0.01),而且随培养时间的延长各组内 NHE1表达均有不同程度的增强(见图1、表1)。
2.1.2 与 AD组比较 NGF预防组内 CaM具有低表达性,与 AD组有显著差异(P<0.01);与AD组比较,NGF治疗组内除加用神经生长因子 12h时与对照组比较 CaM表达差异无显著性外,其余各时间点及处理因素下与对照组比较均有低表达性,与AD组有显著差异(P<0.01)(见图2、表2)。
2.2 各时间点神经元细胞内 pH值比较 各组神经细胞内 p H随培养时间延长均呈降低趋势,各时间点比较 NGF预防组及治疗组细胞内 pH降低幅度较 AD组细胞低,两组比较有明显差异(P<0.01,P<0.05)(见表3)。
表1 各时间点 NHE1(130k Da)的表达±s)
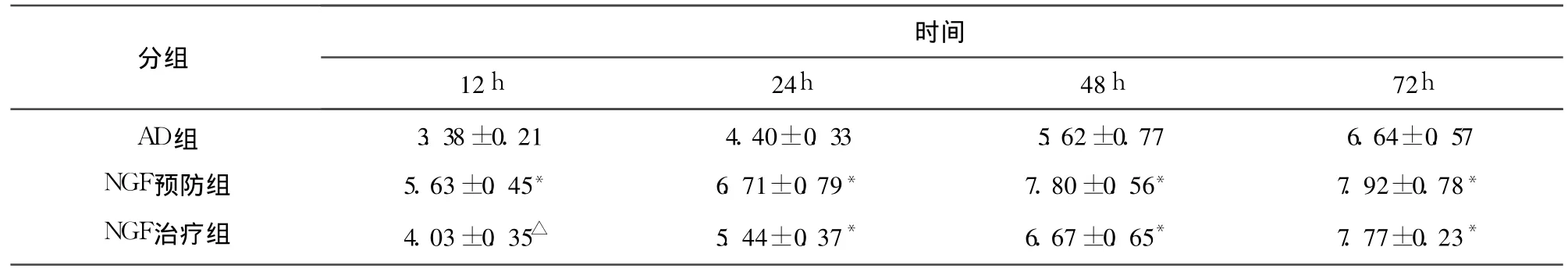
表1 各时间点 NHE1(130k Da)的表达±s)
与 AD组比较*P<0.01,△P<0.05
AD组NGF预防组NGF治疗组3.38±0.215.63±0.45*4.03±0.35△4.40±0.336.71±0.79*5.44±0.37*5.62±0.777.80±0.56*6.67±0.65*6.64±0.577.92±0.78*7.77±0.23*
表2 各时间点 CaM(49k Da)的表达 ±s)

表2 各时间点 CaM(49k Da)的表达 ±s)
与 AD组比较*P<0.01
AD组NGF预防组NGF治疗组1.33±0.220.99±0.23*1.24±0.281.77±0.111.33±0.22*1.48±0.32*1.89±0.231.61±0.34*1.68±0.17*2.1±0.191.80±0.11*1.90±0.24*
表3 各时间点神经元细胞内pH值比较 ±s)
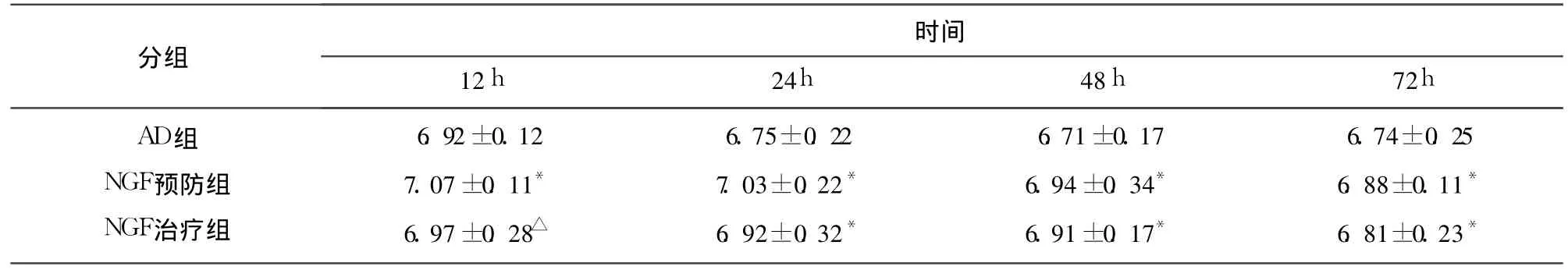
表3 各时间点神经元细胞内pH值比较 ±s)
与 AD组比较*P<0.01,△P<0.05
AD组NGF预防组NGF治疗组6.92±0.127.07±0.11*6.97±0.28△6.75±0.227.03±0.22*6.92±0.32*6.71±0.176.94±0.34*6.91±0.17*6.74±0.256.88±0.11*6.81±0.23*

图1 NHE1的 Western-blot检测
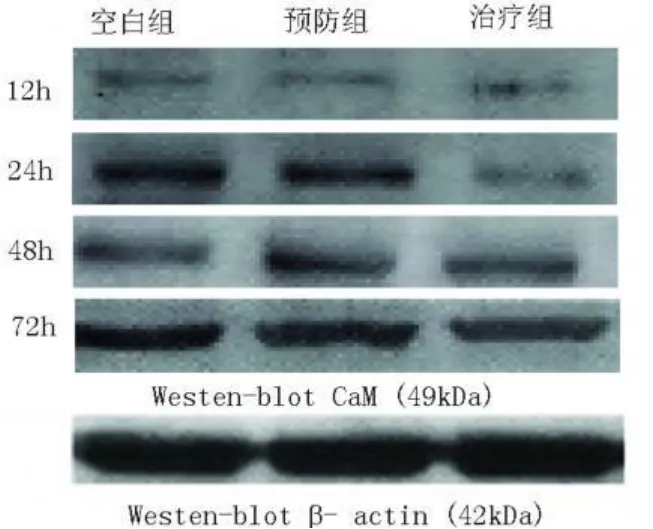
图2 CaM的 Western-blot检测
3 讨 论
阿尔茨海默病(AD)是一种进行性发展的致死性神经退行性疾病,严重影响患者的工作能力和生活质量,也为家庭和社会带来沉重的负担。关于 AD的发病进展存在许多假说,如老年变性病、遗传、病毒感染、炎症、铝中毒[4]、胆碱系统功能缺陷、细胞骨架改变及颅脑外伤等假说,但均不完善,针对以上病因采取的抗炎、抑制胆碱酯酶、调控退化谷氨酸能神经元的突触活性及扩血管改善供血、营养神经和抗氧化治疗等治疗措施,也仅是对症治疗,不能延缓病程的进展。因此,寻找针对病因的治疗药物和手段,是当今研究的难点和热点。深入研究 AD的发病机制和治疗措施成为医务工作者刻不容缓的责任。
AD的主要病理特征为老年斑、神经原纤维缠结、区域选择性神经元数目减少和颗粒空泡变性,神经元细胞减少与神经系统的不可逆转的神经元凋亡有关[1]。由于各种物理和化学刺激因素诱导的细胞凋亡都同时出现细胞内酸化,细胞酸化与细胞凋亡之间的关系就成为人们关注的热点[5,6]。Ibarreta D[7]等利用 AD患者的淋巴母细胞研究证明,α-IgM诱导的细胞内酸化在 AD更为明显,这就说明 AD患者的淋巴母细胞对酸负荷后细胞内 H+缓冲能力和质子外流率都降低。本实验中无论 AD组还是 NGF治疗组、NGF预防组随造模时间的延长,细胞内 pH值持续降低,AD组 pH值降低趋势尤其明显,以上研究结果说明,细胞内的 p H降低在 AD的病理生理进程中起着重要作用。
钠氢离子交换蛋白(Na+/H+Exchanger,NHE)是维持细胞内环境的细胞膜蛋白,它是存在于所有真核细胞的一种跨膜蛋白,该蛋白涉及细胞的多种功能,包括调节细胞内 pH值(intracellur pH,pHi)、细胞体积的控制以及离子转运等。Urcelay E等[8]研究证明,AD患者淋巴母细胞细胞膜上 NHE的激活可以促进淋巴母细胞的增殖,这种效应与表面受体介导的钙调蛋白信号途径有关,它可以被 NHE的抑制剂所抑制。NHE激活或表达增多,可导致细胞内的 p H升高,而 NHE的抑制或表达下调,则使细胞内的 pH降低,细胞酸化。本实验中各组细胞随模上NHE1表达的增强,细胞内 p H值下降趋势减慢,但并没完全停止,更没有出现随 NHE1表达增强细胞内 pH上升的情况,这说明在实验时间段内 NHE1表达增强不能完全对抗 Aβ25-35诱导神经元凋亡的毒性作用。越来越多的资料表明钙调蛋白与许多神经系统疾病有关,AD的发生已被证实部分是由于脑细胞内 CaM以及依赖于 CaM的激酶(PKC,PLA)等活性增高所致[9]。NHE1的 C端功能域存在与钙调蛋白结合的两个位点,钙调蛋白能与 NHE1特异性结合,是其必要的活性调节亚单位,CaM的启动与激活可抑制 NHE表达。实验结果显示随造模时间的延长各组内细胞 CaM与 NHE1的表达均是持续性增强的,这可能 Aβ25-35的细胞毒性持续作用有关。
神经生长因子(NGF)是最早发现和最典型的神经营养因子,其生物学效应可以分为神经系统和非神经系统两大类,有促进神经元分化、保护效应神经元、诱导神经纤维定向生长和再生等多种效应。本实验各组数据显示,NGF预防组与 NGF治疗组内NHE1均具有高表达性,与 AD组比较有显著差异(P<0.01,P<0.05),而且随培养时间的延长各组内NHE1表达均有不同程度的增强。这说明作为NHE1激动剂,神经生长因子作用明显。与 NHE1表达相对应,在 NGF作用下,预防组及治疗组内 pH值较 AD组明显增高,差异具有显著性(P<0.01)。相反,NGF预防组与治疗组内各时间点细胞 CaM表达较 AD组明显要低,差异有显著性(P<0.01)。以上研究结果说明神经生长因子能显著增强 NHE1表达,有效地对抗 Aβ25-35对离体培养的神经元细胞的毒性作用。
总之,神经生长因子可通过增强细胞膜上 NHE1的表达,有效地提高细胞内 pH值,对抗 Aβ25-35对离体培养的神经元细胞的毒性作用,达到抗神经元细胞凋亡的目的。神经生长因子分子量大,不易通过血脑屏障,这是神经生长因子应用于 AD治疗的最大的困扰。相信随着受体介导转运的经鼻腔脑靶向给药、促进内源性 NGF合成的化合物、增强内源性NGF作用的化合物、NGF基因治疗、NGF联合治疗等几方面研究[10]的不断进展,神经生长因子及其它类型的 NGF激动剂如咪唑等在 AD治疗中得到应用。
[1] Harguindey S,Reshkin SJ,Orive G,et al.Growth and trophic factors,pH and the Na+/H+exchanger in Alzheimer's disease,other neurodegenerative diseases and cancer:new therapeutic possibilities and potential dangers[J].Curr Alzheimer Res,2007,4(1):53-65.
[2] Putney LK,Denker SP,Barber DL,et al.The changing face of the Na+/H+exchanger,NHE1:Structure,regulation,and cellular actions[J].Annu Rev pHarmacol Toxicol,2002,42:527-552.
[3] Hirpara J,Clément M-V,Pervaiz S,et al.Intracellular acidification triggered by mitochondrial-derived hydrogen peroxide is an effect or mechanism for drug-induced apoptosis in tumor cells[J].J Biol Chem,2001,276(1):514-521.
[4] Tang MX,Cross P,Andrews H,et al.Incidence of AD in African-A-mericans,Caribbean Hispanics,and Caucasians in northern Manhattan[J].Neurology,2000,56(1):49-56
[5] Gottlieb RA,Nordberg J,Skowronski E,et al.Apoptosis induced in Jurkat cells by several agents is preceded by intracellular acidification[J].Proc Natl Acad Sci USA,1996,93:654-658.
[6] Caceres-Cortes J,Rajotte D,Dumouchel J,et al.Product of the steel locus suppresses apoptosis in hemopoietic cells.Comparison with pathways activated by granulocyte macrophage colony-stimulating factor[J].J Biol Chem,1994,269(16):12084-12091.
[7] Ibarreta D,Urcelay E,Parrilla R,et al.Distinct pH homeostatic features in lymphoblasts from Alzheimer's disease patients[J].Ann Neuro,1998,44(2).216-222.
[8] Urcelay E,Ibarreta D,Parrilla R,et al.Enhanced proliferation of lymphoblasts from patients with Alzheimer dementia associated with calmodulin-dependent activation of the Na+/H+exchanger[J].Neurobiol Dis,2001,8(2):289-298.
[9] Shirasaki Y,Kananzawa Y,Morishima Y,et al.Involvement of calmodulin in neuronal cell death[J].Brain Res,2006,14,1083(1):189-195.
[10] 马东亮,胡海涛,王建明.人脑源性神经营养因子重组腺伴随病毒的制备[J].西安交通大学学报(医学版),2003,24(5):431-437.

