缺血性脑卒中 OCSP分型与神经影像学及脑血管改变之间的关系
朱明勤, 徐琳琳, 冯加纯
目前基于缺血性卒中的分型方法很多,主要有病因学分型、症状学分型、影像学分型 3大类。对患者进行正确的分型对于指导下一步治疗以及判断预后有非常重要的价值。DSA检查是目前国际比较公认的金标准,它可以直接显示血管狭窄或闭塞的部位以及程度,但由于是有创性检查,有一定的风险,价格比较昂贵,临床的应用率并不高。其他分型方法诊断的准确性如何?各种分型方法之间的相关性又如何呢?本文就目前国际上比较公认的几种分型方法和它们之间的关系进行研究。
1 资料和方法
1.1 一般资料 收集吉林大学第一医院神经内科 2004年 6月 ~2008年 11月间因缺血性脑血管病住院行 DSA检查的患者共 227例。年龄范围为35~75岁(平均值 56.35±3.62岁),男性 177例,女 50例。
1.2 按症状分型方法 牛津郡社区卒中项目(Oxfordshire Community stroke projec,t OCSP)分型是Bamford等[1]提出的临床分型方法,以脑卒中所致的临床表现为依据,将急性缺血性脑卒中分为 4个型:(1)完全前循环梗死(TACI);(2)部分前循环梗死(PACI);(3)后循环梗死(POCI);(4)腔隙性梗死(LACI)。
1.3 影像学分类[2,3](1)前循环皮质梗死或纹状体囊区梗死(CO);(2)低灌流梗死,包括半卵圆中心梗死和交界区梗死(LFI);(3)深穿枝区直径小于 2cm的皮质下小梗死(SSI);(4)除 SSI以外的后循环梗死(PCI)。
1.4 OCSP分型与 DSA一致性标准 (1)TACI得到 DSA证实:发现 MCA主干或 ICA闭塞,同时后循环的血管正常或虽异常但与临床和神经影像学不对应;(2)PACI得到 DSA证实:发现 MCA分支闭塞、ACA闭塞,或在未见大血管主干闭塞同时,发现有较严重的血管狭窄,同时后循环的血管正常或虽异常但与临床和神经影像学不对应;(3)LACI得到 DSA证实:未发现前后循环的大血管狭窄和阻塞;(4)POCI得到 DSA证实:发现有椎基底动脉系统血管的狭窄和闭塞,同时前循环的血管正常或虽异常但与临床和神经影像学不对应。
1.5 OCSP与影像学分类一致性标准 (1)TACI得到影像学证实:前循环皮质梗死或纹状体囊区死(CO);(2)PACI得到影像学证实:前循环皮质梗死或纹状体囊区梗死(CO)或低灌流梗死,包括半卵圆中心梗死和交界区梗死(LFI);(3)LACI得到影像学证实:深穿枝区直径小于 2cm的皮质下小梗死(SSI);(4)POCI得到影像学证实:除 SSI以外的后循环梗死(PCI)。
1.6 数据处理和统计学方法 连续变量统计描述采用平均数 ±标准差±s),组间频数资料比较采用卡方检验,所有统计分析采用 SAS统计软件完成,显著性差异的标准是 P<0.05(双侧检验)。
2 结 果
2.1 OCSP各型的构成 227例患者中部分前循环梗死型(PACI)107例占 47%;后循环梗死型(POCI)70例占 31%;完全前循环梗死型(TACI)29例占 13%;腔隙性梗死型(LACI)21例占 9%。各亚型之间的性别及年龄差异 P=0.98>0.05,无统计学意义。表明 OCSP各型在年龄和性别构成方面无显著性差异。
2.2 OCSP各型在影像及血管改变的构成 完全前循环梗死(TACI)中,属于皮质下梗死(CO)的占 62.07%;部分前循环梗死(PACI)中属于低灌流区 LFI和皮质下(CO)分别占 47.66%、29.21%;腔隙性梗死型(LACI)属于皮质下小梗死(SSI)的占61.90%。后循环梗死型(POCI)属于后循环梗死(PCI)的占 52.86%(见表1)。
完全前循环梗死(TACI)中病变位于颈内动脉(ICA)的占 58.62%;部分前循环梗死(PACI)中血管改变位于颈内动脉(ICA)和大脑中动脉(MCA)的分别为 40.19%和 43.93%;腔隙性梗死(LACI)中各个血管病变的比例相接近;后循环梗死(POCI)中属于椎动脉和基底动脉(VA+BA)的占 58.57%。我们用卡方检验比较 PACI+TACI,POCI组在 ICA+MCA,和 VA+BA之间的构成 P=0.0001<0.05各组之间的差异有统计学意义(见表2)。
2.3 OCSP各型与影像学及血管病变敏感性,特异性及一致性 OCSP分型预测前循环病变部位的一致性为 77.97%,敏感性、特异性、阳性预测值、阴性预测值分别为 84.68%、69.90%、77.20%、79.12%。OCSP分型预测 LACI病变部位的一致性为 79.30%,敏感性、特异性、阳性预测值、阴性预测值分别为25.00%、95.43%、61.90%、81.68%。OCSP分型预测后循环病变部位的一致性为 79.30%,敏感性、特异性、阳性预测值、阴性预测值分别 72.55%、81.25%、52.85%、91.08%。OCSP分型能够较好的预测前后循环血管病变的部位。诊断前循血病变的一致性为78.41%,敏感性、特异性、阳性预测值、阴性预测值分别为 80.85%、74.41%、83.82、70.33%。 OCSP分型诊断后循环血管病变的一致性为 71.81%,敏感性、特异性、阳性预测值、阴性预测值分别为 74.55%、80.79%、77.35%、58.57%。
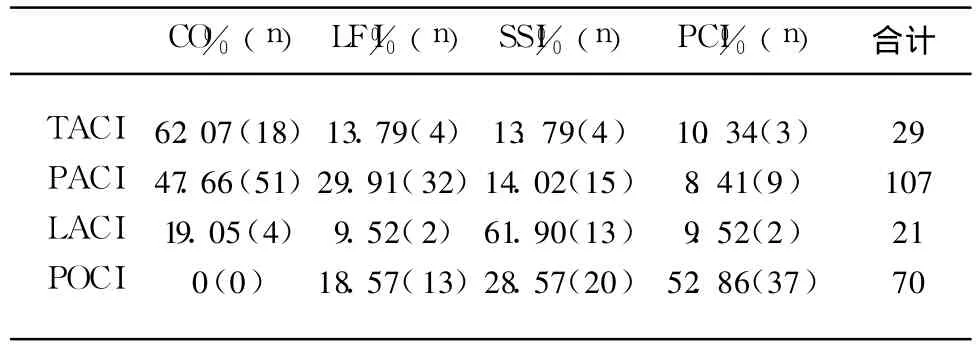
表1 OCSP各型在 CT/MRI上病变部位的构成
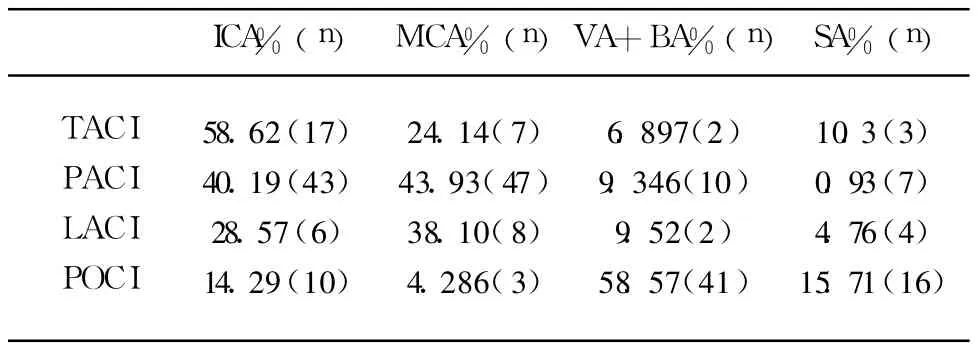
表2 OCSP各型经DSA血管病变部位的分布
3 讨 论
3.1 存在颅内大血管狭窄的人群中 OCSP各亚型的构成情况 国内外以往的研究均显示 LACI为所占比例最多的亚型,POCI最少[4,5]。而本研究显示:部分前循环梗死型(PACI)所占比例最大占47%;提示存在颅内大血管狭窄的人群最常发生的卒中是部分前循环梗死,其次是后循环梗死。这就为存在颅内外血管狭窄人群的卒中的诊断和治疗提出了新的问题和挑战。
3.2 OCSP与影像学病变部位一致性的评价随着超早期溶栓技术的成熟,OCSP分型越来越多的被应用于评价拟进行超早期溶栓的患者。OCSP分型与早期影像学改变的一致性问题越来越受到国内外学者的关注[6,7]。结果表明除腔隙性梗死外,其余各型与 CT病变部位的符合率较好,这对于指导超早期溶栓有重要的临床意义。除 LACI外,其他各型预测影像学相应病变位置的敏感性、特异性、阳性预测值和阴性预测值在 71%~96%之间。影响 OCSP分型与影像学病变一致性的因素有多种,而神经体征的变动及评价时间是主要的影响因素。脑梗死早期的症状体征不稳定,个人的专业经验和技能水平也使检出的症状和体征有差异。因此,临床医生在单纯根据临床表现制定治疗方案时应当慎重。
3.3 OCSP各型和血管病变的一致性评价2007年一项亚洲南部的流行病学调查表明[8],OCSP各亚型大血管病变的发生率分别为 TACI型占79%;PACI型占 47%;POCI型占 65%;LACI型占44%。OCSP分型中,TACI和 PACI及 POCI亚型与脑动脉血管狭窄有密切的关系,能够提示动脉血管狭窄的存在及程度[9]。血管狭窄的部位和 OCSP分型一致性较好[10]。本研究也证实了这一点。表2示完全前循环梗死(TACI)中病变位于颈内动脉(ICA)的占 58.62%;部分前循环梗死(PACI)中血管改变位于颈内动脉(ICA)和大脑中动脉(MCA)的分别为 40.19%和 43.93%;腔隙性梗死(LACI)中各个血管病变的比例相接近;后循环梗死(POCI)中属于椎动脉和基底动脉(VA+BA)的占 58.57%。脑损伤的程度和损伤的部位以及局部血管的分部和血管的状态密切相关。再通闭塞的脑血管是获得良好溶栓效果的基础,提高血管再通率是改善 ICA或MCA主干闭塞疗效的一个关键[11]。分水岭脑梗死约占全部脑梗死患者的 10%。尽管 CWI的病因不甚明确,但 CWI的发生与颅内、外大血管的狭窄密切相关[12,13]。动脉粥样硬化性 ICA/MCA狭窄、闭塞性病变引起脑梗死的可能机制包括:血栓形成导致完全闭塞、动脉-动脉栓塞、血流动力学改变或这些因素的联合作用[14,15]。OCSP分型能够较好的预测前后循环血管病变部位。这对于指导临床工作有很重要的意义。在脑梗死急性期影像学改变的阳性率低,而 OCSP分型可以不借助任何辅助检查对急性期患者进行分型,为临床诊断和治疗提供依据。尤其是在基层医院,各种检查设备不全面,OCSP分型能够为医生提供第一手的资料。然而,我们在研究中发现,有数例患者存在多根大血管的狭窄,我们把能解释此次发病的血管病变定为责任血管,这种分型显然会对研究的结果造成一定的偏倚。本研究的样本量少,是回顾性研究,原始资料上对大血管狭窄部位的记载不够精确和细致。本研究的结果需要更大的样本和更细致深入的前瞻性研究来证实。
[1] Bamford J,Sandercock P,Dennis M,et al.Classification and natural history of clinically identifiable subtypes of cerebral infarction[J].Lancet,1991,337(8756):1521-1526.
[2] Weller C,Ringelstein EB,Reiche W,et al.Clinical and hemodynamic aspects of low flow infarcts[J].Stroke,1991,22(11):1117-1123.
[3] Bogousslavsky J,Regli F.Centrum ovale infarcts:subcortical infarction in the superficial territory of the middle cerebral artery[J].Neurology,1992,42:1992-1998.
[4] 刘学东,吕雅丽.脑梗死 OCSP分型和预后[J].中风与神经疾病杂志,2006,23(6):681-682.
[5] De Silva DA,Woon FP,Pin LM,et al.Intracranial large artery disease among OCSP subtypes in ethnic South Asian ischemic stroke patients[J].J Neurol Sci,2007,260(1~2):147-149.
[6] Wlodek A,Sarzyńska-Dugosz I,Sandercock PA,et al.Agreement between the clinical Oxfordshire Community Stroke Project classification and CT findings in Poland[J].Eur J Neurol,2004,11(2):91-96.
[7] Kobayashi A,Wardlaw JM,Lindley RI,et al.Oxfordshire community stroke project clinical stroke syndrome and appearances of tissue and vascular lesions on pretreatment ct in hyperacute ischemic stroke among the first 510 patients in the Third International Stroke Trial(IST-3)[J].Stroke,2009,40(3):743-748.
[8] De Silva DA,Woon FP,Pin LM,et al.Intracranial large artery disease among OCSPsubtypes in ethnic South Asian ischemic stroke patients[J].J Neurol Sci,2007,260(1~2):147-149.
[9] 方瑞乐,王拥军.OCSP分型与脑动脉血管狭窄的一致性分析[J].山东医药,2005,45(34):51-52.
[10] Zhang H,Liu X,Xu G,et al.Arterial stenosis detected by digital subtraction angiography and its relationship with the Oxfordshire Community Stroke Project classification[J].JInt Med Res,2007,35(1):113-117.
[11] 郑维红,葛 华 .颈内动脉系统急性脑梗死的溶栓治疗[J].中风与神经疾病杂志,2009,26(2):237-238.
[12] Chaves CJ,Sliver B,Schlaug G,et al.Diffusion-and perfusion weighted MRI patterns in borderzone infactsE[J].Stroke,2000,31(5):1090-1096.
[13] Derdeyn CP,Khosla A,Videen TO,et al.Severe hemodynamic impairment and border zone-region infarction[J].Radiology,2001,220(1):195-201.
[14] Kang DW,Chu K,Ko SB,et al.Lesion patterns and mechanismof ischemia in internal carotid artery disease:a diffusion weighted imaging study[J].Arch Neurol,2002,59(10):1577-1582.
[15] Chaves CJ,Staroselskaya I,Linfamte I,et al.Patterns of perfusionweighted imaging in patients with carotid artery occlusive disease[J].Arch Neurol,2003,60(2):237-242.

