骨桥蛋白反义寡核苷酸对微缺氧下人结肠癌细胞HT-29增殖活性及侵袭力的影响
杨庆强,唐春燕
(泸州医学院:1.附属医院普外科;2.护理学院卫校,四川 646000)
在适度缺氧的应激下,肿瘤细胞的起始因子-2α被磷酸化,大多数蛋白质的翻译被抑制,另一方面,特定的缺氧诱导蛋白合成增加,由此基因表达和表型出现转变,肿瘤细胞的生物学行为发生改变,该反应受缺氧程度及时间的影响[1]。作者在前期的研究中将培养液PO220 mm Hg作为微缺氧环境,检测到在微缺氧下H T-29细胞骨桥蛋白(OPN)特异性的表达上调,且HT-29细胞异质性黏附能力、侵袭游走能力显著增强,MMP-2/9活性上调而向恶性表型转化。反义寡核苷酸(antisense oligonucleotide,ASODN)是能与目标mRNA互补的DNA片段。应用ASODN阻断特定基因的表达,研究基因的功能已经成为可能。本实验将靶向OPN ASODN转染至微缺氧下高表达OPN的HT-29细胞,试图特异性地封闭OPN m RNA,以进一步探讨OPN在微缺氧诱导的恶性转化中的作用。
1 材料与方法
1.1 材料 Lipofectamine 2000(invitrogen公司,Santa Cruz Biotechnology),RT-PCR试剂盒(杭州博日公司),明胶(Sigma),matrigel基底膜基质(BD Bioscience),含 4.8%O2、90.2%N2和5%CO2三元混合气体,自行设计的缺氧培养装置等。
1.2 细胞培养 HT-29细胞在含10%胎牛血清的RPMI-1640培养液中贴壁生长,以0.1%胰酶传代。在前期的实验中,作者用溶解氧测定仪实时监测,已摸索出持续低流量灌注4.8%O2,培养液氧分压恒定于20 mm Hg。缺氧条件参照文献[2],并稍作改进。
1.3 ASODN的设计 在Genbank查询OPN基因序列NM_000582,参照文献[3]设计并合成了由20个碱基组成的正义、反义、错义寡核苷酸(missense oligonucleotide,MODN)。各自序列如下:ASODN 序列为 5′-CTA ACT TAA AAA ACA AAA GA-3′。正义寡核苷酸(sense oligonucleotide,SODN)序列为 5′-TCT T TT GT T TTT TAA GT T AG-3′。 MODN 序列为 5′-AGT TGC GGA AAT GAG TG-3′。
1.4 ASODN的转染 将处于对数生长期的HT-29细胞制成浓度为1×105个/m L的细胞悬液,每孔2 m L接种于 6孔培养板,待细胞增殖至60%~70%融合时,吸弃培养液,每孔加入lm L含10μL/m L ODN及终浓度为10μL/m L脂质体的转染液,于37℃、5%CO2及饱和湿度的培养箱中培养6 h。去除转染液,加入2 m L 10%FBS/RPMI-1640培养液,继续培养18 h。根据实验所需,将细胞进行微缺氧培养用于后续实验。
1.5 RT-PCR分析 实验分组:微缺氧空白组、脂质体对照组、SODN组、MODN组、ASODN组。各 ODN组均以 10 μmol/L转染H T-29细胞,转染24 h后再微缺氧培养24 h。各组细胞均用0.1%胰酶消化,制成细胞悬液并行细胞计数,每个样本收集等量细胞2×106,用T RNzol试剂抽提总 RNA,步骤按说明书进行。在genbank查询OPN基因序列NM_000582,用primer5.0软件自行设计引物序列,上游引物为5′-ACC CTT CCA AGT AAG TCC AAC-3′;下游引物为 5′-GGT GAT GTC C TC GTC TGT AGC-3′,预计扩增片断为354 bp。内参 β-actin的上 游引物为 5′-TTG TAA CAA ACT GGG ACG ATA TGG-3′;下 游引 物为 5′-GAT CT T GAT CT T CAT GGT GCT AG-3′,预计扩增片断为764 bp。用逆转录酶和oligo-d T等按 42℃60 min,70℃10 min条件进行cDNA的合成。取逆转录产物5μL、10×RT-PCR Buffer 5μL,MgCl23μL,d NTP Mixture 1μL,上、下游引物各 1μL 及 Taq mix DNA polymerase 0.5μL加入无菌双蒸水至反应总体积为50μL。反应条件为:94℃变性3 min;94℃变性45 s,53℃退火复性45 s,72℃延伸 45 s,共 32个循环后再72℃延伸 5 min。反应体系以β-actin作为内参照。PC R产物用含溴化乙啶的1.5%琼脂糖凝胶电泳,凝胶在Bio-Rad的UⅥ图像处理系统上分析、计算,得出OPN、β-actin的光密度,以β-actin的光密度为参照物,求出OPN光密度与之相比的相对值,得到OPN m RNA表达的半定量结果。
1.6 Western blot分析 将细胞质蛋白进行10%SDS-聚丙烯酰胺凝胶电泳分离,电转移至PVDF膜,用5%脱脂奶粉室温封闭1 h,加入1∶400稀释的羊抗人骨桥蛋白多克隆抗体,4℃过夜,β-actin作内参照。TBS T洗膜3次,10 min/次,加入1∶1000稀释的辣根酶标记兔抗山羊Ig G,37℃1 h,同样洗膜3次,膜上均匀滴加ECL发光试剂,在Bio-Rad图像处理系统Hisensitivity模式下连续曝光显影,对蛋白条带进行灰度相对强度测定,得出积分灰度值,以积分值代表蛋白的表达量。
1.7 M TT检测HT-29细胞的增殖活性 收集对数生长期HT-29细胞,胰酶消化制成5×104/m L细胞悬液,以 200μL/孔接种于96孔板,常氧下、37℃、5%CO2培养24 h待细胞贴壁。各组细胞微缺氧培养 6、12、24、48 h。同时设不加细胞的背景对照,每组设8个复孔,实验重复3次。到达预设时限点时,每孔加入(5 mg/m L)M TT溶液20μL,37℃孵育4 h。弃旧液,每孔加入150μL DMSO,37℃,水平振荡5 min,用酶联免疫检测仪于波长570 nm处测定各孔吸光度(A 570)。扣除背景对照的A 570值即代表存活细胞数量。制作细胞生长曲线,计算细胞抑制率(IR)。IR=(微缺氧空白组 A570-实验组A570)/微缺氧空白组A 570×100%。
1.8 细胞黏附力检测 用无血清RPMI-16401∶3稀释matrigel,以20μL/孔加入96孔培养板,成胶后紫外光消毒灭菌后备用,接种细胞前水化基底膜。取对数生长期 HT-29细胞配成浓度为1×105/m L的细胞悬液,各组均取4 m L接种于培养瓶。微缺氧下培养48 h后,取出各组细胞,用0.1%胰酶消化,调整细胞密度为 5×105/m L,每孔200μL接种于 96孔培养板常规培养。每组细胞均设对照,并分为30、60、90、120 min时段组,每时段组设8个平行孔。于各时段点吸弃培养液及悬浮细胞,PBS冲洗除去未黏附的肿瘤细胞,弃PBS加入 200μL无血清RPMI-1640、20μL MT T培养4 h,吸弃培养上清液,加入二甲亚砜(DMSO)200μL,用酶联免疫检测仪于波长570 nm处测定各孔吸光度(A 570)。细胞黏附率=实验组A570值/对照组 A570值×100%。
1.9 明胶酶谱分析 待测细胞常规消化后,以106个细胞/孔、10%FBS/RPMI-1640接种到6孔板内过夜培养。次日用0.01 mmol/LPBS(p H7.4)洗涤后,各组细胞用无血清RPMI-1640分别在微缺氧下培养24 h,收集其上清液,实验方法参照文献[4]:上清液与 4×上样缓冲液(62.5 m M Tris-Hcl、p H6.8,10%甘油,2%SDS,0.1%溴酚蓝)按照1∶3混合,上样后在1.5%明胶/8%聚丙烯酰胺凝胶、80 V 20 min、100 V 2 h衡压电泳。凝胶分别用洗脱液(2.5%T ritonX-100)、孵育液37℃、24 h(50 m M Tris-HCl、p H7.5 ,0.2 M NaCl,5 m M CaCl2,0.02%Triton X-100),染色缓冲液(0.4%考马斯亮蓝 R-250,10%冰醋酸,20%甲醇)和脱色缓冲液(10%冰醋酸,20%甲醇)至显现出明显的蛋白负染条带。用Bio-Rad的图像处理系统对负染条带进行扫描并定量分析,负染条带的大小、亮度反映MMP-2/9的活性。
1.10 统计学处理 用SAS9.0统计软件分析。计量资料以表示,采用方差分析或 t检验。
2 结 果
2.1 OPN m RNA表达 RT-PCR结果显示,各组均分别在354、764 bp处出现特异性的 OPN基因条带和内参照β-actin条带。OPN ASODN转染HT-29细胞24 h后,再微缺氧培养24 h,其OPN m RNA的表达较微缺氧空白组、脂质体对照组、SODN组、MODN组下调68.5%(P<0.01),而各对照组间差异无统计学意义(P>0.05),见图1。
2.2 OPN蛋白表达 ASODN组OPN蛋白表达较各对照组均明显下调(P<0.01),表达量是对照组的35.4%,而各对照组间差异无统计学意义(P>0.05),见图2。
2.3 OPN ASODN对微缺氧下HT-29细胞增殖的影响MTT结果显示,微缺氧下不同时限点的吸光度值(A 570)及生长抑制率(IR)在各对照组间差异无统计学意义(P>0.05);而ASODN组的A 570值及IR与各对照组比较,差异有统计学意义(P<0.01),IR为(41.6±1.2)%,各组的生长曲线见图3。
2.4 OPN ASODN对微缺氧后HT-29细胞黏附力的影响与微缺氧空白组、脂质体对照组、SODN组、MODN组比较,ASODN组HT-29细胞在各时限点的黏附率均明显下降(P<0.01),而各对照组间的差异无统计学意义(P>0.05),各组细胞在不同时限点的黏附曲线见图4。

图1 RT-PCR检测OPN ASODN对微缺氧下HT-29细胞OPN m RNA表达的影响

图2 Western blot检测OPN ASODN对微缺氧下HT-29细胞OPN蛋白表达的影响
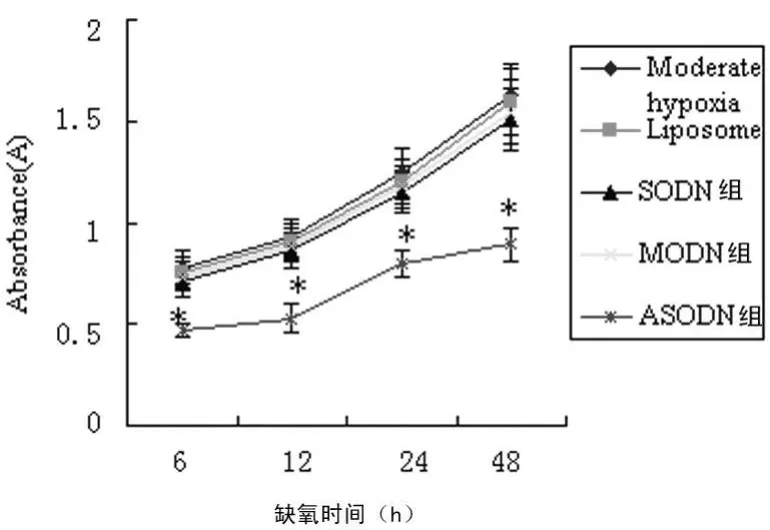
图3 微缺氧下ASODN组与各对照组HT-29细胞的生长曲线
2.5 MMP-2/9活性 明胶酶谱分析呈现相对分子质量为66/72 k D的MM P-2及其前体、92 k D的MMP-9溶解明胶后的负染条带,尤以前者为著。与各对照组比较,ASODN组HT-29细胞分泌的MMP-2/9活性下调71%(P<0.01),而各对照组间差异无统计学意义(P>0.05),见图 5。

图4 微缺氧后ASODN组与对照组HT-29细胞的黏附曲线
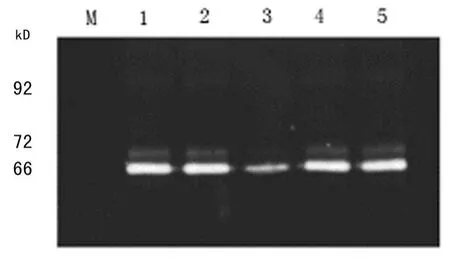
图5 微缺氧下ASODN组与各对照组的明胶酶谱
3 讨 论
肿瘤组织的氧分压为0~20 mm Hg,而正常组织则为 40 mm Hg以上,缺氧乃实体肿瘤物理微环境的基本特征[5]。适度缺氧可能是肿瘤细胞发生遗传不稳定、恶性转化甚至转移的始动因素,缺氧介导肿瘤细胞恶性筛选,对凋亡不敏感的、在缺氧环境下生存下来的细胞更富有侵袭性和对放、化疗的抗拒性[6]。作者在前期的研究中将培养液PO220 mm Hg作为微缺氧环境,检测到H T-29细胞在微缺氧下OPN特异性的表达上调,且HT-29细胞异质性黏附能力、侵袭游走能力显著增强,MM P-2/9活性上调而向恶性表型转化[7]。
在设计ASODN的软件中,Mfold软件可以识别基因序列中呈环状或发夹状的区域,选择单直链的区域作为靶点,由其设计的ASODN更容易与目的基因结合,基因的抑制效率更高。Adw an等[3]使用该软件,设计合成了10条靶向OPN的ASODN,并筛选出最有效率的 1条,该条 ASODN可以使OPN蛋白表达下调84%。作者参照Adwan设计的此条序列,合成ASODN,并参照其浓度用Lipofectamine将其转染入微缺氧下高表达OPN的HT-29细胞,用RT-PCR和Western Blot分析,结果显示 ASODN组OPN m RNA、蛋白表达较各对照组分别下调68.5%和64.6%。表明靶向OPN的ASODN能特异、有效地抑制微缺氧下H T-29细胞OPN m RNA和蛋白的表达。OPN在多种肿瘤组织中高表达,它可增强肿瘤细胞与基质的异质性黏附,促进其移行,并通过与整合素受体、CD44受体结合而参与信号转导,使肿瘤细胞无限制增殖,被认为是恶性转化的分泌性蛋白[8]。
Liu等[9]报道骨肉瘤(OS)中过度表达的OPN可上调细胞周期调节蛋白A(Cyclin A)的表达,进而加速细胞分裂周期,促进OS细胞的增殖。Muramatsu等[10]将OPN的反义寡核苷酸(AS)转染至高表达OPN的口腔肿瘤细胞株BSF-OF,AS组的肿瘤细胞生长速度较对照组明显减慢,肿瘤细胞的侵袭能力也显著降低。本实验表明,ASODN组HT-29细胞转染OPN ASODN后,随着OPN的下调,其A 570值明显低于各对照组,微缺氧下的高增殖活性受到明显抑制,IR达(41.6±1.2)%。表明靶向OPN的ASODN对微缺氧下HT-29细胞的增殖有明显的抑制作用,同时也提示微缺氧诱导的HT-29细胞高增殖活性与OPN的上调密切相关。
肿瘤细胞的远处转移是一个主动的过程,在进入和离开转移通道时都需要肿瘤细胞具备选择性黏附和主动移行的能力。当OPN的RGD序列与整合素受体αvβ3或CD44突变体识别结合后,可增强肿瘤细胞的黏附和迁移能力[11]。Moye等[12]将乳腺良性细胞株Rma通过转染使其表达OPN,发现细胞的黏附力和迁移能力显著增加,而且该细胞株可在大鼠体内形成转移灶。丁凌和郑树[13]分别构建OPN反义和正义真核表达质粒,将其转染入大肠癌细胞株Colo205和SW480。在高表达OPN的大肠癌细胞CD44的表达也上调,E-cadherin的表达则减弱。由此表明,细胞间同质黏附减弱,与ECV304细胞之间的异质黏附增强。本实验用反义寡核苷酸技术,特异性地封闭微缺氧诱导的OPN,结果显示,随着OPN的下调,微缺氧诱导的高异质性黏附力也明显降低。表明OPN参与了肿瘤细胞与基质膜基质之间的异质性黏附,靶向OPN的ASODN能显著下调OPN的表达,从而减弱微缺氧诱导的HT-29细胞的异质性黏附力。
MMP-2/9活性的高低是评估肿瘤侵袭性的重要指标[14]。ASODN组HT-29细胞转染OPN ASODN后,随着OPN的下调,其分泌的M MP-2/9活性下调了71%,表明靶向OPN的ASODN能显著下调微缺氧下HT-29细胞分泌的MMP-2/9活性。实验结果还提示,在微缺氧下MMP-2/9是OPN的下游效应因子。但MM P-2/9没有OPN的调控点,并不直接受OPN的调控,两者之间可能还存在某种因子介导。
作者参照Adw an合成靶向OPN的ASODN,用阳性脂质体为载体,将其转染至高表达OPN的微缺氧HT-29细胞,发现靶向OPN的ASODN可明显抑制微缺氧诱导的OPN m RNA和蛋白表达,并显著拮抗微缺氧诱导的细胞增殖、异质性黏附,阻抑OPN的表达,MMP-2/9的活性也随之下调,表明OPN在微缺氧促进肿瘤向恶性表型转化中起着重要作用。
[1]Koumenis C ,Wouters BG.“ T ranslating” tumor hypoxia:unfolded protein response(UPR)-dependent and UPR-independent pathways[J].Mol Caner Res,2006 ,4(7):423.
[2]Fukuda R,Hirota K,Fan F,et al.Insulin-like grow th factor linduces hypoxia-inducible factor 1-mediated vascular endothelial grow th factor expression,which is dependent on MAP kinase and phosphatidylinositol 3-kinase signaling in colon cancer cells[J].J Biol Chem,2002,277:38205.
[3]Adwan H ,Bauerle TJ,Berger M R.Downregulation of osteopontin and bone sialoproteinⅡis related to reduced colony formation and metastasis formation of MDA-MB-231 human breast cancer cells[J].Cancer Gene Ther,2004,11:109.
[4]Paul F,Ziprin P ,Alkhamesi N ,et al.Hypoxia Augments Gelatinase Activity in a Variety of Adenocarcinomas in Vitro[J].J Surg Res,2005,124(2):180.
[5]Semensa GL.Targeting HIF-1 for cancer therapy[J].Nat Rev Cancer,2003 ,3(10):721.
[6]Le QT ,Denko NC,Giacca AJ.Hypoxic gene expression and metastasis[J].Cancer Metastasis Rev ,2004 ,23:293.
[7]杨庆强,张才全.微缺氧对人结肠癌细胞HT-29骨桥蛋白及核转录因子表达及其侵袭能力的影响[J].中华实验外科杂志,2007,24(11):1353.
[8]Rodrigues LR,Teixeira JA ,Schmitt FL ,et al.The role of osteopontin in tumor progression and metastasis in breast cancer[J].Cancer Epidemiol Biomarkers Prev,2007,16(6):1087.
[9]Liu SJ,Hu GF,Liu YJ,et al.Effectof human osteopontin on proliferation,transmigration and expression of MMP-2 and MMP-9 in osteosarcoma cells[J].Chin Med J(Engl),2004 ,117(2):235.
[10]Muramatsu T ,Shima K ,Oh ta K ,et al.Inhibition of osteopontin expression and function in oral cancer celllines by antisense oligonucleotide[J].Cancer Lett,2005,217(1):87.
[11]Nemoto H,Rittling SR,Yoshitake H ,et al.Osteopontin deficiency reduce experimental tumor cell metastasis to bone and soft tissues[J].J Bone Miner Res,2001 ,16(4):652.
[12]M oye VE,Barraeloush R,West C,et al.Osteopontin expression correlates with adhesive and metastatic potential in metastasis inducing DNA-transfected rat mammary cell lines[J].Br J Cancer,2004,90(9):1796.
[13]丁凌,郑树.骨桥蛋白在不同大肠癌细胞株中的转移相关功能研究[J].中国病理生理杂志,2007,23(3):460.
[14]秦千子,黄顺荣.结直肠癌MMP 7和MMP13的表达和意义[J].广西医学,2005,27(10):1539.

