奶牛乳房炎金黄色葡萄球菌FnbpB-D基因的表达及其抗血清活性
史冬艳,郝永清,张爱荣
(内蒙古农业大学动物科学与医学学院,内蒙古呼和浩特010018)
金黄色葡萄球菌(Staphylococcus aureus)是奶牛乳房炎的主要病原[1],近50%的奶牛乳房炎是由该菌引起[2]。奶牛乳房炎不仅造成产奶量和牛奶品质的下降,更导致了乳品工业的经济损失[3]。由于对奶牛进行抗生素治疗可导致对抗生素产生抗药性的菌株进入食物链[4],使得奶牛乳房炎逐渐引起公共卫生的关注。
S.aureus黏附到乳头管被认为是乳腺感染的第一步[5],因此,黏附到乳腺上皮细胞和细胞外基质上的能力对于S.aureus的致病性至关重要。S.aureus黏附的过程中有多种黏附因子参与[6-7],其中纤连素结合蛋白B(Fibronectin-binding protein B,FnbpB)是重要的黏附素之一,它能够介导S.aureus结合于细胞表面的纤维连结素与纤维蛋白原,使细菌黏附于寄主细胞表面,促进细菌对寄主组织的侵入。Lammers等研究表明,缺乏FnbpB表达的S.aureu菌株不能凝集上皮细胞,并且黏附和侵入牛乳腺细胞的能力显著降低[8]。因此,以FnbpB为靶标进行疫苗研制可能是预防奶牛S.aureus乳房炎的有效途径。FnbpB基因中D区为主要活性部位。本实验通过对内蒙古地区分离到的16株S.aureus菌株的FnbpB-D区基因进行克隆表达,并对表达产物特异性抗体的抗黏附、吞噬调理等特性进行初步研究,进而为S.aureus黏附素疫苗的研究提供参考。
1 材料和方法
1.1 菌株和载体 16株S.aureus分离自内蒙古地区乳房炎病牛,表达载体pET-32a(+)及E.coliDH5均由本实验室保存。
1.2 工具酶及相关试剂EcoRⅠ和HindⅢ、DNA Marker DL2000、蛋白质低分子量 Marker均购自宝生物工程(大连)有限公司,ELISA所用TMB底物显色液购自北京天根生物有限公司。
1.3 重组质粒pET-FnbpB-D的构建 根据Gen-Bank登录的基因序列(X62992),用Primer 5.0设计上、下游引物。在上、下游引物中分别加入EcoRⅠ和HindⅢ酶切位点。其序列为:5'-CGGAATTCGCCCATAATAACGGTAACCAGT-3'和5'-CGCAAGCTT GCACGATTGGAGGTGATGTATC-3'。引物由宝生物工程(大连)有限公司合成。提取16株S.aureus的DNA,利用引物进行PCR扩增。PCR扩增条件为:94℃ 2 min;94℃ 30 s、64℃ 45 s、72℃ 1 min,30个循环;72℃10 min,PCR扩增产物经琼脂糖凝胶电泳检测。选取4株菌的扩增产物进行TA克隆,挑取阳性克隆进行序列测定。测序正确的菌株提取质粒,用EcoRⅠ和HindⅢ双酶切,与用同样的限制性内切酶进行双酶切pET-32a(+)按照常规方法进行连接、转化,构建的pET-FnbpB-D重组表达质粒经PCR及双酶切鉴定,由上海生工进行测序。
1.4 pET-FnbpB-D的诱导表达和可溶性分析 构建的重组质粒(含两个组氨酸标签)和空载体分别转化感受态细胞BL21(DE3)中,用终浓度为1.0 mM的IPTG进行诱导,取不同时间段的表达产物进行SDS-PAGE检测。
1.5 蛋白的大量表达及纯化 经鉴定,目的蛋白以可溶性形式存在。扩大培养后,根据预实验确定的最佳诱导时间和IPTG的浓度,进行大量表达和纯化。
1.6 目的蛋白的鉴定 首免,目的蛋白与氟氏完全佐剂充分乳化后,实验兔背部多点注射免疫(600 μg/只);2周后,目的蛋白与弗氏不完全佐剂充分乳化后二免。1周后,经ELISA测定抗体效价,当效价达到1∶3 200后,免疫兔颈动脉采血制备血清。并按常规方法进行试管凝集试验。
1.7 抗体活性的检测
1.7.1 抗体抗黏附能力的检测 5 μg/mL牛纤维蛋白原包被酶标板4℃过夜,5%脱脂奶粉37℃封闭3 h,同时,将对数生长期的S.aureus与制备的免疫血清37℃共孵育60 min。将孵育的S.aureus加入封闭好的酶标板中,以未经血清孵育的S.aureus做对照,37℃作用2 h,PBST洗涤3次。25%甲醛固定30 min,洗涤同上。用结晶紫染色30 min,洗涤同上。最后用95%乙醇脱色两次,每次5 min,尽量使结晶紫全部脱出。测定405 nm处OD值。
1.7.2 吞噬调理试验 将对数生长期的S.aureus做梯度稀释,取每个稀释度的菌液20 μL分别与免疫兔全血和未免疫兔全血各200 μL于37℃振荡孵育3 h。将所有液体加入至普通琼脂平板上推匀,37℃培养18 h~24 h菌落计数。
1.8 数据分析 ELISA数据采用方差分析和t检验,在SAS统计软件下进行分析,标准差和均值在微软Excel中计算,当p<0.05时认为在统计学上有意义。
2 结 果
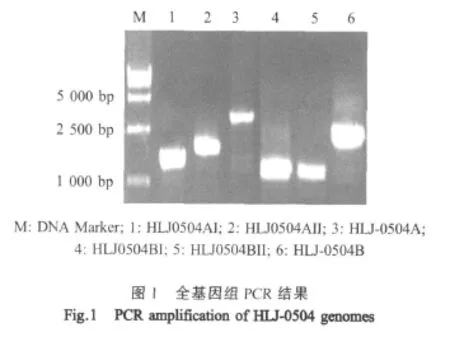
2.1 PCR扩增及重组质粒pET-FnbpB-D双酶切鉴定结果 PCR扩增产物经1%琼脂糖凝胶电泳鉴定显示,16株S.aureus全部含有目的基因,均扩增出约400 bp的DNA片段与预期的402 bp一致,表明成功扩增出目的片段(图1)。重组质粒经双酶切后,得到与理论值相符的条带,表明获得了携带目的基因的阳性重组质粒。
2.2 测序结果 测序结果经Blast比对发现,3株S.aureusFnbpB-D序列与GenBank中登录的核苷酸同源性为96%,其中一株的同源性达97%。
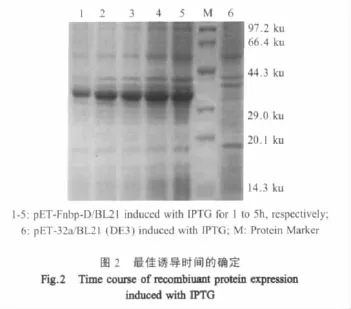
2.3 诱导表达结果 SDS-PAGE检测结果发现,经诱导的重组菌比诱导的空载体多了一条带,与预测的约34.7 ku(氨基酸平均分子量按照110 ku计算)的目的产物大小一致,而且加入IPTG 4 h后的表达量达到最大,电泳结果见图2。
2.4 试管凝集试验结果 对免疫前后实验兔采血制备血清,进行试管凝集试验,结果见表1。S.aureus普遍存在于自然界,但动物感染S.aureus后产生的抗体平均水平低,这就成为S.aureus对人和动物造成反复感染的原因之一。表1结果显示:免疫前兔血清对S.aureus的凝集作用,主要由S.aureus的A蛋白引起;免疫后兔血清的凝集价明显上升,表明血清中抗S.aureus的抗体水平有所增加。
2.5 抗体抗黏附检测结果 用酶标仪测定OD405nm,结果表明,经抗血清孵育的S.aureus的平均OD405nm值为0.1679(标准差为0.0346),明显低于未经孵育组平均OD405nm值0.3543(标准差为0.0895),实验组与对照组差异极显著(p<0.01),表明抗血清有抑制S.au-reus黏附到纤维连结素的作用。实验结果进一步证明FnbpB-D基因具有帮助S.aureus黏附的作用。

表1 凝集试验结果Table 1 The result of tube agglutination test
2.6 吞噬调理试验结果 培养物在37℃培养18 h后进行菌落计数(表2),大于300的菌落数不计。由表中数据显示,实验组的菌落数要比对照组的少,追其原因,可能是实验兔的全血具有杀死S.aureus的作用。

表2 吞噬调理试验结果Table 2 opsonophagocytic test result
3 讨 论
FnbpB被认为是S.aureus重要的黏附因子之一,绝大多数的分离株都含有FnbpB。本实验所用16株S.aureus菌株分离自呼和浩特周边地区奶牛场患奶牛乳腺炎的奶牛,在对16株S.aureus菌株进行FnbpB-D区的PCR扩增后发现,16株菌全部含有目的基因。这比Peacock等所得出的77%的检出率高[9]。这可能与所选菌株的致病性、宿主环境、地域及样本数和引物的特异性等因素有关。
本实验克隆4株S.aureusFnbpB的D片段基因,测序结果显示,3株S.aureus与GenBank中的核苷酸同源性为96%,其中一株的同源性为97%。选取同源性较高的片段,成功构建了重组质粒pET-FnbpB-D,诱导表达的重组蛋白能与牛纤维蛋白原结合。用表达蛋白免疫实验动物后制备血清,经凝集试验、吞噬调理试验和抗粘附性检测表明,表达的重组蛋白免疫家兔后制备的血清具有吞噬调理作用和抗S.aureus黏附牛纤维蛋白原的作用,从而证实所表达的蛋白具有免疫原性。
以上结论表明,FnbpB在内蒙古地区分离到的S.aureus中含有率较高,因此FnbpB是制备S.aureus黏附素疫苗重要的靶位之一。Brouillette等的研究表明,与亲本野株相比,缺乏Fnbp B的突变株的粘附力和对上皮细胞的感染性都显著降低,突变株进入上皮细胞的内摄作用降低了60%[10]。然而,实验结果也表明,突变株仅仅延迟了对乳房上皮细胞的感染,并没有完全阻止其感染,究其原因,可能是该突变株并没有去除其它重要的黏附因子。因此,在了解本地区不同基因型S.aureus基本情况的基础上,有待继续研究其他与乳房炎相关的重要的黏附因子,从而为合理防治奶牛乳腺炎奠定基础。
[1]Elina R,Gabriel M,Jose G.Bovine and rabbit models for the study of aStaphylococcus aureusavirulent mutant strain,RC122[J].Can J Vet Res,2002,66(4):285-288.
[2]Talbot B G,Lacasse P.Progress in the development of mastitis Vaccines[J].Livest Prod Sci,2005,98(1/2):101-113.
[3]Kerro-Dego O,Prysliak T,Potter A A.DNA-protein immunization against the GapB and GapC proteins of a mastitis isolate ofStaphylococcus aureus[J].Vet Immunol Immunopathol,2006,113(1/2):125-138.
[4]Denis M,Wedlock D N,Lacy-Hulbert S J,et al.Vaccines against bovine mastitis in the New Zealand context:what is the best way forward[J].N Z Vet J,2009,57(3):132-40.
[5]Talbot B G,Lacasse P.Progress in the development of mastitis vaccines[J].Livest Prod Sci,2005,98(1/2):101-113.
[6]Taverna F,Negri A,Piccinini R,et al.Characterization of cell wall associated proteins of aStaphylococcus aureusisolated from bovine mastitis case by a proteomic approach[J].Vet Microbiol,2007,119(2-4):240-247.
[7]Hensen S M,Pavicic M J,Lohuis J A,et al.Use of bovine primary mammary epithelial cells for the comparison of adherence and invasion ability ofStaphylococcus aureusstrains[J].Dairy Sci,2000,83:418-429.
[8]Aart L,Piet J M N,Hilde E.The fibronectin binding proteins ofStaphylococcus aureusare required for adhesion to and invasion of bovine mammary gland cells[J].FEMS Microbiol Lett,1999,1(180):103-109.
[9]Peacock S J,Day N P,Thomas M G,et al.Clinical isolates ofStaphylococcus aureusexhibit diversity in fnb genes and adhesion to human fibronectin[J].J Infect,2000,41:23-31.
[10]Brouillette E,Grondin G,Shkreta L,et al.In vivoandin vitrodemonstration thatStaphylococcus aureusis an intracellular pathogen in the presence or absence of fibronectin-binding proteins[J].Vet Microbiol.2004,101(4):253-262.

