鸡传染性支气管炎病毒N蛋白单克隆抗体的制备及其B细胞表位的鉴定
宋 扬,韩宗玺,邵昱昊,孔宪刚,刘胜旺
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/禽传染病研究室,黑龙江哈尔滨150001)
鸡传染性支气管炎(Infectious bronchitis,IB)是由IB病毒(IBV)引起的一种鸡急性高度接触性传染病。IBV是冠状病毒科(Coronaviridae)、冠状病毒属(Coronavirus)第3群禽冠状病毒的代表株[1]。其基因组编码4种结构蛋白:纤突蛋白(S)、膜蛋白(M)、核衣壳蛋白(N)和小膜蛋白(E)。N蛋白为磷酸化蛋白,由409个氨基酸组成,占病毒蛋白总量的40%,分子量约51 ku[2]。N蛋白具有较高的保守性,据报道,N蛋白中间部分比两端更为保守,各病毒株之间在氨基酸的238位~293位之间高度一致[3]。N蛋白在病毒的复制和转录中起作用,主要作用是与病毒RNA结合形成核衣壳[4]。此外,N蛋白具有良好的免疫原性,可在体内产生高水平的抗体并介导细胞毒性T反应[5]。本研究旨在获得针对IBV N蛋白的特异性单克隆抗体(MAb),精确定位IBV N蛋白的抗原表位,在分子水平上揭示N蛋白的抗原结构。
1 材料和方法
1.1 病毒株和质粒 IBV致弱株CK/CH/LDL97Ⅰ由本实验室分离、致弱和保存。原核表达重组质粒pGEX-6p-1-N为本实验室构建并保存。
1.2 实验动物及细胞 BALB/c小鼠购于中国农业科学院哈尔滨兽医研究所实验动物中心;骨髓瘤细胞SP2/0由本实验室保存。
1.3 主要试剂 培养基DMEM购自Invitrogen公司;弗氏完全佐剂(FCA)、弗氏不完全佐剂(FICA)、聚乙二醇(PEG,MW 1450)、HAT、HT、辣根过氧化物酶(HRP)标记的羊抗鼠IgG、MAb亚类鉴定试剂盒均购自Sigma公司;胎牛血清购自Hyclone公司;噬菌体展示随机12肽库(Ph.D-12TMPhage Display Peptide Library Kit)购自NEB公司。
1.4 重组N蛋白的制备 重组蛋白的制备按文献[6]的方法进行。
1.5 动物免疫与细胞融合 取重组蛋白(0.15 mg/mL)与等体积弗氏完全佐剂乳化,皮下接种6周龄~8周龄BALB/c小鼠(0.3 mL/只),每隔2周后等量抗原与弗氏不完全佐剂乳化,进行第2次(病毒抗原)和第3次免疫;最后1次以纯重组蛋白加强免疫,第4 d检测抗体水平,第7 d取脾脏进行细胞融合。融合过程参照文献[6]方法进行。
1.6 杂交瘤细胞株筛选与克隆化 以纯化的IBV作为包被抗原,通过间接ELISA方法检测杂交瘤细胞生长孔上清液中的抗体,以抗体效价大于阴性对照OD490nm值2倍以上者判为阳性。将阳性孔细胞以有限稀释法连续3次细胞克隆纯化。
1.7 腹水制备及效价测定 选取8周龄~10周龄的雌性BALB/c小鼠,腹腔注射无菌石蜡油(0.5 mL/只),7 d~10 d后,腹腔注射杂交瘤细胞5×106个/只,待小鼠腹部膨大后抽取其腹水,并采用间接ELISA法测定其抗体效价。
1.8 MAb生物学活性的鉴定
1.8.1 MAb亚类的鉴定 按照Sigma公司亚类鉴定试剂盒进行鉴定。
1.8.2 MAb western blot分析 将纯化的重组N蛋白、GST蛋白、IBV、性尿囊液进行SDS-PAGE电泳,转印到硝酸纤维素膜,转印结束后,用含5%脱脂乳4℃封闭过夜,PBST(Tween-20,0.05%)洗涤3次,加入腹水MAb,室温感作2 h,PBST洗涤3次,然后加入HRP标记的羊抗鼠IgG(1∶10 000),室温感作2 h,用3,3'-二氨基联苯胺(DAB)底物溶液进行显色,蒸馏水终止反应。
1.8.3 MAb间接ELISA 以纯化的IBV和重组N蛋白分别包被ELISA检测板,以筛选的阳性杂交瘤细胞上清为一抗,重组N蛋白阳性血清、阴性血清作为标准阴阳性对照,HRP标记的山羊抗鼠lgG为二抗,OPD显色,在酶标仪上读取OD490nm值。同时,用IDEXX公司标准IBV抗体检测ELISA试剂盒鉴定MAb的特异性。
1.9 N蛋白MAb抗原表位的筛选 参照NEB噬菌体展示随机12肽库操作手册,进行3筛选。
1.10 表位多肽的精确定位 根据筛选结果,人工合成相应表位基因的两条互补寡核苷酸链,上游引入BamHⅠ粘性延伸末端,下游引入终密码子以及SalⅠ粘性延伸末端。序列为:S:5'-GGATCCTT TGGCCCTCGTACTAAATAGG-3'; R: 5'-GTCGAC CTATTTAGTACGAGGGCCAAAG-3'。将2条互补链退火形成带粘性末端的双链DNA,插入pGEX-6p-1中,转化BL21(DE3)感受态细胞,酶切鉴定重组质粒,命名为pGEX-Ep。对重组菌进行IPTG诱导表达,并将表达的重组蛋白(GST-Ep)进行SDS-PAGE电泳和western blot分析。
1.11 抗原表位的保守性分析 分别取IBV 7个血清型的一个代表毒株进行western blot分析并运用DNAStar分析该表位短肽的氨基酸序列与IBV其它毒株相应区域的同源性。所用毒株及其GenBank序列号如下:CK/CH/LDL/97Ⅰ(EF602445)、CK/CH/LHLJ/04V(DQ352153)、CK/CH/LSD/05Ⅰ(EU637854)、H120 (EU714028)、 tl/CH/LDT3/03 (AY702975)、CK/CH/LSC/99Ⅰ(DQ287916)、Australia-T(U52596)。
2 结 果
2.1 MAb制备
2.1.1 MAb杂交瘤细胞株的建立 细胞融合后,经间接ELISA筛选,获得了1株能稳定分泌抗鸡IBV N蛋白的MAb细胞株,命名为6D10。经检测,MAb 6D10腹水的间接ELISA效价为105。
2.1.2 MAb生物学活性的鉴定
2.1.2.1 MAb亚型鉴定:按照Sigma公司亚类鉴定试剂盒对MAb的亚型鉴定,结果:MAb 6D10的重链为IgG1、轻链为κ链。
2.1.2.2 MAb western blot分析:为了检测所获得的MAb是否特异地针对IBV的N蛋白,我们采用western blot方法检测杂交瘤细胞分泌上清与全病毒的反应性,结果表明,MAb 6D10能与IBV CK/CH/LDL97Ⅰ毒株发生反应,在约55 ku处出现一条特异性条带,与重组N蛋白反应在约72 ku处出现特异性条带而与阴性尿囊液和GST蛋白则没有反应(图1)。表明所获得的MAb能够特异性的识别IBV与重组N蛋白。

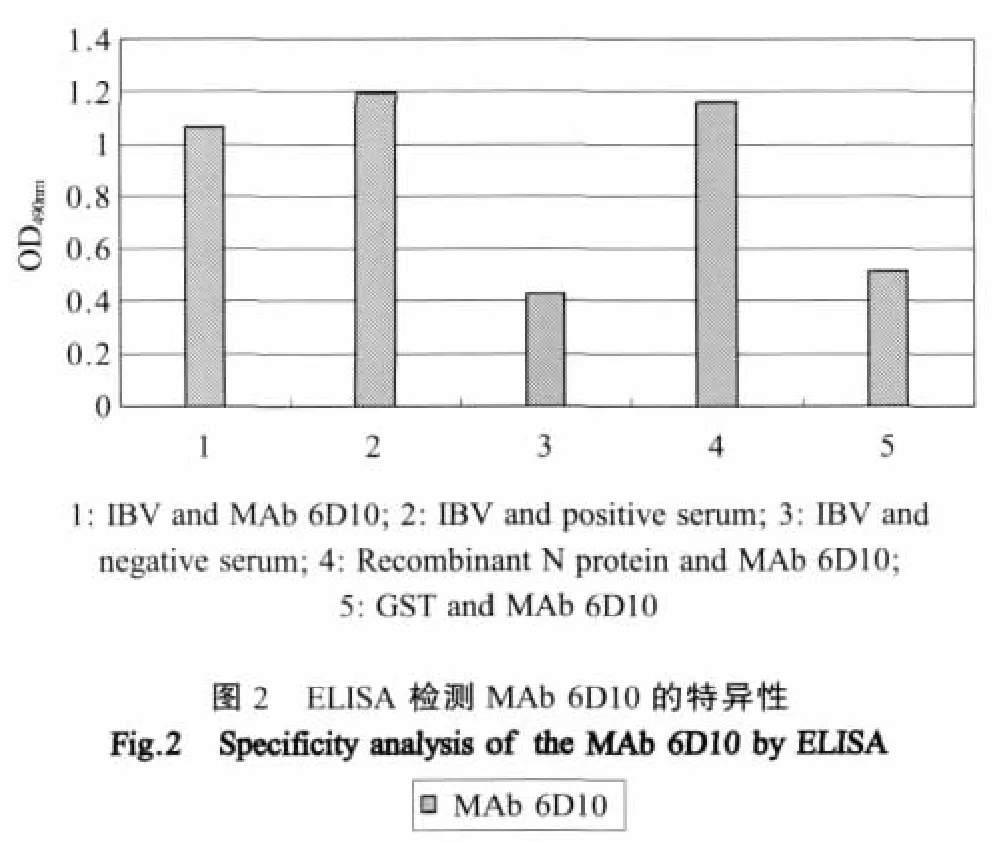
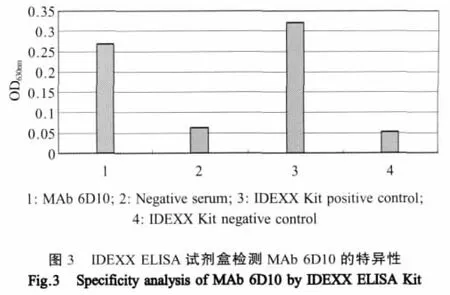
2.1.2.3 间接ELISA检测特异性:间接ELISA结果显示,MAb 6D10能与CK/CH/LDL97Ⅰ尿囊液毒和重组N蛋白发生特异性反应(图2),表明本实验得到的MAb 6D10是特异性针对IBV的N蛋白。为了更进一步确定MAb的特异性,我们用IDEXX标准IBV抗体检测ELISA试剂盒来鉴定该株MAb的特异性,结果显示MAb 6D10同试剂盒中的IBV标准抗原发生阳性反应(图3),结果又进一步证明本实验获得的MAb是特异性针对IBV的N蛋白。
2.2 表位鉴定结果
2.2.1 淘选产率 以每一轮淘选时加入噬菌体的量记作投入量,洗脱后噬菌体的量记作产出量,按照产率=产出量/投入量×100%计算出3轮淘选噬菌体的产率。经过3轮淘选,噬菌体的产率明显升高(表1),表明在淘选过程中与MAb 6D10特异性结合的噬菌体的比例有明显的升高,即发生了特异性噬菌体的富集。

表1 噬菌体展示肤库淘选结果Table 1 The results of 3 rounds of biopanning of display peptide library
2.2.2 噬菌体ELISA检测结果 扩增随机提取的14个噬菌体克隆,然后进行与MAb 6D10的ELISA反应,结果11个噬菌体克隆与MAb 6D10发生阳性反应,而与BSA对照孔不发生反应(图4)。

2.2.3 DNA序列测定及表位分析 将11个噬菌体阳性克隆进行DNA测序并对展示的短肽进行序列比对,结果10个噬菌体克隆展示一组共有序列FGPRTK,而剩下的1个噬菌体克隆没有发现共有序列。将噬菌体肽库展示的共有氨基酸序列与IBV N蛋白序列比较发现,该氨基酸序列与位于N蛋白242位~247位的氨基酸序列完全一致(图5),因此,我们推测FGPRTK可能是一个线性B细胞表位。

2.2.4 B细胞表位的定位将重组质粒 pGEX-6p-1-Ep转化到大肠杆菌BL21中,经IPTG诱导,使其表达GST融合蛋白GST-Ep,Western blot分析表明MAb 6D10可以与GST-Ep融合蛋白发生特异性反应,但却不与GST蛋白发生反应;FGPRTK为MAb 6D10识别序列,即242FGPRTK247为IBV CK/CH/LDL97ⅠN蛋白上的一个线性B细胞表位(图6)。
2.2.5 表位的保守性及同源性分析结果 为了检测MAb 6D10与不同IBV毒株的反应性,选取7个代表IBV不同血清型的毒株进行western blot分析。结果显示,MAb 6D10与所有所选的IBV毒株在54 ku处都有明显的条带(图7)。序列分析结果显示,表位序列(IBV CK/CH/LDL97ⅠN蛋白242 aa~247 aa)与所有所选的IBV分离株N蛋白相应区域(242 aa~247 aa)的序列完全相同(图8)。因此,本研究鉴定的N蛋白线性B细胞表位242FGPRTK247在所比较的经典疫苗毒株、变异毒株等IBV毒株中完全同源,是一个高度保守的线性B细胞抗原表位。

3 讨 论
IBV N蛋白一般由409个氨基酸组成,分析表明其分子量应在51 ku~54 ku之间[7]。早期认为IBV的N基因较为保守[4],而Sapats等认为N基因上存在着新的变异。通常认为IBV主要结构蛋白中S1糖蛋白在诱导鸡的免疫保护中起主要作用[8-9],但Boot等认为N蛋白也是免疫识别的重要靶位。研究编码N蛋白重组DNA的免疫原性发现:用表达的融合N蛋白首免小鼠和鸡,均能引起对IBV完整病毒粒子的免疫应答。用N蛋白免疫鸡后,能使鸡淋巴细胞增生和对IBV产生特异性迟发型超敏反应,这表明N蛋白不仅能激活T细胞,对完整的IBV粒子产生免疫应答,同时也能激活T辅助细胞,增强B淋巴细胞产生抗体的能力[10-12]。Ignjatovie等也发现N蛋白具有较多的抗原决定簇,而且N蛋白携带的所有抗原决定簇均能产生交叉反应性抗体[4]。因此,N蛋白有望作为群特异性诊断抗原或新型疫苗的有效成分。本实验将IBV毒株CK/CH/LDL97Ⅰ病毒与重组N蛋白混合作为免疫原,免疫小鼠,通过细胞融合,建立了1株能稳定分泌抗鸡IBV N蛋白MAb的杂交瘤细胞株6D10。Western blot分析显示,MAb 6D10与CK/CH/LDL97Ⅰ病毒株反应可见一条明显的条带,与报道的N蛋白大小相符;与重组N蛋白反应可见两条明显条带,这可能是N蛋白在原核表达中产物降解,或与蛋白的翻译后修饰或磷酸化有关[13],因为磷酸化形式蛋白在电泳时要比非磷酸化形式慢的多,因此形成两条带。ELISA检测中MAb 6D10与重组N蛋白及全病毒反应性良好,数值较高,表明本实验得到的MAb 6D10是特异性针对IBV的N蛋白,而IDEXX ELISA抗体检测试剂盒的实验结果进一步验证了我们的结论。随后我们以筛选到的MAb 6D10为靶分子,利用噬菌体展示技术对IBV N蛋白上的抗原表位进行了筛选,3轮淘洗后获得了一个共有序列FGPRTK,对应于IBV CK/CH/LDL97Ⅰ株N蛋白242位~247位氨基酸序列。人工合成这个多肽的编码序列并进行原核表达,利用MAb 6D10对表达产物进行western blot分析,结果显示FGPRTK为IBV N蛋白的一个线性B细胞表位。同源性分析结果显示,该表位在所比较的包括经典疫苗H120在内的7个血清型IBV毒株中同源性为100%,因此表位FGPRTK为IBV N蛋白的一个保守的线性B细胞表位。
本研究制备了一株抗鸡IBV N蛋白的MAb,并鉴定了N蛋白上高度保守的线性B细胞抗原表位:242FGPRTK247。该结果为进一步了解IBV的抗原结构和IBV诊断试剂及多表位疫苗的研究奠定了基础。
[1]卡尔尼克B W.禽病学[M].高福,等译.10版,北京:中国农业出版社,1997,653-673.
[2]Cavanagh D,Davis P J.Recent advances in avian virology[J].Br Vet J,1992,148:199-222.
[3]Ignjatovie J,Galli L.Structural proteins of avian infectious bronchitis virus:role in immunity and protection[J].Adv Exp Med Biol,1993,342:449-453.
[4]Ignjatovie J,Galli L.Immune responses to structural proteins of avian infectious bronchitis virus[J].Avian Pathol,1995,22:313-332.
[5]Ignjatovie J,Galli L.The S1 glycoprotein but not the N or M protein of avian infectous bronchitis virus induces protection in vaccinated chickens[J].Arch Virol,1994,138:117-134.
[6]于丹,韩宗玺,邵昱昊,等.抗鸡传染性支气管炎病毒N蛋白单克隆抗体制备与鉴定[J].中国预防兽医学报,2009,(31):654-656
[7]朱立平,陈学清.免疫学常用实验方法[M].北京:人民军医出版社,2000,23:741.
[8]Stern D F,Sefton B F.Coronavirus proteins:biogenesis of avian infectious bronchitis virus virion proteins[J].J Virol,1982,44:794-803.
[9]Sapats S I,Ashton F.Novel variation in the N protein of avian infectious bronchitis virus[J].Virol,1996,226:412-417.
[10]Cavanagh D,Davis P J,Barnes H J,et al.Coronavirus IBV:virus retaining spike glycopolypeptide S2 but not S1 is unable to induce virus neutralizing or hemagglutination inhibiting antibody or induce chicken tracheal protection[J].J Gen Virol,1986,67:1435-1442.
[11]Boots A M H,Van Lierop M J,Kusters J G,et al.MHC class II-restricted T-cell hybridomas recognizing the nucleocapsid protein of avian coronavirus IBV[J].Immunology,1991,72:10-14.
[12]Boots A M H,Kusters J G,Benaissa-Trouw B J,et al.Localization of avian coronavirus[J].Immunology,1991,74:8-13.
[13]杜恩岐,刘胜旺,孔宪刚,等.鸡传染性支气管炎病毒核蛋白基因在大肠杆菌中的表达及抗原性初步研究[J].病毒学报,2003,4(19):342-347.

