犬瘟热病毒F1蛋白的原核表达及其抗原性分析
江 勇,姜 骞,林 欢,刘家森,郭东春,韩凌霞,司昌德,曲连东*
(1.东北农业大学动物医学学院,黑龙江哈尔滨150030;2.中国农业科学院哈尔滨兽医研究所,黑龙江哈尔滨150001)
犬瘟热病毒(Canine distemper virus,CDV)属于副粘病毒科麻疹病毒属,该病毒宿主范围广泛,主要引起犬科、鼬科和浣熊科动物的急性、高度接触传染性疾病,以及感染野生猫科动物、环颈野猪类和西伯利亚海豹等,病死率高达100%。CDV已成为当前危害养犬业、毛皮动物养殖业和野生动物保护业主要病原之一[1-4]。因此,对犬瘟热进行早期确诊、流行病学监测及新型疫苗研制对该病的预防及控制具有重要意义。
F1蛋白相对保守,对病毒的膜融合起关键作用[5],其HRA区和HRB区相应的合成肽免疫动物具有抑制病毒感染的能力[6]。研究显示,台湾地区流行毒株的F1蛋白氨基酸序列的同源性高达99%[7],提示F1蛋白可作为CDV诊断的候选抗原。同时,F1蛋白还含有一些辅助性T细胞抗原表位,可引起特异性的细胞免疫应答[8]。因此,本研究表达了F1蛋白,为进一步建立检测CDV抗体间接ELISA方法及研制F1蛋白亚单位疫苗奠定基础。
1 材料和方法
1.1 病毒株、菌株及主要试剂 CDV HLJ2-07株由本实验室分离保存;兔抗CDV阳性血清、犬抗CDV标准阳性血清、阴性血清,犬细小病毒(CPV)、犬副流感病毒(CPIV)、犬传染性肝炎(CHV)、犬波特氏杆菌(CBb)阳性血清均为本实验室制备;E.coliTop10、BL21(DE3)感受态细胞及pET-30a(+)表达载体由本实验室保存;First-Strand cDNA Synthesis Using SuperScriptTMⅡ Reverse Transcriptase购自 Invitrogen公司;pMD18-T和限制性内切酶购自TaKaRa公司;荧光羊抗兔IgG购自Sigma公司;辣根过氧化物酶标记羊抗犬IgG购自KPL公司。
1.2 引物设计 根据GenBank登录的F1基因序列(EF445055),设计一对引物:Up:5'-TTGAATCCCA GATACATTGGAATAA-3';Low:5'-ATACTCGAGA CGCCTTTGTCTCCTACC-3'。
1.3 目的基因扩增 参照TRIzol LS Reagent说明书提取CDV的总RNA,参照Invitrogen公司试剂盒说明书进行逆转录反应。取逆转录产物(cDNA),经PCR扩增目的片段,反应程序:95℃5 min;94℃30 s、51.7℃ 30 s、72℃ 1.5 min,共30个循环;72℃10 min。对产物进行胶回收。
1.4 重组表达质粒pET-F1的构建 将F1基因PCR产物与pMD18-T连接,转化Top10感受态细胞,提取质粒,经酶切鉴定筛选阳性克隆、测序。测序正确的重组质粒及用EcoRⅠ和XhoⅠ双酶切,纯化后连接到经同样双酶切纯化的pET-30a(+)载体,构建重组表达质粒pET-F1。
1.5 重组蛋白的诱导表达、纯化及可溶性分析 将pET-F1转化大肠杆菌BL21(DE3)感受态细胞,37℃振荡培养至OD600nm值达0.6时,经IPTG诱导进行表达。表达产物进行SDS-PAGE分析。参照Promega公司MagneHisTMProtein Purification System说明书,进行重组蛋白的纯化。
1.6 重组蛋白的western blot鉴定 纯化后的重组蛋白进行SDS-PAGE电泳并转膜,以大肠杆菌吸附处理的兔抗CDV阳性血清为一抗,荧光羊抗兔IgG为二抗,用红外扫描成像系统获取图像。
1.7 特异性鉴定 以重组蛋白为抗原,采用方阵试验确定抗原包被浓度及血清工作浓度,辣根过氧化物酶标记羊抗犬IgG以1∶10 000稀释,TMB显色。(结果判定:阳性血清OD450nm值1.00以上,阴性血清OD450nm值0.20以下,P/N值最大)。采用该ELISA检测方法对CPV、CPIV、CHV、CBb阳性血清进行特异性检测,同时设阴性和阳性对照。
2 结果与讨论
2.1 目的基因扩增及重组表达质粒pET-F1的构建以CDV cDNA为模板,通过PCR扩增,获得扩增片段约为1 300 bp,与预期大小相符。测序结果表明其序列与参考毒株的F1基因序列完全一致。用EcoRⅠ和XhoⅠ双酶切pET-F1,分别得到约5 400 bp和1 300 bp的片段,酶切鉴定与预期相符。
2.2 重组蛋白SDS-PAGE分析 重组菌诱导后在约47.5 ku处出现蛋白条带,与预期重组蛋白分子量一致(图1)。对裂解诱导表达菌体,进一步分析结果显示:大部分重组蛋白存于裂解菌沉淀中,表明重组蛋白以包涵体形式存在。薄层扫描结果显示,重组蛋白占菌体总蛋白31.5%。
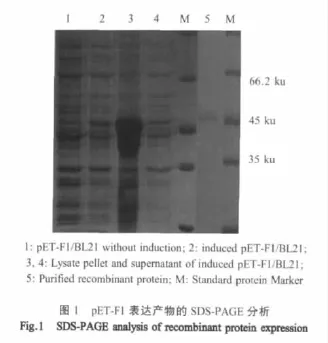
2.3 重组蛋白western blot鉴定 以CDV阳性血清进行western blot检测,结果显示,重组蛋白在约47.5 ku处出现特异性目的条带(图2),表明重组蛋白可以与CDV阳性血清发生反应,并具有良好的抗原性。

2.4 特异性鉴定 将纯化的F1重组蛋白作为包被抗原,经方阵试验确定抗原最佳包被量为4.2 ng/孔,血清最佳稀释度为1∶200。以建立的ELISA方法检测犬的4种病原的阳性血清,结果显示,其P/N值均小于2.0(表1),表明重组蛋白具有良好特异性。

表1 ELISA检测的特异性试验Table 1 The specificity assay of F1 protein by ELISA
本研究利用原核表达系统表达目的蛋白,已知pET-30a(+)载体的标签蛋白大小约为7.5 ku,F1基因编码蛋白大小约为40 ku,这与本研究所获取的重组蛋白大小约为47.5 ku一致,为纯化重组蛋白。本实验采用纯化试剂盒,最初以pH7.8的8 mol/L尿素裂解重组蛋白,但效果不理想,未得到目的蛋白。优化后改用pH8.5的蛋白裂解液,最终纯化到目的蛋白。分析原因可能为:经DNAStar软件推测的重组蛋白等电点为7.9,接近蛋白裂解液pH值而成中性,蛋白发生聚集沉淀。将裂解液pH值改为8.5后,重组蛋白带负电,远离等电点而溶解,而镍离子亲和树脂带正电,增加了蛋白与树脂之间的亲和力,利于蛋白纯化。
随着病毒的变异,近几年犬瘟热的发病率又有显著增长。基因工程疫苗以其安全高效等特点被广泛应用于疾病的预防。本研究中HLJ2-07株F1基因核苷酸序列、氨基酸序列与国内流行毒株进行比对,同源性均很高。制备的F1重组蛋白具有良好的抗原性,为F1蛋白亚单位疫苗的研制奠定了基础。
目前,国内已有应用重组N蛋白作为诊断抗原,建立检测CDV抗体间接ELISA方法的报道[9],闫芳等表达了F1蛋白片段并将其作为CDV的诊断抗原[10]。本研究制备的F1重组蛋白保留了跨膜区,结构更加完整,并初步建立了检测CDV抗体的间接ELISA方法,可为CDV感染过程中抗体监测提供有效手段,也为犬瘟热早期诊断、流行病学调查等研究奠定了基础。
[1]Martella V,Pratelli A,Cirone F,et al.Detection and genetic characterization of canine distemper virus(CDV)from free-ranging red foxes in Italy[J].Mol Cell Probes,2002,16(1):77-83.
[2]Van de Bildt M W,Kuiken T,Visee A M,et al.Distemper outbreak and its effect on African wild dog conservation[J].Emerg Infect Dis,2002,8:211-213.
[3]Martella V,Elia G,Buonavoqlia C.Canine distemper virus[J].Vet Clin North Am Small Anim Pract,2008,38(4):787-797.
[4]孙庆波.犬瘟热预防免疫研究[J].动物医学进展,2007,28(6):69-75.
[5]Philippe P,Pascal C,Dominique W,et al.Signal peptide and helical bundle domains of virulent canine distemper virus fusion protein restrict fusogenicity[J].Virol,2007,20(81):11413-11425.
[6]Colman M P,Lawrence C M.The structural biology of type I viral membrane fusion[J].Nature Rev Mol Cell Biol,2003,4:309-319.
[7]Lee M S,Tsai K J,Chen L H,et al.The identification of frequent variations in the fusion protein of canine distemper virus[J].Vet J,2008,10(1):184-190.
[8]Ghosh S,Walker J,Jackson D C.Identification of canine helper T-cell epitopes from the fusion protein of canine distemper virus[J].Immunology,2001,104(1):58-66.
[9]姜骞,周洁,刘家森,等.犬瘟热重组N蛋白抗原间接ELISA方法的建立及应用[J].中国预防兽医学报,2008,30(3):225-232.
[10]闫芳,夏咸柱,扈荣良,等.犬瘟热病毒F1基因的原核表达与初步应用[J].中国兽医学报,2005,25(4):351-352.

