牛荚膜血清A型巴氏杆菌病的分子流行病学调查
马文戈,姜志刚,于 力
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/大动物病研究室,黑龙江哈尔滨150001)
牛出血性败血症(Haemorrhagic septicaemia of cattle,HSC)是由多杀性巴氏杆菌(Pasteurella mutocida,Pm)引起的,主要以肺部病损为特征的牛传染病,一般为散发性,在剧烈应激和新血清型出现的情况下,多呈地方性流行。国外主要流行荚膜血清A、B或E型,我国以往主要是荚膜血清B型[1-2]。自2006年以来,我们陆续接到来自不同地区牛场发生纤维素性肺炎的疫情报告。根据疾病的严重程度、地方流行性特点以及临床病理学特征,推测该病是由我国未曾发生过的新血清型Pm引起的HSC。自2008年我们报道从患牛肺组织中分离到牛源荚膜血清A型多杀性巴氏杆菌以来,陆续从天津、吉林、内蒙古、宁夏和山东的发病牛均分离到同型病原菌。用送检病料接种小鼠,分离到具有巴氏杆菌表型特征的病原菌,继而用分离菌回归小鼠显示高度致病力,并且从鼠体内分离出表型及分子特征相同的细菌。据此,我们已经将上述疫情定性为由荚膜血清A型Pm引起的牛出血性败血症[3]。由于牛群没有免疫力,新出现的牛源荚膜血清A型Pm在我国一些省市呈地方性流行,并导致极高的发病率和死亡率,给养牛业造成重大的经济损失。
鉴于巴氏杆菌病对动物危害的严重性,准确可靠地鉴定Pm具有重要的临床意义。不同Pm菌株具有多型性以及在侵袭力等生物学特性方面的显著差异,采用分子生物学方法准确快速地鉴定Pm流行菌株的荚膜血清型就成为预防和控制HSC的关键步骤[4]。
1984年Carter提出血清学分型方法,将多杀性巴氏杆菌分为A、B、D、E和F 5个荚膜血清型[5]。然而,在不同的环境和培养条件下,Pm的代谢水平有显著差异,导致按该方法鉴定Pm的稳定性差、可靠性不高。Townsend等建立的Pm多重PCR分型方法,是以Pm种内特异性基因kmt1和荚膜生物合成基因hyaD-hyaC、bcbD、dcbF、ecbJ、fcbD为基础而建立的[6],经过不断补充和完善,可替代Pm血清学方法鉴定不同荚膜血清型Pm。但是,在具体的荚膜生物合成基因hyaD-hyaC的PCR扩增过程中,Townsend等提供的Pm多重PCR引物常出现扩增目标条带长度与设计长度不一致,甚至序列与目标序列一致性低于50%的情况,在疫情普查和病原分离中会造成假阴性结果,不能满足流行病学调查和病原分离鉴定的需要。因此,我们对荚膜生物合成基因hyaD-hyaC的PCR引物进行了重新设计,对Townsend等建立的Pm多重PCR分型方法进行了改进,目标是更有效地鉴别Pm分离株的荚膜血清型。近几年来,在Pm的分子进化分析中,国外学者主要用16S rRNA作为靶基因。16S rRNA位于原核细胞核糖体小亚基上,核苷酸长度约1 540 bp,结构和碱基排列复杂度适中,易于进行序列测定和分析比较。16S rRNA分子在结构上可分为保守区和可变区,保守区序列显示物种间的亲缘关系,而高变区序列显示物种间的差异和演化。在生物进化过程中,16S rRNA分子保持相对稳定的生物学功能和相对保守的碱基序列,同时也发生与进化过程同步的突变,因此用其作为靶序列进行分子进化分析和荚膜血清型鉴定,更加稳定可靠[7]。采用16S rRNA进行分子进化分析,还能及时追溯Pm病原的传播途径和来源,提供疫情控制和扩散的信息,从而实现对HSC流行态势的预警和预报。
在前期研究的基础上,我们又对9个省(市)区的疫情进行分析、病料采集、以及分子鉴定和进化分析,结果报告如下。
1 材料和方法
1.1 流行病学记录及病原材料 分别采集自黑龙江、吉林、宁夏、山东、内蒙古、天津和贵州发病牛的肺脏、肝脏、心脏、肾脏、呼吸道和肠道组织。
1.2 菌株、培养基及分子生物学试剂 各地区病料按照文献[3]的方法分离菌株用多重PCR扩增kmt1基因,荚膜合成基因hayD-hayC、bcbD、dcbF、ecbJ和fcbD和16S rRNA基因,PCR产物纯化后由上海生工生物工程技术服务有限公司测序。脑心浸汤(BHI)购自杭州天和微生物试剂有限公司。各种核酸内切酶、DNA Ladder 2000、Prime StarTaq酶、pMD18-T载体均购自宝生物工程(大连)有限公司。
1.3 PCR引物 参考Townsend等的Pm种特异性基因引物Kmt1,以及A、B、D、E、F荚膜血清型特异性基因引物capA、capB、capD、capE、capF[6],对一些基因的引物进行了改良。合成的引物序列为:capA1:5'-TGCCAAAATCGCAGTCAGTATTTT TTATCC-3'; capA2: 5'-TGCCATCATTGTCAGTGA TTTATTTTGTAAG-3';capB1:5'-GCGATATCAATC TGCTTAAGATAAT-3'; capB2: 5'-GAGGATTCTAT CTTGACTGAAGTA-3'; capD1: 5'-TTACAAAAGA AAGACTAGGAAC-3'; capD2:5'-CATCTACCCACT CAACCATATTCA-3'; capE1: 5'-TCCGCAGAAAAT TATTGACTC-3'; capE2: 5'-GCTTGCTGCTTGATTT TGTC-3'; capF1: 5'-AATCGGAGAACGCAGAAAT CAG-3'; capF2: 5'-TTCCGCCGTCAATTACTCTG-3';16S rRNA序列 16sU:5'-TCAGATTGAACGCT GGCGGCAGGCTTAAC-3';16sL:5'-CACCCCAGTC ATGAATCATACCGTGGTAA-3'。引物由上海生工生物技术服务有限公司合成。
1.4 PCR扩增及序列测定 将病原菌培养物250μL,12 000 r/min离心2 min,弃上清,用50 μL无菌双蒸水震荡悬浮,作为PCR模板。50 μL PCR反应体系组成:双蒸水36 μL,5倍Prime Star缓冲液10 μL,10 m mol dNTP 1.5 μL,10 μmol上下游引物各 1.0 μL,Prime StarTaqDNA 聚合酶 1.0 μL,模板 0.5 μL。PCR扩增反应条件:95℃5 s;94℃30 min,55℃45 min,72℃45 min共30个循环;72℃ 10 min延伸。PCR产物经1%琼脂糖凝胶电泳检测。PCR产物经琼脂糖凝胶回收后送上海生工生物工程技术服务有限公司测序,Blast搜索GenBank中的同源序列,并进行序列比对分析。
2 结 果
2.1 牛HSC的流行病学特征 2008年春天,黑龙江某奶牛场出生的犊牛出现以呼吸道症状为主的疾病,发病率超过50%,并且不断出现死亡病例。用各类抗生素治疗,但疗效甚微,并且停药后绝大部分病情出现反复。我们从该牛场病牛肺脏分离到荚膜血清A型Pm,并且确定该疫情为牛出血性败血症[3]。由于目前尚无疫苗可以使用。至2009年春天,该牛场初生犊牛中以呼吸道综合征为主的症状仍然存在,发病率甚至达到70%以上。
同期在其他地区也有相似的病例报告。华北某奶牛场自2005年从国外引进青年牛约2 200头,之后少数牛出现精神萎靡、呼吸困难症状。直至2007年内陆续出现死亡病例,2008年3月~7月,发病率达到21%,经抗生素治疗后症状略有好转,但容易反复。2008年陆续有其它省发生疫情,主要的流行病学特征与上述病例相似。有些从外地长途运输引进牛发病,发病率和死亡率差异较大。比较典型的例子是西南某省一奶牛场,该养殖户从华东某省大型牛羊调拨基地引进4月龄~6月龄种用肉牛36头。后陆续发病,发病率达到100%,死亡率在引进后两个月内达50%,预后均不良,之后以全部捕杀告终。
在所有病例中,荚膜血清A型Pm的输入和扩散是前提条件。发病率的高低和严重性与应激程度相关,例如长途运输的时间和气候炎热程度等。该病原一旦传入牛场,首先呈地方性流行,之后经过死亡淘汰和治疗,逐步过渡为散发,难以达到群体净化的目标。
2.2 Pm特异性基因和荚膜合成基因的序列测定及同源性分析 多重PCR扩增产物经琼脂糖凝胶电泳显示,黑龙江、山东、天津、吉林、宁夏和内蒙古送检的病料中,扩增出与阳性对照相同大小的两条特异片段(图1),分别约为 460 bp的 Pm特异性kmt1基因和约为1 000 bp的荚膜血清A型生物合成基因hyaD-hyaC,而阴性对照中未扩增出任何条带。结果表明,从上述6省送检病料中分离的细菌,均为荚膜血清A型Pm。
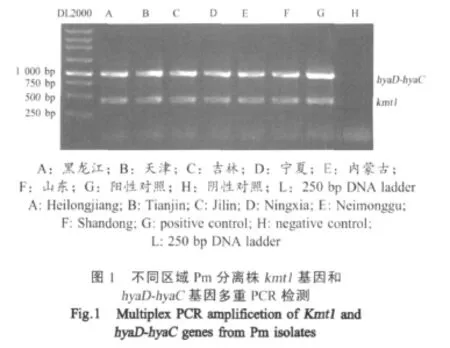
将460 bp PCR产物条带经胶回收纯化后,测序。从6个省市分离菌株的kmt1序列完全一致。Blast显示,A型分离株kmt1基因与GenBank中各血清型Pm的kmt1基因序列AF016259、AY225341、AY225342、 AY225343、 AY225344、 DQ233648、DQ233649、EU873317的一致性均在98%以上,进一步验证了这些分离株均为Pm。
同样,对荚膜血清A型生物合成基因hyaD-hyaC的PCR产物进行序列分析,从上述6省市的病料中扩增的荚膜血清A型相关基因(1 044 bp)的同源性均大于99.9%。Blast搜索显示,分离菌株的hyaD-hyaC基因与GenBank中登录的属于B、D、E、F血清型的AF169324 bcbD基因、AF302465 dcbF基因、AF302466 ecbJ基因、AF302467 fcbD基因同源性均在50%以下,而与A型菌株AF067175相应基因的同源性大于98%,进一步验证了这些分离株均为荚膜血清A型Pm。PCR扩增和序列分析均表明,我们从上述6省(市)分离的Pm为荚膜血清A型菌。
2.3 16S rRNA基因序列测定及系统进化分析 用PCR方法从上述6省市的病料中扩增1 468 bp的16S rRNA基因片段进行序列测定和分析。序列比对显示,所有分离株的16S rRNA基因同源性为100%。选择GenBank中不同动物来源各种血清型Pm的16S rRNA基因序列,与我们分离的荚膜血清A型Pm的16S rRNA基因一同建立系统进化树,结果见图2。16S rRNA基因系统进化分析显示,中国分离株(代表株为PM-TJ)与英国荚膜血清A型分离株Pm338同源性最高,达99.93%,而与其它牛源荚膜血清A型Pm的同源性稍有下降,但明显高于与其它动物来源荚膜血清A型Pm的同源性,即各种不同动物来源的荚膜血清B、D、E、F型Pm与A型Pm的同源性均明显低于A型Pm之间的同源性(表1)。16S rRNA基因系统进化分析结果表明,我国各地区牛源荚膜血清A型Pm分离株属于同一来源,而且与英国牛源分离株Pm338起源于共同的祖先。
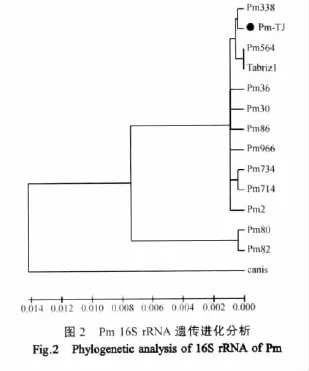

表1 与Pm-TJ菌株相关性较高的Pm菌株的16S rRNA基因检索记录Table 1 16S rRNA genes of Pm related highly to PM-TJ strain
3 讨 论
HSC是由Pm引起牛的主要传染病之一,呈散发或地方性流行,预防和控制方法主要依靠疫苗接种。从2006年开始,我国陆续有类似病例出现。我们对黑龙江某奶牛场的疫情进行综合分析发现,其主要临床症状和解剖变化类似于HSC,继而从病牛肺脏分离到荚膜血清A型巴氏杆菌。此后陆续从天津、宁夏、内蒙古、吉林、山东分离到相同血清型多杀性巴氏杆菌菌株。
对各地临床病例进行分析发现,所有的病原都是输入性的,发病的诱因主要是长途运输过程中的应激因素。发病动物以幼龄犊牛最为易感,死亡率也较高。牛一旦感染发病,长期维持临床症状,对抗菌素治疗不敏感,预后均不良。发病牛经呼吸道途径不断将病原传播给其它牛,间隔一段时间后再度流行,这与国外的报道一致[1,8-9]。在用多重PCR对Pm荚膜血清型进行分型过程中,使用hyaD-hyaC基因引物[6,10-11]进行PCR扩增,结果并不稳定,常扩增出非特异序列。因此,我们根据hyaD-hyaC基因重新设计PCR引物,经过筛选,确定一对特异性高和稳定性好的Pm的hyaD-hyaC基因引物,改进了Townsend等建立的Pm多重PCR分型方法。在此基础上,对来自7个省区的病料进行Pm鉴定和荚膜血清型分型,结果在6个省区检出相同的荚膜血清A型Pm,表明该疫情在我国已有较大范围的扩散。
在前期多重PCR分型的基础上,我们对不同区域分离株的16S rRNA基因进行系统进化分析,以追溯病原菌的来源。所测定的Pm菌株的16S rRNA基因长度为1 468 bp,在本研究中所有6个分离株的核苷酸序列完全一致,表明分离自我国不同地区的荚膜血清A型Pm有一个共同的来源。同时,通过16S rRNA进化分析显示,国内的分离菌株与英国分离株Pm338的相似性在所有已报道的动物Pm中是最高(99.93%),表明它们具有共同的进化来源。
奶牛和肉牛对该病均易感。牛群一旦引入该病,难以清除和净化。对可疑牛群首先进行病原分离和多重PCR鉴定,有条件的大型牛场可制备自家疫苗,对牛群进行荚膜血清A型巴氏杆菌灭活菌苗免疫防制。
[1]Carter G R,DeAlwis M C L.Haemorrhagic septicaemia[A]In Adlam C,Rutter J M(ed.),Pasteruellaand pasteurellosis[C].London,England,Academic Press Limited,1989.
[2]吴范庚,我国多杀性巴氏杆菌血清学鉴定及交互免疫试验[J].中国兽医杂志,1997,23(8):14-15.
[3]马文戈,于力.牛源荚膜血清A型多杀性巴氏杆菌的分离鉴定[J].中国预防兽医学报,2008,30(10):747-750.
[4]Townsend K M,Frost A J,Lee C W,et al.Development of PCR assays for species-and type-specific identification of Pasteurella multocidaisolates[J].J Clini Microbiol,1998,36(4):1096-1100.
[5]Carter G R,Chengappa M M.Recommendations for a standard system designating serotypes ofPasteurella multocida[J].Am Associ Vet Lab Diag,1981,24:37-42.
[6]Townsend K M,Boyce J D,Chung J Y,et al.Genetic organization ofPasteurella multocidacap loci and development of a multiplex capsular PCR typing system[J].J Clini Microbiol,2001,39(3):924-929.
[7]Davies R L.Genetic diversity amongPasteurella multocidastrains of avian,bovine,ovine and porcine origin from England and Wales by comparative sequence analysis of the 16S rRNA gene[J].Microbiology,2004,150:4199-4210.
[8]Ekundayo S O,Odugbo M O,et al.Phenotypic variability among strains ofPasteurella multovidaisolated from avian,bovine,caprine,leporine and ovine origin[J].Afi J Biotechnol,2008,7(9):1347-1350.
[9]Davies R L,MacCorgwodale R,Reilly S.Characterisation of bovine strains ofPasteurella multocidaand comparison with isolates of avian,ovine and porcine origin[J].Vet Microbiol,2004,99(2):145-158.
[10]Kamp E M,Bokken G C,Vermeulen T M,et al.A specific and sensitive PCR assay suitable for large-scale detection of toxigenicPasteurella multocidain nasal and tonsillar swabs specimens of pigs[J].J Vet Diag Investi,1996,8:304-309.
[11]Dziva F,Muhairwa A P,Bisgaard M,et al.Diagnostic and typing options for investigating diseases associated withPasteurella multocida[J].Vet Microbiol,2008,128:1-22.

