CD20单抗对 Burkitt淋巴瘤细胞 Bcl-2和 p38MAPK蛋白表达的影响
秦文娇,顾静文,许小平,陈 洁,陈波斌,林果为
淋巴瘤是血液系统常见的肿瘤之一。靶向治疗药物联合细胞毒药物是目前淋巴瘤治疗的热点。其中 CD20单抗 (Mebthera,Rituximab,利妥昔单抗,美罗华)已经在临床有较多应用[1],它通过多种作用方式诱导淋巴瘤细胞凋亡,如抗体依赖性细胞介导的细胞毒作用 (ADCC)和补体依赖的细胞溶解作用 (CDC)。有文献推测 CD20单抗也可能直接诱导 B淋巴细胞凋亡,但具体机制目前尚不清楚。Bcl-2基因 (B-cell lymphoma/Leukemia gene,B细胞淋巴瘤/白血病 -2基因)是凋亡因子的信号转导途径的调节点,其表达产物可抑制 B淋巴细胞凋亡的发生。80%低度恶性和 30%中度恶性淋巴瘤 Bcl-2基因有 t(14∶18)染色体移位,从而导致 Bcl-2蛋白的过表达。Bcl-2过表达的淋巴细胞是日后复发的根源,而且可导致对多种化疗药物的耐药。临床研究显示抗 Bcl-2药物可以增加 CD20单抗的疗效,两种药物有协同作用。CD20单抗的应用,是否也会影响 Bcl-2蛋白通路的表达,从而引起细胞凋亡的改变,目前尚未有详细的实验室研究的报道。CD20有多个磷酸化位点,包括细胞内主要的信号转导系统之一——丝裂素活化的蛋白激酶 (mitogen-activated protein kinases,MAPK)。p38 MAPK信号转导通路可在许多肿瘤细胞凋亡中发挥作用,其活性增加可保护 B淋巴细胞免于凋亡。但是这一通路是否受 CD20单抗的调节,目前亦尚无文献报道。因此,本研究通过观察不同浓度 CD20单抗对 B淋巴细增殖的影响及其作用机制。
1 材料与方法
1.1 材料 Raji和 Namalwa淋巴瘤细胞株均来自于中国科学院细胞库。培养于 RPMI 1640培养基至对数生长期。
1.2 细胞活力测定 将 Raji和 Namalwa细胞株加入终浓度为12.5μmol/L、25.0μmol/L和 50.0μmol/L的 CD20单抗中,以 PBS作为空白对照药物作用不同时间 (12、24、48、72 h);弃上清,加入 MTT 20 l培养 4 h;加二甲亚砜 100μl,于 490 nm波长处测定吸光度值,计算细胞增殖抑制率。细胞增殖抑制率 (%)=(1-CD20单抗组吸光度值/对照组吸光度值)×100%。
1.3 流式细胞仪检测凋亡指标 Annexin V+和 PI-细胞为早期凋亡细胞,Annexin V+和 PI+细胞为晚期凋亡细胞。将 50.0 μmol/L CD20单抗加入实验组,以空白 PBS为对照组。获取细胞悬液,离心,PBS清洗 3次;加入 AnnexinⅤ -FITC及碘化丙啶 (PI)混匀反应后用流式细胞仪检测,双标记法采集红色荧光和绿色荧光,CELLQUEST软件分析,以散点图 (dot plot)形式打印。
1.4 目的蛋白的免疫印迹鉴定 吸弃细胞培养上清,PBS洗涤后加入 200μl的 M-PERTM试剂,将细胞裂解液离心,吸取清亮上清液 (细胞蛋白质)50.0μg/ml进行 SDS-PAGE,电转移 1.5 h分离后电转移至 NC膜,密封置摇床 1 h,放入用封闭液稀释的鼠抗人 Bcl-2、p38单克隆抗体液 (终浓度20μg/ml)孵育 1 h,TTBS缓冲液洗膜,移入羊抗鼠 IgG-HRP二抗中孵育;洗膜后 DAB显色系统检测。以 β-actin作为内参,目的蛋白含量 =目的蛋白灰度值/同一样本 β-actin灰度值。
1.5 统计学方法 数据以 (x±s)表示,两组间数据比较用t检验,统计分析在 SPSS 10.0统计软件上完成,P<0.05为差异有统计学意义。
2 结果
2.1 CD20单抗对淋巴瘤细胞增殖的影响 不同终浓度的CD20单抗分别作用于 Raji细胞 12、24、48和 72 h后的细胞抑制率:12.5μmol/L时分别为 (5.80±0.29)%、(16.28±0.78)%、 (20.05±1.42)%和 (19.41±0.71)%;25.0 μmol/L时分别为 (19.06±0.75)%、 (30.39±0.26)%、(40.40±0.99)%和 (39.34±1.20)%;50.0μmol/L时分别为 (38.50±1.70)%、 (52.31±1.62)%、 (71.91±2.05)%和 (50.42±2.16)%。对同一终浓度、不同处理时间及相同处理时间、不同终浓度的细胞增殖抑制率进行每两组间统计分析,表明:不同终浓度的 CD20单抗作用 12、24和 48 h时细胞增殖抑制率间差别有统计学意义 (P<0.05,见图 1)。同样不同终浓度的 CD20单抗对 Namalwa细胞也有相似的抑制结果。
2.2 CD20单抗诱导淋巴瘤细胞株凋亡 Raji细胞株实验结果:实验组细胞凋亡率为 (31.52±2.48)%,对照组为(2.03±0.94)%,差异有统计学意义 (P<0.05,见图 2)。Namalwa细胞株实验结果:实验组细胞凋亡率为 (21.84±1.69)%,对照组为 (1.49±0.87)%,差异有统计学意义 (P<0.05,见图 3)。
2.3 目的蛋白的检测结果 使用50.0μmol/L的 CD20单抗处理 48 h后,2株细胞株中的 Bcl-2和 p38MAPK蛋白的表达量与对照组的表达量比较,差异均有统计学意义 (P<0.05,见表 1、图 4)。
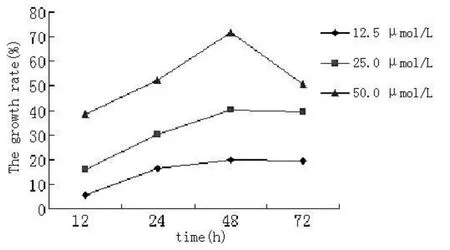
图 1 CD20单抗对细胞增殖抑制率的影响Figure 1 The growth rate after Rituximab treatment
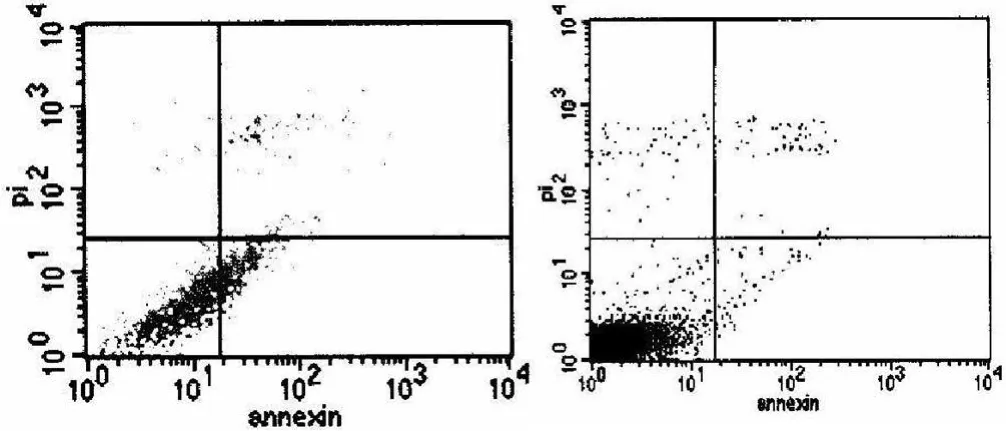
图 2 Raji细胞凋亡率Figur e 2 The apoptosis rate of Raji cell
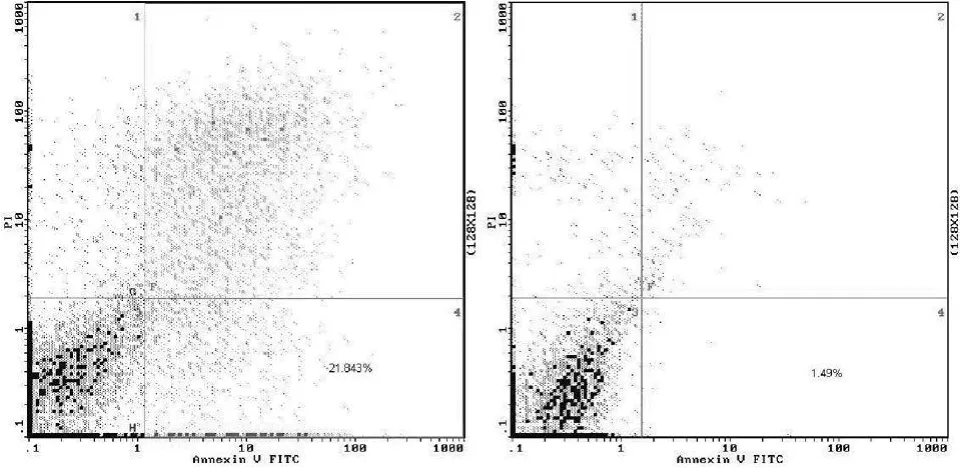
图 3 Namalwa细胞凋亡率Figure 3 The apoptosis rate of Namalwa cell
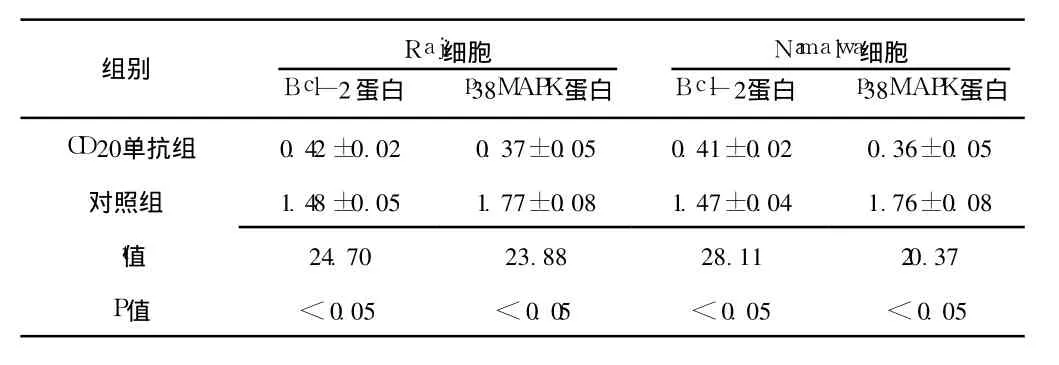
表 1 CD20单抗对 Bcl-2和 p38MAPK蛋白表达的影响 (x±s)Table 1 The effect of Rituximab on Bcl-2 and p 38MAPK protein expression of Raji and Namalwa lymphoma cell
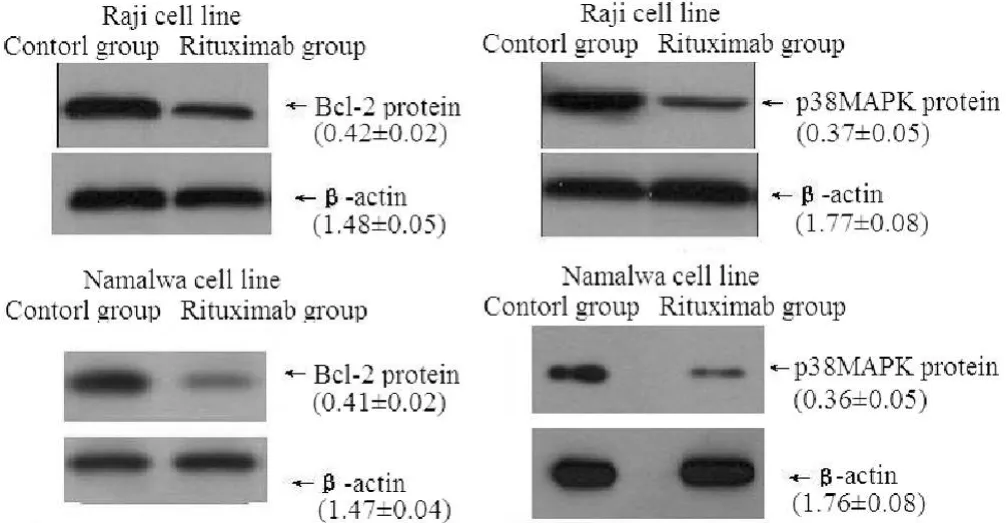
图 4 CD20单抗对 Bcl-2和p 38MAPK蛋白表达的影响Figur e 4 The effect of Rituximab on Bcl-2and p 38MAPK protein expression of Raji and Namalwa lymphoma cell by Western blot
3 讨论
淋巴瘤的靶向治疗因其特异性杀伤靶细胞、不损伤正常组织细胞的特点,临床应用日益广泛。CD20单抗是其代表药物,可通过 ADCC和 CDC诱导 B淋巴瘤细胞凋亡,其诱导 CD20阳性的 B淋巴瘤细胞直接凋亡的作用及机制越来越受到关注。
为了明确 CD20单抗抑制淋巴瘤细胞增殖的效果,选择最佳的药物作用浓度,本实验使用不同浓度 CD20单抗分别处理Raji细胞株 12、24、48和 72 h后测定细胞抑制率。结果显示与对照组相比,实验组 Raji细胞株的细胞抑制率明显增加,以 50.0μmol/L浓度处理 48 h后的效果最佳,可达到 (71.91±2.05)%。可见在一定范围内 CD20单抗对 Raji细胞的增殖有明显的抑制作用,且呈剂量 -效应和时间 -效应依赖关系。
流式细胞术检测 50μmol/LCD20单抗处理 48 h的 Raji和Nawalma细胞的凋亡率,实验组细胞比对照组明显增多,确切证实体外单独使用 CD20单抗,未通过抗体和补体介导的细胞毒作用,仍可以直接诱导细胞的凋亡,这是 CD20单抗杀伤淋巴瘤细胞的又一效应机制。
用 Western blot检测 Raji和 Namalwa细胞株 Bcl-2和p38MAPK蛋白的表达,结果表明:在 CD20单抗处理后的 Raji和 Namalwa细胞株中,Bcl-2和 p38MAPK蛋白的表达量与对照组相比均有明显下降。
Bcl-2基因是一种原癌基因,具有抑制凋亡的作用,可以调节各种信号转导途径的共同交叉点。Bcl-2过度表达可增强细胞对大多数 DNA损伤因子的抵抗性,抑制大多数化疗药物所引起的靶细胞凋亡[2]。p38MAPK在体内细胞信号转导中起协调作用,参与 B淋巴细胞凋亡的调控,有文献认为p38MAPK激活后对 B淋巴细胞有保护作用,可以拮抗细胞毒药物[3-4]。本研究前一步已证实 CD20单抗可以直接诱导CD20(+)的 B淋巴瘤细胞的凋亡,因此结合本实验结果推测其正是通过减少 Bcl-2及 p38MAPK蛋白的表达,阻止了这两个蛋白调控的抗凋亡通路的信号转导,诱导细胞的凋亡。结合临床资料[5],抑制 Bcl-2的表达的药物可以诱导细胞凋亡,增强 CD20单抗的作用,与其有协同作用,也说明 Bcl-2蛋白表达减少可能是 CD20单抗发挥作用的途径之一。
1 Mclaughlin P,Grillo-Lopez AJ,Link BK,et al.Rituximab chimeric anti-CD20 monoclonal antibody therapy for relapsed indolent lymphoma:half of patients respond to a four-dose treatment program[J].Clinical Oncology,1998,16(8):2825-2833.
2 Zhou J,Zhang S,Shen HM.Critical role of pro-apoptotic Bcl-2 family members in an drugrapholide-induced apoptosis in human cancer cells[J].Biochemical pharmacology,2006,72:132-144.
3 Vega MI,Huerta-Yepaz S,Garban H,et al.Rituximab inhibits p38 MAPK activity in B NHL and decreases IL-10 transcription:Pivotal role of p38 MAPK in drug resistance[J].Oncogene,2004,23(20):3530-3540.
4 Aaron L,Miller M,Webb S,et al.p38 mitogen-activated protein kinase(MAPK)is a key mediator in glucocorticoid-Induced apoptosis of lymphoid cells:correlation between p38 MAPK activation and sitespecific phosphorylation of the human glucocorticoid receptor at serine 211[J].Mol Endocrinol,2005,19(6):1569-1583.
5 Jeyanthi R,Francisco J,Hernandez-Ilizaliturr,et al.Pro-apoptotic therapy with the oligonucleotide genasense(oblimersen sodium)targeting Bcl-2 protein expression enhances the biological anti-tumour activity of rituximab[J].British Journal of Haematology,127:519-530.

