颈动脉粥样硬化与缺血性脑血管病的关系
谢明臣 ,谢壁云,罗春艳
(宁远县人民医院功能科,湖南 宁远425600)
为评价颈动脉彩超检查在缺血性脑血管病的临床运用价值,我们利用彩色多普勒超声检测280例缺血性脑血管病患者的颈动脉血管,探讨缺血性脑血管病与颈动脉粥样硬化之间的关系,现报告如下。
1 资料与方法
1.1 临床资料
1.1.1 缺血性脑血管病组:脑梗塞246例,椎-基底动脉供血不足34例,共计280例。其中男202例,女78例。年龄35~78.5岁,平均56.8岁。均系2008年12月至2010年2月在我院住院期间经 CT、MRI检查确诊的缺血性脑血管病患者。其中大面积(直径>3cm)脑梗塞56例,占本组病例的20%;小面积(直径>1 cm)脑梗塞 74 例,占 26.4%;小灶性(直径<1 cm)即腔隙性脑梗塞116例,占41.4%。单个梗塞灶72例,多发174例。梗塞部位分别位于左侧118例(43.9%),右侧 78例(31.7%),双侧弥漫性 60例(24.4%),左侧发病率大于右侧。位于皮质下白质与核团(包括放射冠、内、外囊、基底节、丘脑等)216例,占 87.8%;脑干 24例,占 9.8%;小脑 6例,占2.4%。既往史:身体健康48例,有高血压病史130例,有冠心病史94例,有糖尿病史26例,有短暂性脑缺血史52例,双上肢血压异常26例,合并两种以上的疾病56例。临床上大多有头疼,头晕,语言不清,行走不稳,或单侧肢体活动障碍或一过性晕厥(TIA)等症状。
1.1.2 对照组:为本院年龄相当的职工及家属,既往无任何疾患的志愿者200名。
1.2 方法
使用麦迪逊ACCUVIX V10彩色超声诊断仪,探头频率7.5MHz。检查前嘱患者休息5~10 min,取平卧位,头部后仰偏向检查对侧,充分暴露颈部。先从锁骨内侧端横向检查颈总动脉,然后沿胸锁乳头肌外缘纵切扫查,依次显示颈总动脉(CCA)近端、中段和远端,至分叉处分别扫查颈内动脉(ICA)和颈外动脉(ECA),椎动脉(VA)和锁骨下动脉(SA)。测量指标为[1-2]:1.CCA内径:于CCA分叉前2 cm处测量;距分叉膨大部以远1cm处分别测量ICA、ECA、VA、SA内径;颈动脉内膜-中层厚度:正常的颈动脉管壁呈典型的”双线征“,即两条平行的强回声带被一低回声或无回声带所分离,两线间的距离即为IMT。正常值<0.9mm;如>1.0 mm 为增厚;管腔内-中膜局部隆起增厚,向管腔内突出,IMT>1.2 mm,但未造成管腔狭窄,视为粥样硬化斑块形成,根据斑块回声强度和组织病理学研究分为[3]:①较均匀的低回声脂质型软斑块;②等回声的纤维型斑块;③)强回声或伴声影的钙化型硬斑块;④回声强弱不均的溃疡型混合斑块;观察彩色多普勒血流信号充盈管腔情况,用频谱多普勒测量各段动脉的峰值流速(PSV)和舒张末流速(EDV);估计管腔狭窄程度[1]:①血管轻度狭窄:管腔狭窄程度≥20%而<50%,无明显血流动力学改变;②管腔明显狭窄;50%≤管腔狭窄≤99%,有明显血流动力学变化;③血管完全闭塞;未见彩色血流通过。
判断异常标准[1]:如IMT>1.0 mm为增厚,管壁回声不规则与光点增粗,为颈总动脉硬化征像;颈动脉任何一处发现斑块(IMT>1.2 mm)均为斑块形成;CCA、ICA、ECA、VA、SA 中的任何一条管腔狭窄均视为管腔狭窄,无论是存在管壁硬化,还是斑块形成或是管腔狭窄中的一项或>1项均视为异常。
1.3 统计学处理
采用SPSS8.0软件包,对检查结果进行统计学分析。
2 结果
缺血性脑血管病组的CCA直径,EDV和PSV值与对照组比较,均有显著性差异(P<0.01,表1)。IMT增厚和斑块发生率也显著高于对照组,进一步统计分析表明缺血性脑血管病和颈动脉粥样硬化存在着线性关系(r=0.844,P<0.01,表 2)。本组病例共检出单纯性IMT增厚、光点粗糙64例(22.9%)。粥样硬化斑块形成120例(42.9%)。血管狭窄42例(15.0%),其中合并两条以上的血管狭窄16例(LCCA中段10例,球部16例,LICA起始段10例,RCCA中段 4例,RICA近端 2例,LSA近端 10例,RSA近端6例)。血管闭塞14例(5.0%),其中RICA6例,RVA6例,LVA 2例。超声检查颈部动脉血管异常240例,总异常率达85.7%。对照组中有IMT增厚和软斑形成34例,异常率为17.0%,二者比较有显著差异(P<0.01)。在临床诊断的34例椎-基底动脉供血不足中,有16例SA近端狭窄而形成锁骨下动脉盗血,6例椎动脉闭塞,12例未见明显异常。120例颈动脉粥样硬化斑块病变和血管狭窄及闭塞病变共累及双侧CCA、ICA和分叉处(BIF)及SA的起始处,其中发生于左侧的218处,右侧190处。各部位发生情况见表3。另有28例腔隙性脑梗塞颈动脉超声未见明显异常。
3 讨论
结果显示本组研究对象的颈总动脉直径较对照组者的颈总动脉直径增加(P<0.01),说明了颈动脉粥样硬化从IMT增厚,到斑块形成乃至管腔狭窄,血流速度增快等一系列变化,伴随着的是动脉粥样硬化血管的重构过程。动脉硬化早期血管内径的增加,表明了动脉呈正性重构,它不但代偿性扩张、甚至为过渡代偿,从而保证了病变远端必需的血液供应,使缺血情况少发生或延迟发生。然而随着动脉粥样硬化病程的进展,动脉扩张逐渐转变为负性重构即动脉缩窄。动脉扩张不是随年龄增加而产生的退行性改变,而是随动脉粥样硬化程度增加的一种血管重构现象一致[4]。张梅等[5]研究发现,斑块部位斑块面积与血管总面积呈正相关(P<0.05),管腔面积与狭窄程度呈负相关(P<0.05)。当狭窄程度<25%时,管腔面积与狭窄程度无相关性,当狭窄程度>25%时,管腔面积与狭窄程度呈负相关(P<0.05)。本组病例中仅有3例狭窄程度>50%的血管呈负性重构。
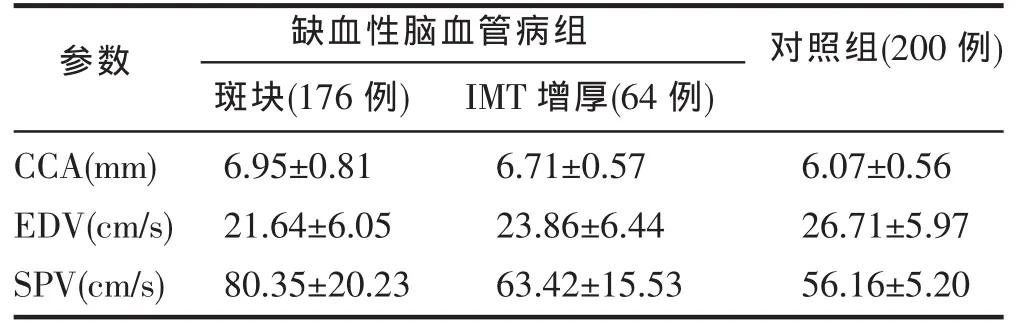
表1 缺血性脑血管病组与对照组颈动脉参数超声测值比较

表2 缺血性脑血管病的颈动脉超声所见与对照组比较

表3 颈动脉粥样硬化斑块在各部位发生率(%)
在动脉粥样硬化的发生发展过程中,病变主要累及大、中动脉内膜,首先是IMT的增厚,使内膜变为粗糙,逐渐形成斑块。当斑块突入管腔时,由于富含脂质或管壁应力的增大,斑块可发生破裂,暴露的脂质和胶原纤维可激活血小板,启动凝血反应形成血栓,是构成脑梗塞的重要危险因素。本文结果表明,颈动脉粥样斑块的好发部位以分叉处最多见,往往两侧同时受累,其次为CCA主干和ICA、SA的起始段,左侧发病的机率高于右侧,正好与本组脑梗塞病的的发病率左侧高于右侧相吻合。这可能与血流的剪切应力和血液动力学及解剖学位置有关。因此,颈动脉粥样硬化病变是引起脑梗塞的重要原因[4-6]。在我们的工作中发现粥样硬化斑块所致的明显管腔狭窄较少见,这种以晚期狭窄为主要病变的粥样斑块与脑梗塞的发生率以及梗塞的范围相关性较差,而粥样斑块的性质与脑梗塞密切相关。软斑及混合型溃疡斑块容易破裂、出血、形成血栓,随血液流动到达颅内,发生脑梗塞的机率较高。而硬斑块因表面钙化,不易破裂脱落,故脑梗塞发病率较低。
颈动脉粥样硬化是引起脑血管疾病的重要因素[7-8],因此对颈动脉粥样硬化的诊断日益受到临床的重视。在颈动脉成像的多种检查技术中,DSA、CT、MRI等均具有一定的局限性,如创伤性、禁忌症、并发症、费用昂贵等。而颈动脉彩色多普勒超声成像作为一种费用低廉、诊断价值显著的无创伤性成像方法,能获得高质量声像图,而且可以直接显示血管内膜、粥样斑块、管腔狭窄程度等,不仅可以对已发生的脑血管病变的患者提供诊断和治疗指标,而且能将无症状期动脉硬化患者检出预报。因此,颈动脉彩超诊断技术,对缺血性脑血管疾病的颈动脉粥样硬化检出预报和疗效的观察评价有重要意义。
[1]周永昌,郭万学,主编.超声医学[M].第 4版.北京:科学技术出版社,2002.792-810.
[2]邹艳秋,戈晓华,著.颈动脉超声多普勒实用手册[M].北京:学苑出版社,1996.6-7.
[3]赵玉霞,刘运芳,张梅,等.声学密度定量技术检测动脉粥样斑块的临床研究[J].中国超声医学杂志,2002,8(10):762-764.
[4]陈灏珠,主编.实用内科学[M].第 12版.北京:人民卫生出版社,2005.2022-2029.
[5]张梅,张运,高月花,等.超声检查对颈动脉粥样硬化血管重构的研究[J].中华超声影像学杂志,2002,11(4):229-231.[6]冯友贤,李建明.颅外阻塞性脑血管疾病[C],见:血管外科学[M].第2版.上海:上海科学技术出版社,1992.589.
[7]周琳,刘晓光,叶海碧,等.颈内动脉系统短暂性脑缺血发作与TCD及MRI的对比分析 [J].中国医师杂志,2003,8:1014-1016.
[8]王久武,徐艳.颈动脉彩超在缺血性脑血管病中的应用价值[M].医师进修杂志,2004,7:28-29.

