聚糖纳米粒阿霉素对移植瘤小鼠的体内抑瘤作用探讨
柳 虹
(湖南省肿瘤医院药剂科,湖南 长沙 410013)
为探索治疗肝癌新的有效方法,我们利用纳米颗粒的被动靶向特性以及受体介导的主动靶向性研制出聚糖纳米粒载导的阿霉素,其载药量44.79±4.27g/mg,粒径 110±12nm 的 O-羧甲基壳聚糖一聚乳酸阿霉素纳米粒,并将其应用于移植瘤小鼠,检验其对肿瘤细胞的抑制作用,进行体外治疗肝癌的实验研究。
1 材料与方法
1.1 材料
小鼠购于中南大学动物中心,雌雄各半,体重20±2g。由本院动物中心饲养、管理,各组动物分笼饲养,饮水和饲料来源相同。
1.2 方法
1.2.1 O-羧甲基壳聚糖一聚乳酸阿霉素纳米粒的制备
(1)O-羧甲基乳糖酰化壳聚糖(Gal-CMCS)的制备
O-羧甲基壳聚糖(CMCS)的制备,在参照文献的基础上改进[1]。将一定量壳聚糖加入50%NaOH浸泡,冷冻干燥后将碱性壳聚糖加入到100mL异丙醇中,40℃下搅拌,1h后,滴加含氯乙酸的异丙醇溶液50mL。O.5h滴加完毕,继续搅拌后升温至65℃,反应3h,倾去溶剂,加入60mL蒸馏水,搅拌至固体完全溶解,用1 mol/HCL调pH值至中性,透析(蒸馏水,MWCO,10000)24h,冷冻干燥得到 CMCS。CMCS 1.0g溶解在30mL蒸馏水90mL甲醇中,加入乳糖(13.0g),室温搅拌 4h 后,滴加 KBH4(1.5g/15mL)水溶液,反应3d,过滤,滤液用蒸馏水透析5d,滤去水不溶物,滤液冷冻干燥,得GaI-CMCS。
(2)O-羧甲基壳聚糖一聚乳酸阿霉素纳米粒的制备[2]
将1mL 5%的阿霉素溶液在超声条件下加到~定体积的l%降解聚乳酸二氯甲烷溶液中,超声5min使之成为均一稳定的初乳液。然后在超声条件下将100mL 0.4%O-羧甲基壳聚糖水溶液滴加到初乳液中超声10rain后形成复乳体系。将此复乳在电磁搅拌条件下挥发4h形成固体纳米微粒,采用高速离心得到白色沉淀,冷冻干燥后得到白色粉末。
1.2.2 动物实验
(1)肿瘤模型的建立[3]
取腹腔传代7天且生长良好的SIHO瘤源小鼠,于无菌条件抽取乳白色腹水,台盼蓝染色证旺活细胞数>98%,配成含瘤细胞为5×106个/mL的悬液,接种于小鼠右前肢腋部皮下,每鼠接种悬液0.2mL,即 1×106瘤细胞/只。
(2)分组和给药方法
120只小鼠随机分为生理盐水对照组、空白脂质体对照组、游离阿霉素组、0-羧甲基乳糖酰化壳聚糖-聚乳酸阿霉素纳米粒组 (载药量:44.79±4.27g/mg;粒径110±12nm)。以质量分数为2%的戊巴比妥钠按30mg/kg体重行腹腔注射麻醉。经舌静脉,按分组分别注射;注射剂量均为2.5mg/kg体重。以上每组30只动物,接种瘤细胞浆液24h后尾静脉给药。空白脂质体脂质含量与脂质含量相同。给药后动物正常饲养,每日观察皮下肿块生长情况。停药后5d,处死动物,称体重,完整剥取皮下肿块,称重。按下列公式计算药物肿瘤抑制率:
肿瘤抑制率(%)=[对照组平均瘤重(g)-治疗组平均瘤重(g)]/对照组平均瘤重(g)×100%[4]。
2 结果
实体瘤抑瘤实验治疗期间,各实验组动物无死亡,对照组动物皮下肿块平均重量>1g。0-羧甲基乳糖酰化壳聚糖-聚乳酸阿霉素纳米粒组动物平均瘤重较对应游离阿霉素组明显减轻,药物抑瘤率显著提高(P<0.05),但两组治疗组较生理盐水对照组、空白脂质体对照组抑瘤率有显著提高(P<0.05),而空白脂质体组与生理盐水对照组抑瘤率无显著差异 (P>0.05)。提示0-羧甲基乳糖酰化壳聚糖-聚乳酸阿霉素纳米粒组及游离阿霉素都有显著抑瘤作用,脂质体本身无抑瘤作用,结果见表1,图1。

表1 聚乳酸阿霉素纳米粒的体内抑瘤实验结果
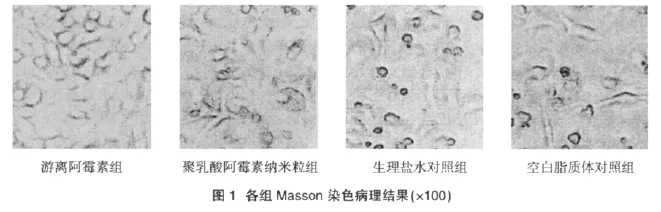
3 讨论
阿霉素是一种细胞周期非特异性药物,属葸环类抗肿瘤抗生素,并且可以延缓G0/G1期细胞进入S期[5]。自从70年代应用于临床以来,是治疗实体肿瘤最有效的药物之一,应用相当广泛。阿霉素的作用机理与该药可与DNA结合及抑制DNA合成有关。临床应用疗效与剂量有一定的依赖性,大量的实验结果显示:在一定的范围内随着药物剂量的增加,阿霉素诱导细胞凋亡的作用也随着增强,这是临床获得较好疗效的内在基础。但剂量过大,如:积累剂量>550mg/m2,心脏毒性、骨髓抑制等副作用也明显增加[6]。
纳米粒具有靶向性,能直接向靶器官、靶细胞或细胞内靶结构输送药物,同时具有缓释、保护药物、提高疗效、降低毒副作用等优点[7]。纳米载体靶向性一般分为被动靶向和主动靶向。被动靶向是纳米颗粒通过增加渗透和滞留效应 (enhanced penetration and retention effect,EPR效应),使纳米基因复合体更多地从肿瘤脉管系统逃离和在肿瘤内累积,即在瘤体内的累积过程[8]。主动靶向主要是通过受体介导、单克隆抗体介导、磁性纳米制剂定位增加纳米载体所携药物在靶组织的累积。磁性纳米药物制剂是将药物和适当的磁料(如Fe3)配制在药物载体系统中,够强的体外磁场作用下选择性地注入血液到达并定位于肿瘤靶区,药物在受控状况下从载体中释放而对正常组织无太大的影响:受体介导则利用肝细胞表面特有的ASGPR将药物中组合入半乳糖配体进行主动靶向转运药物[9]。聚乳酸纳米粒载药后被网状巨噬细胞摄取,药物在体内重新分布,主要积聚在肝、脾内,而心、肾、胃肠道药物含量较少,且药物直接进入溶酶体,然后再被缓慢释放到胞浆或体外,大大减轻了这些脏器的直接损害[10]。
我们采用阿霉素,利用纳米颗粒的被动靶向特性以及磁导向和受体介导的主动靶向性研制了聚乳酸阿霉素纳米粒。本实验证明了聚乳酸阿霉素纳米粒可明显抑制动物实体肿瘤的生长,延长荷瘤动物的生存期,比游离药物有更强的抗肿瘤活性。脂质体载药后可保护其所载药物在生理环境中免受免疫系统和酶系统的攻击,为药物达到靶细胞提供了适宜的环境,同时可延长药物在体内的滞留时间,以提高药物的疗效。脂质体还具有缓释作用,包封在脂质体中的药物进入肿瘤组织或在肿瘤组织周围缓慢释放,延长了药物的作用时间,增强了药物的抗肿瘤效果。聚乳酸阿霉素纳米粒载药延长荷瘤小鼠的生存期可能由于经腹腔注射后,载药脂质体在腹腔内与肿瘤细胞直接接触,由于缓释作用,延长了药物与肿瘤细胞的作用时间,提高了腹腔内淋巴组织的药物吸收率,抑制了荷瘤动物的腹腔淋巴转移;较大直径的聚乳酸阿霉素纳米粒不易透过腹膜进入血循环从而避免了药物对腹腔脏器的直接损害。因此,聚乳酸阿霉素纳米粒在降低药物毒性的同时,保留或提高了药物对动物实体瘤的抑瘤作用。
[1]常桂民,段芳龄,张向东,等.半乳糖脂修饰的阿霉素脂质体体外杀伤肝癌细胞的实验研究[J].癌症,2009,18(3):281-284.
[2]Fitzsimmons IL,Ryaby JT,Mohen S,et a1.Combined magnetic fields increase insulin-lide growth factor-2 in TE85 human osteosarcoma bone cellcultures[J].Endocrimology,2005,136:3100.
[3]张小云,张晓鄂.恒定磁场对Hela细胞生长分裂的影响[J].科学通报,1989,34:1901.
[4]陶凯雄,陈道达,田源,等.可霉素磁性蛋白微球联合外磁场对恶性肿瘤细胞的毒性试验 [J].生物医学工程学杂志,2007,18(2):169-172.
[5]陶凯雄,陈道达,方德炎,等.恒定磁场联合阿霉素磁性蛋白微球抑制恶性肿瘤细胞生长的研究[J].中华物理医学与康复杂志,2000,22(3):152-154.
[6]Harmana,LiangY,Allison JD,et al.Chemotherapyofhuman carcinoma xenogerafts during pulsed magnetic field exposure[J].Anticancer Res,2004,14(4A):1521.
[7]高进.癌的侵袭与转移[M].北京:北京医科大学中国协和医科大学联合出版社,2006.64-150.
[8]Karim AC.Effect of adriamycin on the RPC C2A cloned cell line from rat incisor pulp[J].Anat Rec,1995,242(1):11-20.
[9]Maeda H,Wu J,Sawa T,et al.Tumor vascular permeability and the EPR effect in macromolecular therapeutics:a review[J].J Control Release,2000,65(1-2):271-284.
[10]Tomietto M,Saiani L,Saarikoski M,et al.Assessing quality in clinical educational setting:Italian validation of the clinical learning environment and supervision (CLES)scale[J].G Ital Med Lav Ergon,2009,31(3 Suppl B):B49-55.

