胰岛素对人外周血内皮祖细胞凋亡的影响
李 琳 ,雷闽湘 ,徐寒松,刘泽灏
(1.长沙市一医院内分泌代谢科,湖南 长沙410008;2.中南大学湘雅医院内分泌代谢科,湖南长沙410078)
血管内皮祖细胞是成熟血管内皮细胞的前体细胞,属于干细胞群体,既可自我更新,又能定向分化为成熟的内皮细胞。已有研究表明2型糖尿病患者的内皮祖细胞数量减少、功能受损[1-2]。我们知道2型糖尿病患者由于胰岛素抵抗,许多都存在高胰岛素血症。而细胞凋亡是细胞数目减少的机制之一。本文分别用不同浓度的胰岛素对体外培养的健康人的外周血内皮祖细胞进行干预,以观察其对内皮祖细胞凋亡的影响,从而用于探讨糖尿病患者内皮祖细胞数量减少的机制。
1 对象与方法
1.1 研究对象
正常成年人(年龄25~30岁)外周血液9份,其中男性血液标本5份,女性血液标本4份。所有供血者均排除吸烟、近期外伤、手术史、皮肤溃疡等影响内皮祖细胞的因素。
1.2 试剂
M199培养基 (Hyclone公司),VEGF,bFGF,EGF,IGF-l(Pepro Tech EC 公司),Annexin V-FITC试剂盒(晶美生物工程有限公司),FITC-UEA-1(Sigma公司),人淋巴细胞分离液(天津灏洋公司),注射用速效猪胰岛素(江苏万邦生化医药股份有限公司)。
1.3 方法
1.3.1 EPCs的分离,诱导和分化
分离出健康成年人外周血单个核细胞,加入含胎牛血清、VEGF、bFGF、EGF、 IGF-1的 M199培养基。饱和湿度、5%CO237℃孵育箱中培养,每4d换液一次。贴壁细胞供实验用。
1.3.2 EPCs鉴定
上述细胞加入FITC-UEA-1和Dil-acLDL孵育洗涤后,激光共聚焦显微镜下观察,FITC-UEA-1(绿光)和 Dil-acLDL(红光)双阳性细胞为 EPCs。
1.3.3 不同浓度的胰岛素干预
内皮祖细胞培养第7天,更换培养基,成分同前,分别用不同终浓度的猪胰岛 (0mU/l,20mU/l,200mU/l,2000mU/l)干预。
1.3.4 凋亡测定
将经不同浓度胰岛素干预后的每组内皮祖细胞消化洗涤重悬后,先后加入Annexin-FITC和PI。混匀后于室温避光孵育15min。
每组经过上述步骤处理得到的细胞悬液分别在荧光显微镜下观察。发绿色荧光的为早期凋亡细胞,同时发绿色和红色荧光的细胞为坏死细胞。分别对每张玻片的3个不同的视野进行计数。经过上述步骤处理得到的每管细胞悬液分别用流式细胞仪进行分析。
1.4 统计分析
各组数据以mean±SD表示。不同浓度胰岛素干预组两两之间比较用t检验,P<0.05为差异有统计学意义。SPSS11.5统计软件进行统计分析。
2 结果
2.1 荧光显微镜下不同浓度胰岛素干预24h后的检测结果
荧光显微镜下计数,20mU/L胰岛素干预组较对照组的凋亡率无明显差异 (P>0.05),200mU/L及2000mU/L组较对照组凋亡率明显增高 (P<0.05),2000m/U/L与2000mU/L组比较,凋亡率明显增高(P<0.05),结果见见表 1。
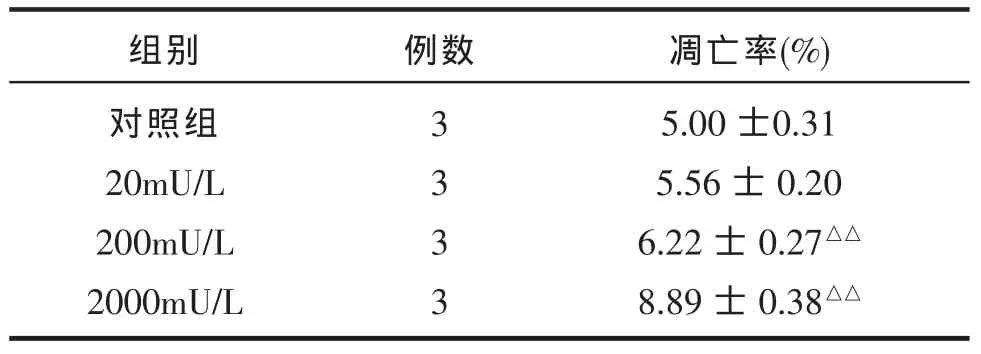
表1 荧光显微镜下不同浓度胰岛素干预24h后的检测结果
2.2 荧光显微镜下2000m U/L胰岛素组不同干预时间的检测结果
由表2可见,2000mU/L胰岛素干预组48h较24h的凋亡率有明显差异(P<0.05)。
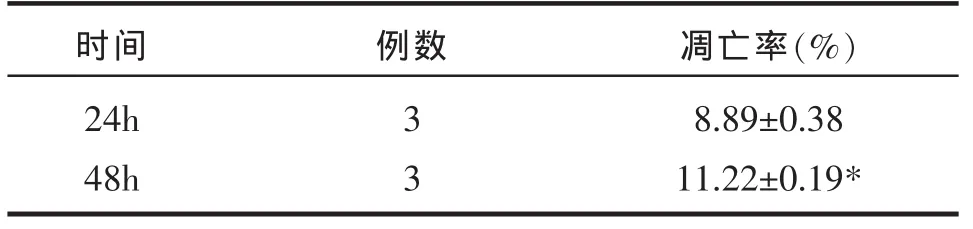
表2 荧光显微镜下2000mU/L胰岛素组不同干预时间的检测结果
2.3 流式细胞仪检测不同浓度胰岛素干预24h后的检测结果
流式细胞仪分析,20mU/L胰岛素干预组较对照组的凋亡率无明显差异 (P>0.05),200mU/L及2000mU/L组较对照组凋亡明显增高 (P<0.05);2000mU/L与2000mU/L组比较,凋亡率明显增高(P<0.05),结果见表 3。
2.4 流式细胞仪检测2000m U/L胰岛素组不同干预时间的结果
由表4可见,2000mU/L胰岛素干预组48h较24h的凋亡率有明显差异(P<0.05)。

表3 流式细胞仪检测不同浓度胰岛素干预24h后的检测结果

表4 流式细胞仪检测2000m U/L胰岛素不同干预时间的检测结果
3 讨论
正常人空腹胰岛素水平波动在5~25 mU/L,餐后胰岛素峰值是空腹的5~10倍,持续时间不长(2~3 h)。在2型糖尿病患者中由于胰岛素抵抗的存在,许多患者存在高胰岛素血症。因此我们的实验用20mU/L、200mU/L、2000mU/L胰岛素诱导内皮祖细胞的凋亡,结果发现在24 h内200mU/L、2000mU/L均可以增加内皮祖细胞的凋亡率,并且高浓度胰岛素(2000mU/L)对内皮祖细胞凋亡的这种影响呈时间依赖性,但是24 h内20mU/L胰岛素与对照组的凋亡率的差异在统计学上无显著性。这提示生理浓度胰岛素不会增加内皮祖细胞的凋亡,长时间(即超过正常餐后胰岛素高峰持续时间)的高胰岛素浓度将增加内皮祖细胞的凋亡。2型糖尿病患者由于长期在高血糖及高胰岛素血症状态下,内皮祖细胞的凋亡增加,分化增殖受到抑制,导致2型糖尿病患者的内皮祖细胞数量较正常人减少,这也正与我们过去的研究[3]相符。而且在达到2型糖尿病诊断标准前的正常葡萄糖耐量阶段和糖耐量减低阶段均可长期存在高空腹胰岛素血症[4]。从我们的体外胰岛素干预培养的结果推测2型糖尿病在正常葡萄糖耐量阶段和糖耐量减低阶段就可能已经存在了内皮祖细胞的数量减少,而有研究表明内皮祖细胞数量减少是糖尿病血管并发症的机制之一[5],因此在2型糖尿病的正常葡萄糖耐量阶段和糖耐量减低阶段可能就已经存在了内皮功能受损,这提示我们在2型糖尿病的正常葡萄糖耐量阶段和糖耐量减低阶段就应该进行增强胰岛素敏感性的治疗,以预防血管并发症的发生。
[1]Loomans CJ,de Koning EJ,Staal FJ,Rookmaaker MB,Verseyden C,de Boer HC,Verhaar MC,Braam B,Rabelink TJ,van Zonneveld AJ.Endothelial progenitor cell dysfunction:a novel concept in the pathogenesis of vascular complications of type 1 diabetes[J].Diabetes,2004,53(1):195-199.
[2]Tepper OM,Galiano RD,Capla JM,et al.Human endothelial progenitor cells from type II diabetics exhibit impaired proliferation,adhesion,and incorporation into vascular structures[J].Circulation,2002,106(22):2781-2786.
[3]王爱民,雷闽湘,刘泽灏.2型糖尿病外周血内皮祖细胞的诱导分化及影响因素的研究 [J].中国糖尿病杂志,2006,14(3):188-191.
[4]Groop LC.Insulin resistance:the fundamental trigger of type 2 diabetes[J].Obesity Metabolism,1999,suppl1:S1-7.
[5]Fadini GP,Miorin M,Facco M,Bonamic S,Baesso I,et al.Circulating endothelial progenitor cells are reduced in peripheral vascular complications of type 2 diabetes mellitus[J].J Am Coll Cardiol,2005,45(9):1458-1460.

