纤维结合蛋白基因在儿科A族β溶血性链球菌的分布及与大环内酯类抗生素耐药的关系
冯利娟, 杨永弘, 俞桑洁, 姚开虎, 袁 林, 沈叙庄
A族β溶血性链球菌(Group A streptococcus,GAS)是引起儿童感染性疾病的重要病原菌。最多见的是急性咽扁桃体炎、猩红热和脓疱疮等感染,严重感染有菌血症、关节炎、中毒性休克综合征、坏死性筋膜炎等。有资料表明,由 prtF基因编码的纤维结合蛋白F(fibronectin binding protein F)与菌株的emm分型、所导致疾病、对大环内酯类抗生素耐药及耐药基因相关[1],在我国尚缺少这方面的研究。我们之前的研究发现儿科高水平大环内酯类抗生素耐药的GAS感染株流行,分离株emm分型主要集中在emm12型和emm1型,本研究观察prtF基因在我国GAS菌株所致疾病、emm分型以及与对大环内酯类抗生素耐药的关系。
材料与方法
一 、材料
(一)菌株来源 收集北京儿童医院、重庆儿童医院、深圳儿童医院239株临床分离株,其中取自侵袭性感染菌株 8株(3.35%),猩红热 84株(35.15%),咽扁桃体炎79株(33.05%),皮肤软组织感染11株(4.60%),肺炎2株(0.84%),其他7株(2.93%),正常健康儿童48株(33.05%)。分离株的91.63%来自于咽拭子,5.02%来自感染黏膜或创面与皮肤软组织感染不对应,2.09%来自血液,0.91%来自胸水。标本接种于5%羊血培养基,挑选β溶血菌落进行杆菌肽检测,阳性株采用Lancefield族特异性抗血清分型确定为GAS。侵袭株是Working Group on Severe Streptococcal Infections定义的通常分离自无菌部位如血液、脑脊液、关节腔、心包或腹膜、骨、深组织等部位[2]。本研究中病原菌株是指与健康携带株所对应的致咽炎、猩红热、侵袭性感染等疾病的菌株。
(二)抗菌药物标准品 红霉素(14元环)、克拉霉素(14元环)、阿奇霉素(15元环)、交沙霉素(16元环)和克林霉素均购自中国药品生物制品检定所。
(三)Taq酶、dNTP 购自宝生物工程有限公司;PCR引物委托上海生工生物工程技术服务有限公司合成,引物序列见表1。
(四)质控菌株 肺炎链球菌ATCC49619用作琼脂稀释试验的质控菌株。
二、方法
(一)抗生素药物敏感性试验 5种抗生素(红霉素、克拉霉素、阿奇霉素、交沙霉素和克林霉素)对239株GAS的MIC值检测采用琼脂稀释法,按CLSI规程操作[3]。抗菌药敏感性判定依据2008年CLSI判定标准。细菌多点接种器蘸取0.5麦氏浊度的GAS悬浊液接种于5%羊血的MH培养基上(Mueller-Hinton琼脂+5%羊血的培养基)。质控株为肺炎链球菌ATCC49619。
(二)基因检测 用PCR方法检测编码纤维结合蛋白基因prfF1、prtF2及编码M蛋白的emm基因、大环内酯类抗生素耐药基因ermB、ermTR和mef A。
PCR条件:94℃预变性1 min后,94℃变性30 s,退火30 s,72℃延伸30 s,30个循环后72℃再延伸10 min。PCR扩增产物1%~1.5%琼脂糖凝胶电泳,溴化乙锭染色成像。
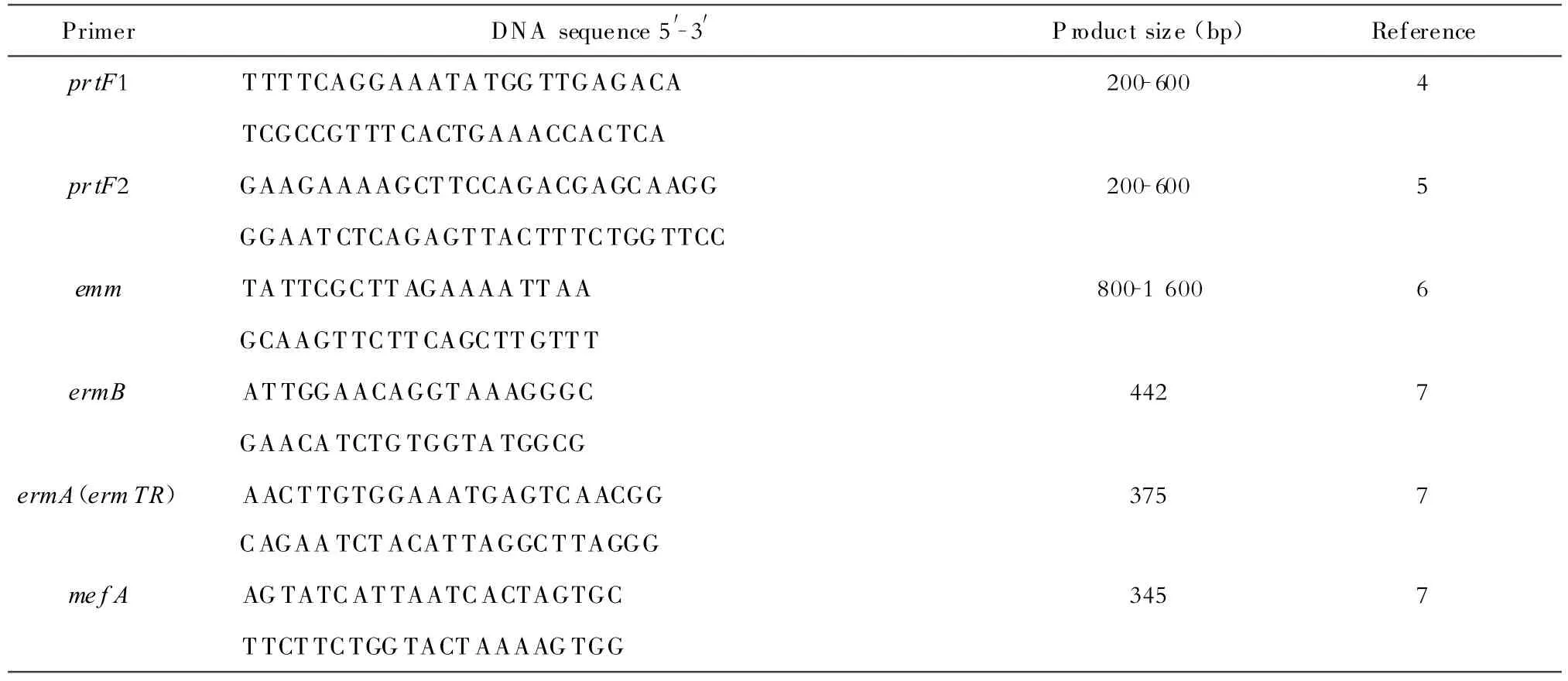
表1 用于检测 ermB、ermTR、mef A、prfF1、prtF2的引物Table 1.Primers used for amplification of ermB,ermTR,mef A,prfF1,and prtF2genes
(三)Emm分型 将PCR所得emm基因测序,测序序列与美国CDC数据库对比(CDC:http://www.cdc.gov/ncidod/biotech/strep/protocols.html)。
(四)统计分析 采用统计软件SPSS13.0进行卡方检验进行率的比较,P<0.05为差异有统计学意义。
结 果
一、prtF基因的携带率及在不同感染人群中的分布
在239株中,prf F1阳性 161株,占67.36%,prtF2阳性的有158株,占66.11%。两个基因都为阳性的有141株,占59.00%,两者均为阴性的有61株,占27.32%。
prtF1基因阳性菌株在致咽炎菌株、致猩红热菌株、侵袭性菌株、健康携带菌株中的携带率分别为69.62%、61.90%、37.50%和 81.25%;致咽炎、致猩红热菌株与健康携带菌株之间没有差别(P>0.05),仅健康携带菌株与侵袭性菌株之间有差别,健康儿童prtF1基因携带率高于侵袭性感染分离株(P<0.05)。prtF2基因阳性菌株在致咽炎菌株、致猩红热菌株、侵袭性菌株、健康携带菌株中的携带率分别为 63.29%、59.52%、62.50%和83.33%。病原菌株与正常携带株比较,健康儿童prtF2基因携带率高于病原菌株(P<0.05)(表2)。
prtF1及prtF2同时阳性携带率在致咽炎、猩红热和侵袭性疾病菌株中分别为56.96%、55.95%和37.50%,分布差异均没有统计学意义(P>0.05)。在健康携带株中占79.17%,在病原菌株中均低于健康携带菌株(P<0.05)。
二、prtF基因在不同emm分型GAS中的分布
239株GAS分离株有16种emm分型,包括emm12、emm1、emm22 、emm4、emm3、emmst1815、emm18、emm6、emm77、emm87、emm80、emm86、emm41、emm63、emm112、emmstG485.0。其中最多的有 emm12(53.14%)、emm1(25.94%)、emm22(6.28%)、emm4(3.35%),这4种emm 分型占菌株总数的 88.7%。如表3所示:emm1、emm4中prtF1和prtF2的携带率及两种基因同时携带率均低于emm12型和emm22型(P<0.05)。两者基因同时阳性在emm12、emm22型中更为多见,而在emm1型中则多为阴性。在 emm3、emmst1815、emm18型中多为仅prtF2阳性。
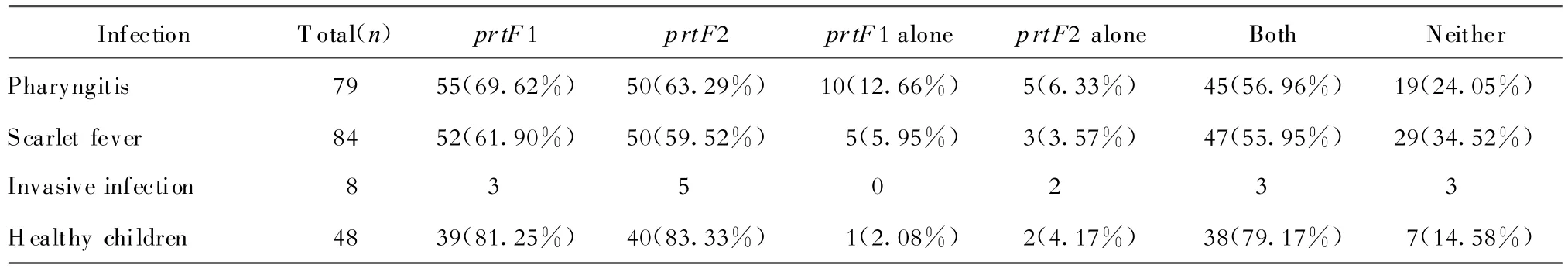
表2 prtF基因在不同感染人群中的分布Table 2.The prevalence of prtF genes by different infections

表3 纤维结合蛋白基因在不同emm型菌株中的分布Table 3.The distribution of prtF genes by different emm types

表4 纤维结合蛋白基因与大环内酯类抗生素耐药及耐药基因的关系Table 4.Relationship between prtF genes and macrolide resistance determinants
三、prtF基因与菌株耐药性及耐药基因的相关性
琼脂稀释法检测239株GAS对4种大环内酯类抗生素及克林霉素的敏感性。结果共有42株红霉素敏感株,197株红霉素耐药株。在197株耐药株中,prtF1和 prtF2同时阳性在耐药株中为64.46%,在敏感株中为30.95%,在耐药株中的阳性率高于敏感株,差异有统计学意义(P<0.05)。prtF1基因和prtF2基因单独阳性在耐药株分别为69.04%和 67.51%;在敏感株分别为57.14%和54.76%,两组之间差异无统计学意义(P>0.05)。
在197株大环内酯类耐药株中ermB阳性的有186株,ermTR阳性的有11株,prtF1基因在ermB阳性的菌株中携带率为71.51%,在ermTR中的携带率为27.27%;prtF2基因在ermB阳性的菌株中携带率为 70.43%,在 ermTR中的携带率为18.18%,两者同时阳性在携带ermB的菌株中占67.74%,prtF1,2基因同时阳性率在ermB阳性的菌株中高于ermTR阳性菌株(P<0.05)。
讨 论
纤维结合蛋白是存在于许多病原菌包括GAS中的重要毒力因子,有结合细胞外蛋白的能力,支持细菌黏附定植在黏膜表面并在黏膜表面或上皮细胞内存活[8],并可以帮助细菌逃避机体免疫反应。β内酰胺类抗生素如青霉素多在细胞外起作用,对进入细胞内的细菌没有效果,这也是许多青霉素治疗GAS感染失败的原因所在[1]。而大环内酯类抗生素多进入细胞内杀灭细菌,国外有报道由erm基因介导的耐药基因与prtF基因密切相关[4]。本研究则是观察 prtF基因在我国GAS菌株所致疾病、emm分型以及与大环内酯类抗生素耐药的关系。
GAS菌株prtF基因的携带率在不同国家的研究中各有不同,一般为30%~40%到70%~80%[4,9],澳大利亚Vlaminckx等[10]报道,导致侵袭性感染的GASprtF1携带率为50%;而欧洲报道侵袭性分离株 prtF1的阳性率为19.41%[1],德国报道儿科临床分离株阳性率30.56%[11],日本报道儿科临床分离株阳性率为75.00%[12];PrtF2在国外报道的临床分离株的携带率为36%~80%[13-14],prtF1/prtF2同为阳性率为31%~100%[13-14]。本文报道的菌株中prtF1的阳性率为70.24%,PrtF2的携带率为69.27%,prtF1/prtF2同时阳性率为65.37%,与日本相近。
有研究显示,prtF1在侵袭性菌株比非侵袭性菌株中阳性率高[7],prtF1与 prtF2在非侵袭性菌株与健康携带株之间的阳性率没有差别[7],而本结果显示prtF1基因的携带率在致咽炎、猩红热株与非致病株之间没有差别,与国外研究相似,但在正常携带株中prtF1的携带率高于侵袭株,在侵袭株与致咽炎、猩红热株中则没有差别,这种结果可能是我们搜集到的侵袭株太少所引起的误差所致。prtF2和 prtF1/prtF2基因组合在健康携带株中的阳性率高于病原株,与意大利报道的一致[1],而与澳大利亚报道的仅存在于病原菌株不同。有报道称prtF2比prtF1更具有细胞内摄作用,但是在我国更多地存在于健康儿童所携带的GAS中,prtF蛋白的作用机制与致病机制还需要进一步探索。
同时携带prtF1和prtF2基因组的研究显示,prtF1和prtF2或存在于一个潜在的致病岛(纤维结合胶原束T移植抗原岛)(M12型),或存在于独立的基因座(M3型和M18型)[15]。有研究发现,prtF1/prtF2基因组合通常存在于某些特定emm分型中,如emm3和emm12型,而emm18型菌株中不携带prtF基因,并与菌株的分离部位无关[7]。在本研究中,prtF更多的存在于emm12和emm22型中,6株emm18型菌株中多为 prtF2阳性,而emm3、emmst1815型中也只检测到 prtF2基因。prtF基因与emm基因的关系尚需要进一步的研究。由于本研究的菌株91.63%来自于咽拭子,其他来源的菌株较少,我们没有分析不同分离部位之间的差异。
国外的报道显示prtF基因在大环内酯类抗生素耐药菌株中阳性率高,prtF在erm基因阳性的菌株中比mef A阳性菌株中更常见[2],prtF1/prtF2基因组合与erm基因的关系比单独prtF关系更强[7]。德国关于儿科分离株的研究中在ermTR阳性菌中没有检测到prtF基因[13]。本研究的菌株中,prtF1和 prtF2在大环内酯类抗生素敏感株和耐药株中的携带率无明显差异,这一结果与其他研究中这2种基因在耐药菌株中携带率高的结果不符。本研究结果显示 prtF1和 prtF2同时携带率在大环内酯类抗生素敏感株和耐药株中有差异,这与国外一些报道相同[7]。本研究还显示这两种纤维结合蛋白基因在ermB的菌株中携带率较高,ermTR阳性的菌株中仅有27.27%携带prtF1,与德国的结果类似。
GAS由于prtF蛋白的作用,易进入上呼吸道上皮细胞逃避β内酰胺类抗生素作用,又携带erm基因而得以逃避大环内酯类抗生素作用。本研究表明,在我国儿童GAS分离株中,以共同携带prtF1/prtF2基因的emm12型菌株为主,多存在于健康儿童中,erm基因菌株多存在于咽部分离的非侵袭性菌株中,为耐药菌株的传播提供便利。这可能是我国的GAS耐药水平高,而侵袭性不高的原因。我们结果补充了GAS临床感染菌株关于prtF毒力基因的特征,从而对我国儿科GAS的致病性,耐药性及其传播,有了更深刻的认识和理解,对制定治疗措施提出新的要求。
致谢 本研究所用菌株由北京儿童医院、重庆儿童医院、深圳儿童医院提供,mef A阳性对照菌株由中国药品生物制品检定所提供,在此表示感谢。感谢北京儿童医院儿科研究所微生物室全体人员在研究过程中给予的帮助与支持。
[1] Baldassarri L,Creti R,Imperi M,et al.Detection of genes encoding internalization-associated proteins in Streptococcus pyogenes isolates from patients with invasive diseases and asymptomatic carriers[J].J Clin Microbiol,2007,45(4):1284-1287.
[2] No authors listed.Defining the group A streptococcal toxic shock syndrome:rationale and consensus definition.Working Group on Severe Streptococcal Infections[J].JAM A,1993,269(3):390-391.
[3] Szczypa K,Sadowy E,Izdebski R,et al.Group A Streptococci from invasive-disease episodes in Poland are remarkably divergent at the molecular level[J].J Clin Microbiol,2006,40(11):3975-3979.
[4] Facinelli B,Spinaci C,Magi G,et al.Association between erythromycin resistance and ability to enter human respiratory cells in group A streptococci[J].Lancet,2001,358(9275):30-33.
[5] Gorton D,Norton G,Layton R,et al.Presence of fibronectin-binding protein gene prtF2 in invasive group A streptococci in tropical Australia is associated with increased internalisation efficiency[J].Microbes Infect,2005,7(3):421-426.
[6] Creti R,Imperi M,Baldassarri L,et al.emm T ypes,virulence factors,and antibiotic resistance of invasive Streptococcus pyogenes isolates from Italy:What has changed in 11 years?[J].J Clin Microbiol,2007,45(7):2249-2256.
[7] Pe′rez-T rallero E,Montes M,Orden B,et al.Phenoty pic and genotypic characterization of Streptococcus pyogenes Isolates displaying the MLSB phenotype of macrolide resistance in spain,1999 to 2005[J].Antimicrobial Agents Chemotherapy,2007,51(4):1228-1233.
[8] Bianco S,Allice T,Zucca M,et al.Survey of phenoty pic and genetic features of Streptococcus pyogenes strains isolated in Northwest Italy[J].Curr Microbiol,2006,52(1):33-39.
[9] Musumeci R,Bue CL,Milazzo I,et al.Internalization-associated proteins among Streptococcus pyogenes isolated from asymptomatic carriers and children with pharyngitis[J].Clin Infect Dis,2003,37(2):173-179.
[10] Vlaminckx BJ,Mascini EM,Schellekens J,et al.Site-specific manifestations of invasive group A streptococcal diseases:type distribution and corresponding patterns of virulence determinants[J].J Clin Microbiol,2003,41(11):4941-4949.
[11] Haller M,Fluegge K,Arri SJ.Association between resistance to ery thromycin and the presence of the fibronectin binding protein F1 Gene,prtF1,in Streptococcus pyogenes isolates from German pediatric patients[J].Antimicrob Agents Chemother,2005,49(7):2990-2993.
[12] M a X,Kikuta H,Ishiguro N.Association of the prtF1 Gene(encoding fibronectin-binding protein F1)and the sic Gene(encoding the Streptococcal inhibitor of complement)with emm types of Group A Streptococci isolated from Japanese children with pharyngitis[J].J Clin Microbiol,2002,40(10):3835-3837.
[13] Goodfellow AM,Hibble M,T alay SR,et al.Distribution and antigenicity of fibronectin-binding proteins(SfbI and SfbII)of Streptococcus pyogenes clinical isolates from the Northern Territory,Australia[J].J Clin Microbiol,2000,38(1):389-392.
[14] Kreikemeyer B,Oehmcke S,Nakata M,et al.Streptococcus pyogenes fibronectin-binding protein F2:expression profile,binding characteristics,and impact on eukaryotic cell interactions[J].J Biol Chem,2004,279(16):15850-15859.
[15] Bessen DE,Kalia A.Genomic localization of a T serotype locus to a recombinatorial zone encoding extracellular matrixbinding proteins in Streptococcus pyogenes[J].Infect Immun,2002,70(3):1159-1167.

