人胎儿肝脏间充质干细胞的体外培养及生物学特性研究
毕薇薇,黄若洋,刘洋
近年来,对间充质干细胞(mesenchymal stem cell,MSC)的研究越来越细致和深入,MSC 的动物及临床试验研究也越来越广泛。MSC 可来源于骨髓、脐带、脂肪、肌肉等组织,其中研究与应用较多的是自体骨髓 MSC。但由于骨髓来源的 MSC受年龄及身体状况等因素影响,其细胞质量和数量受到很大限制[1]。为此,本实验尝试在体外从人胎儿肝脏中提取 MSC 并研究其生物学特性,以期为将来 MSC 的临床应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 标本来源 人胎儿肝脏组织来源于四平市中心医院药物流产胎儿,胎龄 2~3 个月,母亲身体健康(捐献者均签署知情同意书)。肝功能正常,肝炎病毒标志物均为阴性。梅毒阴性,HIV 阴性。
1.1.2 主要试剂与仪器 α-MEM 培养液和优等胎牛血清(FBS)购自美国 Hyclone 公司;胰蛋白酶购自美国 Gibco 公司;II 型胶原酶购自美国Sigma 公司;FITC 标记的小鼠抗人 CD34、CD44、CD105、CD13、HLA-ABC、HLA-DR 单抗购自法国 Immuntech 公司;细胞培养瓶购自美国 Corning公司;371 型高温灭菌 CO2培养箱购自美国Thermo 公司;程序降温盒购自美国 NALGENE 公司;CKX41 型倒置相差显微镜为日本 Olympus 公司产品。
1.2 方法
1.2.1 人胎儿肝脏 MSC 的分离与培养 无菌取出胎肝,用 PBS 冲洗数次,剪碎后用 0.25%胰酶消化后 4℃过夜。次日取出于 37℃继续消化 5~10min,吸出细胞悬液,在剩余组织中加入 0.1%的II 型胶原酶,37℃中和 10min,消化后组织用200 目筛网过滤,获得的细胞悬液 270×g离心5min,细胞沉淀用 PBS 洗 2 次。将细胞沉淀置于含 10%胎牛血清的 α-MEM 培养液中,吹打制备成终浓度为1×106/ml 的细胞悬液。将细胞悬液加入装有含 10%胎牛血清的 α-MEM 培养液的25cm2培养瓶中,置于 37℃、5%CO2培养箱中培养。48 h 后,吸出悬浮细胞液体,更换新培养液;随后 2~3 d 换液 1 次,倒置相差显微镜下观察细胞生长情况并拍照。待细胞生长至 10 d 左右达80%以上融合后,加入 0.25%胰蛋白酶- 0.02%EDTA(1∶1)混合液消化进行重复传代培养,各代细胞依次记为P1~P10 代细胞。
1.2.2 MSC 生长曲线的测定 取生长良好的P3、P7、P10 代细胞,用 0.25%胰酶(含 1mmol EDTA)消化后,以 2×104/ml 的密度接种于 24 孔板,每孔 1 ml。每天各取 3 孔消化计数细胞,取平均值,连续培养 7 d。以培养时间为横轴,细胞数为纵轴,绘制细胞生长曲线。
1.2.3 MSC 表面抗原标志的测定 取生长良好的 P5 代细胞,用 0.25%胰酶(含 1mmol EDTA)消化。PBS 洗涤 2 次,制备成终浓度为1×106/ml的细胞悬液,分装入试管中,每管 0.1 ml。分别加入 FITC 标记的小鼠抗人 CD34、CD44、CD105、CD13、HLA-ABC、HLA-DR 单抗,同时以加入α-MEM 培养液作为阴性对照。黑暗中孵化 15min后,上流式细胞仪检测。
1.2.4 向成骨细胞的诱导及鉴定 取生长良好的P4 代细胞,用 0.25%胰酶(含 1mmol EDTA)消化后,以 4×104/ml 的密度接种于预置多聚赖氨酸预处理盖玻片的 6 孔板内。加入含有 1×10-8mol/L 地塞米松、1×10-2mol/L β-甘油磷酸钠、1.5×10-4mol/L 维生素 C 的 α-MEM 培养液诱导培养,同时以仅加入 α-MEM 培养液作为阴性对照,每 3 d 换液 1 次。诱导 2 周左右取出细胞爬片,进行碱性磷酸酶染色。
1.2.5 MSC 的冻存与复苏 随机收集生长良好的传代细胞,取少量细胞悬浮液(约 0.1 ml)计数细胞浓度及冻前存活率。加入含有 10%二甲基亚砜(DMSO)和 30%胎牛血清的新鲜培养液,装入无菌塑料冷冻保存管(corning)放至程序降温盒中,于 –70℃冻存 24 h 后转入液氮保存。分别于 2 个月和 6 个月后,取出冻存管,37℃水浴复苏细胞,台盼蓝染色检测细胞活性。在细胞悬液中加入 α-MEM 培养液后离心,置于 37℃、5%的CO2培养箱中培养,每日倒置相差显微镜下观察细胞生长状态及数量。
2 结果
2.1 MSC 体外培养与形态学观察
原代细胞接种 3 d 后可见少量贴壁细胞,细胞大小形态不均,呈圆形、纤维样或内皮细胞样,均为单个细胞(图1A);6 d 后细胞开始快速增长,形成多处快速生长的细胞集落,集落内细胞多为较宽的梭形细胞,呈漩涡状或放射状平行排列,且随着培养时间的延长,细胞集落伸展增大。原代培养至 11 d 左右时细胞达 80%~90%融合,此时细胞排列紧密,多呈纤维样,而内皮样细胞少见,圆形细胞消失(图1B)。细胞传代培养 2~3 代后维持纤维样形态,较紧密。

图1 人胎儿肝脏 MSC 体外原代培养的形态学观察(A:培养第3 天时细胞形态,倒置相差显微镜×100;B:培养第11 天时细胞形态,倒置相差显微镜×40)Figure 1 The morphology observation of human fetal liver MSC cultured in vitro.A: The morphology of human fetal liver MSC cultured for 3 days, inverted phase contrast microscope×100; B: The morphology of human fetal liver MSC cultured for 11 days, inverted phase contrast microscope×40.
2.2 MSC 生长曲线分析
传代细胞生长较原代细胞要快,一般 4~5 d左右即能达到 90%以上融合。观察 P3、P7、P10代细胞的生长曲线,发现具有以下共同特征:传代培养的潜伏期约为24~48 h,对数增殖期约为3~4 d,对数增殖期后第5~6 天进入平台期(图2)。
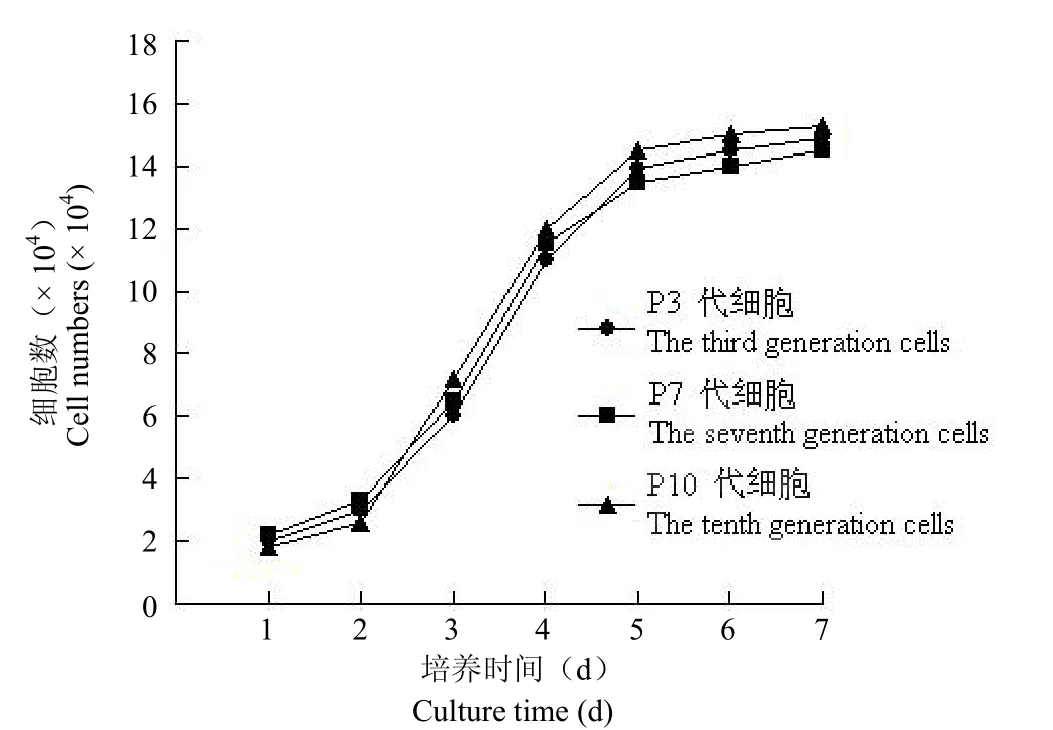
图2 人胎儿肝脏 MSC 体外传代培养细胞生长曲线Figure 2 Growth curve of human fetal liver MSC subcultured in vitro

图3 人胎儿肝脏 MSC 表面抗原标志的流式细胞术检测Figure 3 Detection of antigen markers on human fetal liver MSC surface by flow cytometry
2.3 MSC表面抗原标志检测
流式细胞仪检测显示,MSC 表面 CD34、HLA-DR 均呈阴性表达,CD44、CD105、CD13 均呈阳性表达,HLA-ABC 呈弱阳性表达(图3)。
2.4 成骨诱导鉴定
成骨诱导培养 2 周后,进行碱性磷酸酶染色,可见诱导后细胞的细胞核染成均一的淡蓝色,阴性对照则未见细胞染色(图4)。证实人胎儿肝脏来源的 MSC 有成骨分化潜能。

图4 人胎儿肝脏 MSC 体外成骨诱导的碱性磷酸酶染色检测(倒置相差显微镜×400)Figure 4 Detection of human fetal liver MSC induced into Osteogenesis in vitro by alkaline phosphatase staining (Inverted phase contrast microscope×400)
2.5 细胞冻存及复苏生长特性分析
台盼蓝染色计数复苏后细胞存活率达 90%以上,倒置相差显微镜下观察复苏后细胞增殖能力较强,与未冻存传代细胞相比具有相同的生长特性。
3 讨论
体内、外实验证明在不同的诱导条件下,MSC可分化为多种细胞,并可分泌多种趋化因子和生长因子等[2],能促进细胞的生长、增殖并介导细胞的迁移[3-4],具有广泛潜在的临床应用价值。此外,MSC 还易于外源基因的转染和表达,其携带的外源基因表达具有组织特异性,可定位于缺陷组织,因此 MSC 的分离培养及扩增具有重要意义。胚胎组织中 MSC 的含量相对较高,且具有更强的增殖分化潜能;另外,由于胚胎处在宫内发育阶段时,受环境影响较小,因而由环境因素所引起的基因突变也较少;同时胚胎组织细胞的免疫原性及免疫活性也较成体组织更弱,这也存在着明显的优势。胚胎肝脏在人孕 5 周开始造血,在胚胎造血期间,机体需要间质组织及其分泌的大量细胞因子以支持并促进造血和血细胞分化[5],因此早期的胎肝中含有丰富的 MSC。
肝脏组成复杂,人们通常使用经腹主动脉或脐静脉灌流消化法[6](胰蛋白酶或胶原酶)先离散细胞,再通过淋巴细胞分离液或进行密度梯度离心获取单个核细胞[7]。此类方法不仅操作复杂,而且易污染。本研究采用双酶消化法从人胎肝中分离获取MSC,结果显示胎肝来源的 MSC 在生长周期、表面抗原标志[8]、免疫学特性以及向脂肪细胞和成骨细胞分化能力等方面与以往研究的骨髓来源的MSC 相类似。胎龄越小,由于肝脏 MSC 占肝组织各种细胞的比例越大,越容易分离、纯化。但有研究表明,不同来源的 MSC 所分泌的细胞因子也不完全相同[9]。
目前,肝干细胞参与肝脏生长发育与再生的观点已被广泛接受,利用肝干细胞进行细胞移植与生物人工肝治疗各种终末期肝病也被认为是最有前途的方法之一。但有关肝干细胞活化、分离培养、筛选及鉴定等方法尚未成熟,还有待进一步发展和完善。
[1]Gong Z, Calkins G, Cheng EC, et al.Influence of culture medium on smooth muscle cell differentiation from human bone marrow-derived mesenchymal stem cells.Tissue Eng Part A, 2009, 15(2):319-330.
[2]Forte G,minieri M, Cossa P, et al.Hepatocyte growth factor effects on mesenchymal stem cells: proliferation, migration, and differentiation.Stem Cells, 2006, 24(1):23-33.
[3]Kortesidis A, Zannettino A, Isenmann S, et al.Stromal-derived factor-1 promotes the growth, survival, and development of human bone marrow stromal stem cells.Blood, 2005, 105(10)3793-3801.
[4]Ponte AL, Marais E, Gallay N, et al.The in vitro migration capacity of human bone marrow mesenchymal stem cells: comparison of chemokine and growth factor chemotactic activities.Stem Cells, 2007,25(7):1737-1745.
[5]Schmelzer E, Zhang L, Bruce A, et al.Human hepatic stem cells from fetal and postnatal donors.J Exp Med, 2007, 204(8):1973-1987.
[6]Ma JX, Fang CH, Zhang W, et al.Isolation and culture of adult rat liver stem cells and Morphological observation.Chin J Hepatobiliary Surg, 2005, 11(1):60-62.(in Chinese)马俊勋, 方驰华, 张伟, 等.成体大鼠肝干细胞分离、培养及形态学观察.中华肝胆外科杂志, 2005, 11(1):60-62.
[7]Fang B, Li N, Song Y, et al.Comparison of human postembryonic, multipotent stem cells derived from various tissues.Biotechnol Lett, 2009, 31(7):929-938.
[8]Gonzalez R, Maki CB, Pacchiarotti J, et al.Pluripotent marker expression and differentiation of human second trimester Mesenchymal Stem Cells.Biochem Biophys Res Commun, 2007,362(2):491-497.
[9]Hwang JH, Shim SS, Seok OS, et al.Comparison of cytokine expression in mesenchymal stem cells from human placenta, cord blood, and bone marrow.J Korean Med Sci, 2009, 24(4):547-554.

