shRNA双表达载体pCSH1的构建及抗肿瘤活性研究
何红伟,李保卫,任开环,邵荣光
RNA 干扰(RNAi)技术是一种非常有潜力的疾病治疗手段,具有干扰特异性高、可同时干扰多个基因的特点[1-3]。与化学合成小干扰 RNA(siRNA)及短发夹 RNA(shRNA)病毒表达载体法相比,shRNA 非病毒表达载体法介导的多靶点RNAi 操作简便、成本低、干扰效果稳定且安全性高[4]。但 shRNA 表达质粒有时可以促发干扰素效应,这种非特异性作用与浓度有密切关系,在需要同时抑制两个或多个基因时往往受到很大的限制。所以本研究设计并构建了一种可用于同时表达两种 shRNA 的载体 pCSH1,在对两个靶基因产生有效的特异 RNA 干扰的同时降低载体的用量,从而减少非特异性作用。
1 材料与方法
1.1 主要材料
质粒 pUC19,人肝癌 HepG2 细胞本室保存;pSilencer H1 3.0 购自美国 ambion 公司;TRIzol、RT-PCR 试剂盒购自美国 Invitrogen 公司;N-Ras、c-Myc、β-actin 单克隆抗体均购自美国 Santa Cruz公司。
1.2 方法
1.2.1 可同时表达多种基因 shRNA 的载体pCSH1 的设计与构建 为了实现将两个 shRNA转录单位串联在一个载体上的目的,利用同尾酶的特性,需要在 shRNA 转录单位两侧选择一对同尾酶和设计两组多克隆位点(KSEE、HXEP),使这两组多克隆位点与 shRNA 表达转录单位、pUC19的质粒序列有序组合,构建成质粒载体。根据以上设计思路,需人工合成两对引物,每对引物对应一个多克隆位点。合成的引物序列分别为:KSEEa:5’ AAT TGG TAC CGT CGA CGA TAT CG 3’,KSEEas:3’ CCA TGG CAG CTG CTA TAG CTT AA 5’,HXEPa:5’ AGC TTC TCG AGA TAT CTG C 3’,HXEPas:3’ AGA GCT CTA TAG ACG TCG A 5’。KSEEa 和 KSEEas 可以退火形成双链,双链上含有 Kpn I、Sal I、EcoR V 和 EcoR I 共 4 个酶切位点;HXEPa 和 HXEPas 可以形成双链,双链上含有 Hind III、Xho I、EcoR V 和 Pst I 共 4 个酶切位点。这两对引物退火形成双链后,将 pUC19 质粒片段和 pSilencer H1 3.0 中的 H1 启动子片段共 4 个片段连接起来。然后测序验证插入片断的正误,构建形成 pCSH1 表达载体(图1)。
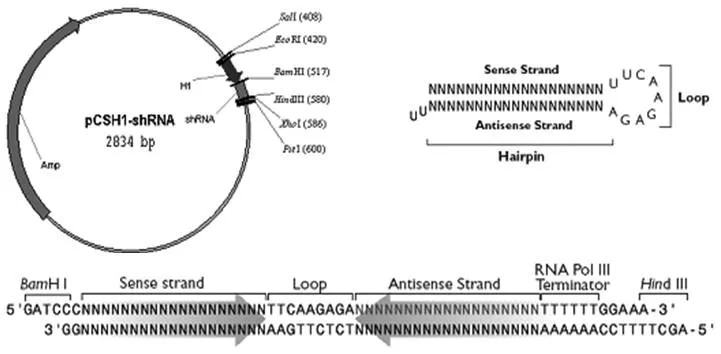
图1 pCSH1 质粒图谱和 shRNA 转录模板示意图(修改自 pSilencerH1 3.0,ambion)Figure 1 Small hairpin RNA template and the pCSH1 vector maps (Modified from pSilencerH1 3.0, ambion)
1.2.2 携带两个 shRNA 表达单位的 pCSH1-shNM 载体的构建 首先合成两个肿瘤相关基因N-Ras 和 c-Myc 的 shRNA 模板。N-Ras-shRNA的寡 DNA 引物序列为:5’ GAT CCG TGT GAT TTG CCA ACA AGG TTC AAG AGA CCT TGT TGG CAA ATC ACA CTT TTT TGG AAA 3’ 和 5’AGC TTT TCC AAA AAA GTG TGA TTT GCC AAC AAG GT C TCT TGA ACC TTG TTG GCA AAT CAC ACG 3’;c-Myc-siRNA 的寡 DNA 序列如下:5’ GAT CCC GGA AGA AAT TCG AGC TGC TTT CAA GAG AAG CAG CTC GAA TTTC TTC CTT TTT TGG AAA 3’ 和 5’ AGC TTT TCC AAA AAA GGA AGA AAT TCG AGC TGC TTC TCT TGA AAG CAG CTC GAA TTT CTT CCG G 3’;实验中采用的阴性对照 mock-shRNA 序列为:5’GATCCC GGA TAG TAC GAG ATT ACA CTT CAA GAG AGT GTA ATC TCG TAC TAT CCT TTT TTG GAA A 3’ 和 5’ AGC TTT TCC AAAAAA GGA TAG TAC GAG ATT ACA CTC TCT TGA AGT GTA ATC TCG TAC TAT CCG G 3’。引物送到北京赛百盛基因技术有限公司合成。这三对引物退火形成双链后,连入 pCSH1 载体中,分别构建成 pCSH1-shNR、pCSH1-shMyc 和 pCSH1-shMock 质粒。然后将构建好的载体 pCSH1-shNR 用 Sal I + Pst I酶切回收小片断,再用 Xho I + Pst I 酶切载体pCSH1-shMyc 回收大片断,由于 Sal I 和 Xho I是同尾酶,所以可以直接将两个回收的片断连接,即实现了两个 shRNA 转录单位的串联。构建后的载体中 Sal I 、Xho I 和 Pst I 3 个酶切位点的相对位置维持不变,可以继续用于串联更多的 shRNA转录单位(图2)。
1.2.3 干扰序列表达质粒的转染 提取真核转染级的质粒,使用 LipofectamineTM2000 脂质体转染人肝癌 HepG2 细胞,转染后 24~36 h 进行沉默效果测定。

图2 两个 shRNA 转录单位串联的流程图Figure 2 Ligation flow diagram of two shRNA expression cassettes in one plasmid
1.2.4 RT-PCR 细胞转染 24 h 后,用 TRIzol 提取总 RNA,并用紫外分光光度计测定 RNA 的浓度和质量。采用 RT-PCR 试剂盒对 mRNA 水平进行检测。以 GAPDH 为内标进行 RT-PCR,反应完成后将产物进行琼脂糖电泳,用凝胶成像仪照相并分析结果。
1.2.5 Western Blot 细胞转染 36 h 后,10%SDS-PAGE 凝胶电泳分离各组蛋白样品,半干转膜仪将蛋白转到 PVDF 膜上,然后进行 Western Blotting 检测。
1.2.6 细胞克隆形成法 将质粒载体瞬时转染HepG2 细胞 24 h 后,以每孔 40 个细胞的密度接种在 96 孔培养板中。培养 10 d,当出现肉眼可见的克隆时,甲醇固定 15min,Giemsa 染液染色15min。显微镜下计数大于 50 个细胞的克隆数。
1.2.7 细胞生长曲线法 将质粒载体转染肿瘤细胞 24 h 后,将细胞以每孔 3000 个细胞铺到 24 孔板中,并连续计数 6 d,以培养时间为横轴,细胞数为纵轴(或对数)作图,绘制细胞的生长曲线。
1.3 统计学分析
各项检测数据以±s表示,组间比较采用未配对t检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 shRNA 表达载体 pCSH1 的构建
按照实验方法所述进行载体构建,构建成的载体委托宝生物公司测序,引物为M13±,双向测序结果均正确,证明改造完成,其 shRNA 转录单位的序列中,EcoRI 与 BamHI 之间为H1 启动子序列,BamHI 与 HindIII 之间为shRNA 模板及终止子序列,EcoRI 之前与 HindIII 之后为两个多酶切位点。构建完成后的 pCSH1 如图1 所示。
分别合成以 N-Ras 和 c-Myc 为靶点的干扰序列,以及不针对任何靶点的阴性对照 Mock序列,插入 pCSH1,得到质粒 pCSH1-shNR,pCSH1-shMyc 和 pCSH1-shMock,进行测序鉴定,结果表明各种 shRNA 模板序列正确。然后,按照实验方法所述构建了能同时表达抗 N-Ras 和 c-Myc 的质粒 pCSH1-shNM(图2)。
2.2 pCSH1-shNR、pCSH1-shMyc 和 pCSH1-shNM干扰效果的验证
分别采用 RT-PCR 和 Western Blot 法测定质粒转染人肝癌 HepG2 细胞后对靶基因的 mRNA和蛋白水平的影响。RT-PCR 结果表明,pCSH1-shNR 和 pCSH1-shNM 能够有效降低N-Ras 基因mRNA 水平,而 pCSH1-shMock 对 N-Ras 基因mRNA 的水平没有影响(图3)。pCSH1-shMyc 和pCSH1-shNM 能够有效降低 c-Myc 基因 mRNA的水平,而 pCSH1-shMock 对 c-Myc 基因 mRNA的水平没有影响(图4)。Western Blot 结果表明,pCSH1-shNR、pCSH1-shMyc 能分别抑制 HepG2细胞中 N-Ras 或 c-Myc 蛋白的表达,能同时干扰两个基因的载体 pCSH1-shNM,则可以同时抑制N-Ras 和 c-Myc 蛋白的表达。而 pCSH1-shMock对 N-Ras 和 c-Myc 蛋白水平没有影响,Western Blot 以 β-actin 作为上样对照(图5)。

图3 pCSH1-shNR、pCSH1-shNM 降低 N-Ras 的 mRNA水平Figure 3 N-Ras mRNA level was distinctly reduced by pCSH1-shNR and pCSH1-shNM
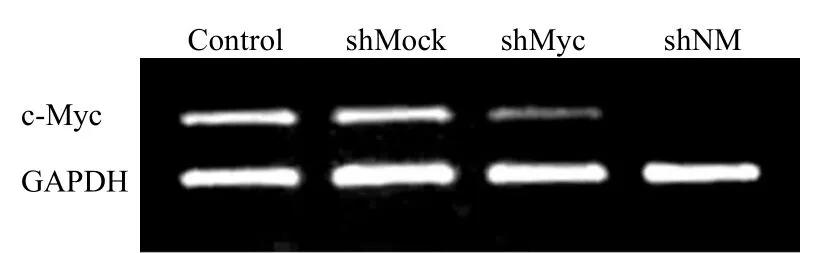
图4 pCSH1-shMyc、pCSH1-shNM 降低 c-Myc 的mRNA 水平Figure 4 c-Myc mRNA level was distinctly reduced by pCSH1-shMyc and pCSH1-shMyc

图5 pCSH1-shNR、pCSH1-shMyc 和 pCSH1-shNM 对人肝癌 HepG2 细胞靶蛋白水平的影响Figure 5 Effects of pCSH1-shNR, pCSH1-shMyc and pCSH1-shNM on N-Ras and c-Myc proteins
2.3 载体 pCSH1-shNM 对细胞克隆形成的影响
为了考察 N-Ras 和 c-Myc 协同干扰是否对肿瘤抑制有增效作用,我们用克隆形成法来检测pCSH1-shNM 对 HepG 2 细胞增殖的影响。结果表明(图6),HepG2 瞬时转染 pCSH1-shMock 后对克隆形成率也有一定的影响(与对照相比下降19%),而 pCSH1-shNR 处理后克隆形成率降低了51.1%,pCSH1-shMyc 转染组降低了 54.0%;pCSH1-shNM 转染组降低幅度最大,达到了70.5%,且与 pCSH1-shNR、pCSH1-shMyc 转染组相比均具有统计学显著性差异。

图6 质粒 pCSH1-shMock、pCSH1-shNR、pCSH1-shMyc和 pCSH1-shNM 对人肝癌 HepG2 细胞的克隆形成的影响Figure 6 Effects of pCSH1-shMock, pCSH1-shNR, pCSH1-shMyc and pCSH1-shNM on clony formation of HepG2 cells
2.4 应用 pCSH1 实现针对肿瘤相关基因 N-Ras同一位点的 shRNA 转录单位串联
为了验证 pCSH1 对同一 shRNA 转录单位进行串联是否有意义,本研究构建了针对肿瘤相关基因 N-Ras 同一位点的 shRNA 转录单位串联的载体 pCSH1-2shNR,并用生长曲线法检验它对细胞生长的影响。细胞生长曲线结果表明,处理 6 d 后,与未做任何转染处理的对照相比较,pCSH1-shMock 转染组的细胞存活率为61.6%,pCSH1-2shMock 转染组的存活率为51.5%,pCSH1-shNR转染组的存活率为39.7%,pCSH1-2shNR 转染组的存活率为23.6%。以上结果提示相同质量的 pCSH1-2shNR 对细胞生长的抑制明显强于pCSH1-shNR,而相同质量的 pCSH1-2shMock 对细胞生长的抑制略微强于 pCSH1-shMock(图7)。
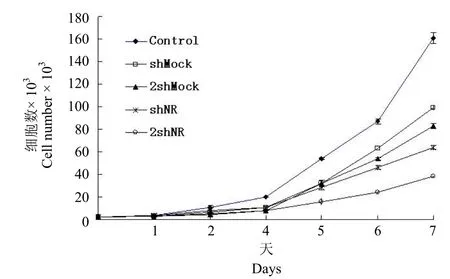
图7 pCSH1-2shNR、pCSH1-shNR 对人肝癌 HepG2 细胞生长的影响Figure 7 The inhibitory effects of pCSH1-2shNR and pCSH1-shNR on human hepatoma HepG2 cells
3 讨论
多靶点 RNA 干扰目前是一个研究的热点,载体表达的多靶点 RNA 干扰最初由 Jazag 等[5]于2005年提出并验证,目前发展了各种多靶点 RNA干扰载体的构建策略[6-9]。我们实验室也开展了该领域的研究,采用 siRNAs 对两个不同靶点进行抑制,还采用瞬时转染 siRNA 或 RNA 干扰载体与药物联用进行多靶点研究,取得了很好的效果[10-12]。本研究构建的 shRNA 表达质粒 pCSH1的目的是用于治疗,在设计时注意了尽量增加RNA 干扰的效率和尽量降低质粒在瞬时转染时的非特异毒性两个问题。
为了达到这个目的,必须考虑下列因素:①质粒大小尽量小;②shRNA 转录单位尽量多。根据这个思路,采用了 pUC19 的质粒基本序列;采用了 RNA 聚合酶 III 识别的 H1 启动子;并将shRNA 转录单位串联。pUC19 是一个很小的原核克隆质粒,分子量约为2.7 kb。目前用于 RNA 干扰表达载体的 RNA 聚合酶 III 识别的启动子有人 H1 启动子、人 U6 启动子和鼠 U6 启动子。人 H1 启动子是三个中分子量最小的一个。利用同尾酶的特性将 shRNA转录单位串联在一个质粒上也是一种操作简便的方法,且不会增加过多的冗余序列。构建完成后的质粒 pCSH1 实现了最初的构想。
在完成质粒 pCSH1 的构建之后,我们对该载体的功能进行了验证。实验表明将 N-Ras 和c-Myc 的 shRNA 模板构建入 pCSH1 质粒后,均可以有效地实现对靶基因的表达特异性抑制;pCSH1 质粒可以有效地串联相同的或不同的shRNA 转录单位,当质粒 pCSH1 串联了不同的shRNA 转录单位后两个不同靶点的抑制效果明显。说明两个 shRNA 转录单位存在于一个 pCSH1质粒上不会影响相互之间的转录活性。在此基础上初步考察了 pCSH1-shNM 的抗肿瘤活性。在克隆形成率实验中,pCSH1-shNM 比单独抑制 N-Ras和 c-Myc 的质粒 pCSH1-shNR、pCSH1-shMyc 对细胞克隆形成的抑制均有显著增强,说明这种联合抑制可以取得更好的抗肿瘤活性。
最后我们考察了构建两个相同 shRNA 转录单位的 pCSH1-2shNR,发现在相同的质粒用量的情况下,pCSH1-2shNR 对 HepG2 细胞增殖的影响明显高于 pCSH1-shNR,表示在相同的抑制效率下所需质粒的用量前者低于后者。降低了质粒的用量就意味着质粒导入细胞过程中产生非特异毒性的可能性降低。说明 pCSH1 针对同一位点的shRNA 转录单位串联可以增加 RNA 干扰效果或在保证相同的干扰效果的同时降低质粒的使用量。此外,还可以针对同一基因进行不同靶点的干扰,文献[13]表明这样可以提高对靶基因的抑制效率。
由此可以看出,文中所构建的载体 pCSH1 有如下特点:①分子量小;②能将 shRNA 转录单位串联;③串联之后能进行有效的干扰。该载体构建完成后,可以用于抗肿瘤研究中的多靶点干扰组合的研究,也可以被抗体导向的纳米颗粒或脂质体携带,用于多种疾病如肿瘤等的基因治疗研究。
[1]Sledz CA, Williams BR.RNA interference in biology and disease.Blood, 2005, 106(3):787-794.
[2]Robbins MA, Rossi JJ.Sensing the danger in RNA.Nat Med, 2005,11(3):250-251.
[3]Shao RG.Small interfering RNA mediated multi-target therapy of cancer.Acta Pharmaceutica Sinica, 2009, 44(3):219-225.(in Chinese)邵荣光.小干扰 RNA 介导的多靶点肿瘤治疗.药学学报,2009,44(3):219-225.
[4]Tuschl T.Expanding small RNA interference.Nat biotechnol, 2002,20(5):446-448.
[5]Jazag A, Kanai F, Ijichi H, et al.Single small-interfering RNA expression vector for silencing multiple transforming growth factor-beta pathway components.Nucleic Acids Res, 2005, 33(15):e131.
[6]Wang Y, Tao ZZ, Chen SM, et al.Application of combination of short hairpin RNA segments for silencing VEGF, TERT and Bcl-xl expression in laryngeal squamous carcinoma.Cancer Biol Ther, 2008,7(6):896-901.
[7]Hu T, Fu Q, Chen P, et al.Construction of an artificial MicroRNA expression vector for simultaneous inhibition of multiple genes in mammalian cells.Int J Mol Sci, 2009, 10(5):2158- 2168.
[8]Shan ZX, Lin QX, Yang M, et al.A quick and efficient approach for gene silencing by using triple putative microRNA-based short hairpin RNAs.Mol Cell Biochem, 2009, 323(1/2):81-89.
[9]Junn HJ, Kim JY, Seol DW.Effective knockdown of multiple target genes by expressing the single transcript harbouring multi-cistronic shRNAs.Biochem Biophys Res Commun, 2010, 396(4):861-865.
[10]Liu TG, Yin JQ, Shang BY, et al.Silencing of hdm2 oncogene by siRNA inhibits p53-dependent human breast cancer.Cancer Gene Ther, 2004, 11(11):748-756.
[11]Sun HX, He HW, Zhang SH, et al.Suppression of N-Ras by shRNA-expressing plasmid increases sensitivity of HepG2 cells to vincristine-induced growth inhibition.Cancer Gene Ther, 2009, 16(9):693-702.
[12]Zhao M, He HW, Sun HX, et al.Dual knockdown of N-ras and epiregulin synergistically suppressed the growth of human hepatoma cells.Biochem Biophys Res Commun, 2009, 387(2):239-244.
[13]Hung L, Kumar V.Specific inhibition of gene expression and transactivation functions of hepatitis B virus X protein and c-myc by small interfering RNAs.FEBS Lett, 2004, 560(1/3): 210-214.

