pGSK-3β和NF-κB在慢性支气管哮喘小鼠气道重塑中的表达水平及意义
蒋光,杨远
支气管哮喘是气道慢性炎症性疾病,反复炎症刺激可引起组织损伤及后续的组织结构的改变即气道重塑[1],其确切发生机制尚不十分清楚。糖原合成酶激酶 3β(glycogen synthase kinase3β,GSK-3β)是真核生物中广泛存在的丝/苏氨酸蛋白激酶,参与多种细胞过程和信号转导途径,可以参与核因子 kappa B(nuclear factor-kappa B,NF-κB)信号通路的调节。文献[2]报道 GSK3β 主要通过调节 NF-κB 核转位及亚基 p65 磷酸化而影响核因子的活性,而 NF-κB又是多向调节功能的转录因子,广泛参与许多基因的转录调控,包括基质金属蛋白酶 9(matrix metalloprotease-9,MMP-9)基因[3],是重要的炎症反应调节因子,它们在许多疾病生理病理过程中起重要作用,近年研究发现GSK-3β 具有逆向调节心肌肥厚[4]、气道平滑肌肥大增生[5]的作用,Bentley 等[6]发现急性支气管哮喘模型的气道平滑肌细胞肥大、增生,上皮细胞和炎症细胞中失活的磷酸化 GSK-3β(pGSK-3β)含量增加。全肺 pGSK-3β 增加,GSK-3β 活性降低,说明 GSK-3β 磷酸化、失活促进气道平滑肌重塑。有关 GSK-3β 在慢性哮喘气道重塑过程中的表达及作用尚不清楚。本实验旨在利用卵蛋白致敏和激发的慢性支气管哮喘小鼠模型,探讨支气管哮喘气道重塑形成过程中 GSK-3β、NF-κB 和mmP-9 的表达情况及相互关系,为气道重塑的发生机制提供新的理论依据。
1 材料与方法
1.1 主要试剂和仪器
清洁级雄性 BALB/c 小鼠 16 只,6 周龄,体重 16~20 g,许可证号:SCXK(苏)2007-0001,购于扬州大学比较医学中心;V 级鸡卵清蛋白(ovalbumin,OVA)购自美国 Sigma 公司;兔抗磷酸化糖原合成酶激酶-3β(Ser9)多克隆抗体购自美国 Cell signal 公司;鼠抗 NF-κB p65 单克隆抗体购自美国 Santa Cruz 公司;兔抗mmP-9 多克隆抗体购自美国 Santa Cruz 公司;β-actin 购自美国 Santa Cruz 公司 。SB-15347 垂直电泳仪购自美国 GE 公司;XXOV-450 半干转膜仪购自美国Bio-Rad 公司;硝酸纤维素膜购自美国 Bio-Rad 公司;增强化学发光剂(ECL)购自美国 GE 公司;Cymentre 2000 柯达活体成像仪购自美国 Kodak公司。
1.2 方法
1.2.1 慢性支气管哮喘小鼠模型制备 将小鼠随机分为2 组:哮喘组和对照组,每组 8 只。小鼠适应性饲养 1 周后,采用卵蛋白致敏和激发法[7]建立支气管哮喘小鼠模型。哮喘组于第0、14 天腹腔注射 OVA 10 μg + 氢氧化铝 2 mg 的生理盐水悬液 0.1 ml,第21 天开始以 2.5%OVA 雾化激发,30min/d,每周 3 d,共 6 周;对照组全部以生理盐水代替。
1.2.2 取材 2 组小鼠末次激发后 24 h 内颈椎脱臼处死动物,迅速打开胸腔,取出左肺于 10%中性福尔马林溶液中固定 24 h。肺标本严格于垂直位石蜡包埋,切片,片厚 3 μm。右肺用 PBS 液冲洗后入 –70℃低温冰箱中保存备用。
1.2.3 HE 染色 取左肺组织切片行 HE 染色,光学显微镜观察(观察倍数 10×40)支气管及周围的炎性细胞浸润情况及黏膜和平滑肌的变化。
1.2.4 pGSK-3β、NF-κB p65 和mmP-9 蛋白表达的检测 从 –70℃低温冰箱中取出右肺组织标本,剪碎后,加入蛋白质裂解缓冲液及蛋白酶抑制剂,置于玻璃匀浆器中研磨,冰上匀浆,4℃14 000×g离心 5min,取上清液,蛋白质印迹法[8]测定蛋白质含量。取上述上清液按上样量 40 μg 上样,加等体积的上样缓冲液稀释,经聚丙烯酞胺变性凝胶电泳分离蛋白,采用试剂说明书提供的电转法将蛋白转至 PVDF 膜上,依次加入封闭液、一抗(稀释度 1∶1 000)、辣根过氧化物酶标记二抗,再经化学发光剂反应,X 光片压片曝光。自动获取图片结果。相应蛋白表达值为条带的灰度值除以 β-actin(1∶1 000,43 KD)内参照校正。
1.3 统计学处理
采用 SPSS13.0 统计软件,数据以±s表示,进行t检验、单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 慢性哮喘气道重塑模型
对照组小鼠行动敏捷,一般情况未见异常。哮喘组经卵蛋白激发后,出现擦鼻,打喷嚏,呼吸急促,口唇发绀,腹部翕动,易激惹,烦躁不安,严重者出现呼吸减慢,行动迟缓或俯伏不动。
2.2 肺组织病理学变化
光学显微镜下哮喘组与对照组相比,小鼠气道壁及气道平滑肌明显增厚,黏膜下水肿,黏膜下层增宽,管腔狭窄,有时可见黏液栓堵塞,气道上皮细胞脱落,杯状细胞增多,黏膜下及管周有大量炎性细胞浸润等(图1)。

图1 各组小鼠的组织学染色×400(A:哮喘组;B:对照组)Figure 1 Histological staining of lung tissues of mice in each group.A: Asthma group; B: Control group.
2.3 肺组织 pGSK-3β、NF-κB 和mmP-9 的表达
蛋白质印迹结果表明,哮喘组 pGSK-3β、NF-κB 和mmP-9 的表达水平均高于对照组(P<0.05),pGSK-3β 和 NF-κB 的表达呈正相关,NF-κB和mmP-9 的表达呈正相关(图2 和表1)。

图2 蛋白质印迹法检测各组小鼠肺组织 pGSK-3β、NF-κB 和mmP-9 表达量Figure 2 The expression levels of pGSK-3β, NF-κB andmmP-9 in lung tissues of mice were assessed by Western blotting
表1 各组小鼠肺组织 pGSK-3β、NF-κB 和mmP-9 的灰度值(±s)Table 1 Gray value of pGSK-3β, NF-κB andmmP-9 in lung tissues of mice in each group
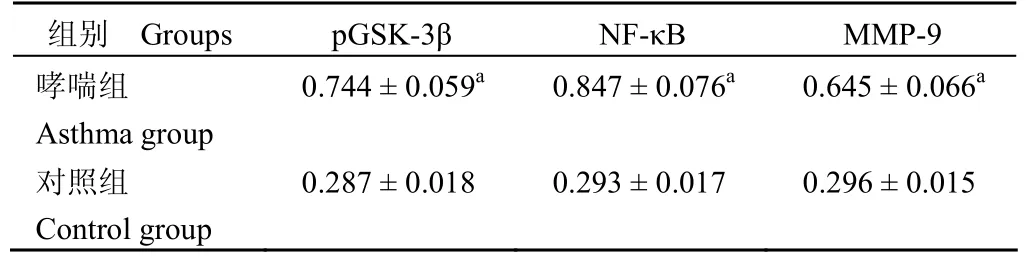
表1 各组小鼠肺组织 pGSK-3β、NF-κB 和mmP-9 的灰度值(±s)Table 1 Gray value of pGSK-3β, NF-κB andmmP-9 in lung tissues of mice in each group
注:a表示与对照组比较P<0.01Note: a RepresentP<0.01 by compared with the control group.
组别 Groups pGSK-3β NF-κB mmP-9哮喘组Asthma group 0.744±0.059a 0.847±0.076a 0.645±0.066a对照组Control group 0.287±0.018 0.293±0.017 0.296±0.015
3 讨论
本实验结果表明 OVA 致敏加反复雾化激发可以成功建立小鼠哮喘气道重塑模型类似于人类哮喘的气道炎症和气道重塑的病理改变,与国内外有关文献[7]报告相似。
GSK-3 最早是作为能够磷酸化并抑制糖原合成酶(Glycogen Synthase,GS)活性的蛋白激酶而被发现[9],GSK-3 具有 2 个紧密相关的亚型GSK-3α 和 GSK-3β,新近研究表明,GSK-3β 能磷酸化多种底物,包括代谢与信号蛋白、细胞结构蛋白和转录因子等,参与胚胎发育、细胞增殖、细胞分化、细胞凋亡和胰岛素反应等诸多方面。在受到外界刺激后,总的 GSK-3β 水平没有改变,GSK-3βN端丝氨酸残基(Ser9)磷酸化形成假底物覆盖活化位点而使该酶活性降低,从而改变其下游成分的活性或功能[10]。人类许多疾病如糖尿病、肿瘤、神经退行性疾病、炎症等都与 GSK-3β 活性调节异常有关,因此 GSK-3β 已经成为多种疾病治疗的潜在靶点。
气道重塑过程也是细胞外基质重塑的过程,上皮下纤维化形成及气道壁胶原的沉积增加是气道重塑的重要病理改变,在这一过程中细胞外MMP-9 表达异常起了重要作用[11]。
本实验结果表明,随着 pGSK-3β 增多,NF-κB活性升高,MMP-9 表达也增加,三者呈正相关。GSK-3β 磷酸化失活,NF-κB 和mmP-9 表达的异常升高参与了哮喘气道重塑的发生发展。GSK-3β参与并促进气道重塑可能是通过对 NF-κB 的作用来介导的,由于体内 NF-κB 调节机制复杂,关于GSK-3β 和 NF-κB 之间具体的作用机制目前尚不清楚,有待进一步研究。
[1]Warner SM, Knight DA.Airway modeling and remodeling in the pathogenesis of asthma.Curr Opin Allergy Clin Immunol, 2008, 8(1):44-48.
[2]Dugo L, Collin M, Thiemermann C.Glycogen synthase kinase 3beta as a target for the therapy of shock and inflammation.Shock, 2007,27(2):113-123.
[3]Wu CY, Hsieh HL, Jou MJ, et al.Involvement of p42/p44 MAPK, p38 MAPK, JNK and nuclear factor-kappa B in interleukin-1beta-induced matrix metalloproteinase-9 expression in rat brain astrocytes.J Neurochem, 2004, 90(6):1477-1488.
[4]Sugden PH, Fuller SJ, Weiss SC, et al.Glycogen synthase kinase3(GSK3) in the heart: a point of integration in hypertrophic signaling and a therapeutic target? A critical analysis.Br J Pharmacol, 2008, 153 Suppl 1:S137-S153.
[5]Deng H, Dokshin GA, Lei J, et al.Inhibition of glycogen synthase kinase-3beta is sufficient for airway smooth muscle hypertrophy.J Biol Chem, 2008, 283(15):10198-10207.
[6]Bentley JK, Deng H, Linn MJ, et al.Airway smooth muscle hyperplasia and hypertrophy correlate with glycogen synthase kinase-3(beta) phosphorylation in a mouse model of asthma.Am J Physiol Lung Cell Mol Physiol, 2009, 296(2):L176-L184.
[7]Temelkovski J, Hogan SP, Shepherd DP, et al.An improved murine model of asthma: selective airway inflammation, epithelial lesions and increased methacholine responsiveness following chronic exposure to aerosolised allergen.Thorax, 1998, 53(10):849-856.
[8]Crowder RJ, Freeman RS.Glycogen synthase kinase-3 beta activity is critical for neuronal death caused by inhibiting phosphatidylinositol 3-kinase or Akt but not for death caused by nerve growth factor withdrawal.J Biol Chem, 2000, 275(44):34266-34271.
[9]Cohen P, Yellowlees D, Aitken A, et al.Separation and characterisation of glycogen synthase kinase 3, glycogen synthase kinase 4 and glycogen synthase kinase 5 from rabbit skeletal muscle.Eur J Biochem, 1982, 124(1):21-35.
[10]Frame S, Cohen P.GSK3 takes centre stage more than 20 years after its discovery.Biochem J, 2001, 359(Pt 1):1-16.
[11]Greenlee KJ, Werb Z, Kheradmand F.Matrix metalloproteinases in lung: multiple, multifarious, and multifaceted.Physiol Rev, 2007,87(1):69-98.

