使用优化PAGE电泳及银染技术检测临床粪便样品中的轮状病毒RNA
杨昭庆,黄永坤,刘馨
人轮状病毒肠炎是世界范围内的一个重要的健康问题,也是引起儿童腹泻并导致死亡的主要原因之一[1]。快速有效地分离、鉴定临床粪便样中的轮状病毒,不仅可以确证轮状病毒的感染,还可以准确监控轮状病毒流行株的变化,积累轮状病毒的流行病学数据。轮状病毒的基因组为双链RNA,分为 11 个节段,不同株型轮状病毒的 RNA 电泳图谱存在差异,可由此初步判定轮状病毒株型别[2]。本文以猴轮状病毒 SA11 株的 RNA 基因组作为模版,对 PAGE电泳和银染的检测条件进行优化,并使用优化后的条件对临床粪便样品进行检测。
1 材料与方法
1.1 主要材料和仪器
猴轮状病毒 SA11 株为本所保存;12 份临床样品来自云南昆明医学院附属第一医院,为儿科急性腹泻小儿粪便样本,收集的时间为 2009 年 11 月,随机编号 1~12 号;A 群轮状病毒胶体金诊断试纸购自北京万泰生物药业有限公司;小量液体样品 RNA 抽提试剂盒购自上海华舜生物技术有限公司;小型垂直电泳槽购自 Bio-Rad 公司。
1.2 方法
在不改变电泳设备的前提下,以猴轮状病毒 SA11 株为模版,对其 RAN 基因组的电泳条件进行了比较和优化,包括不同丙烯酰胺和N,N’-甲叉丙烯酰胺配比、分离胶、积层胶浓度、电压、电泳时间,银染的染色和显色时间。并以优化后条件对细胞培养的不同代次的轮状病毒 RNA 基因组进行检测和重复实验,确定其稳定性。
PAGE 电泳的缓冲液为 TBE,电泳结束后,使用 10%无水乙醇和0.5% 的冰乙酸洗涤凝胶 2 次,每次 5 min,然后使用 0.2% 的硝酸银溶液染色,显色液为 NaOH 和甲醛溶液。
使用 A 群轮状病毒胶体金诊断试纸对腹泻样品进行快速检测(具体方法参照该产品说明书),将阳性样品用20 mmol,pH 7.4 的 PBS 制成 10% 悬液,于 3724 × g 条件下,离心 30 min。上清用 0.2 µm 滤膜过滤后,取 250 µl滤液用 RNA 抽提试剂盒提取病毒 RNA,取 10 µl RNA 抽提物,然后进行 PAGE 电泳和银染检测。
2 结果
对 PAGE 电泳的条件优化如下:采用的聚丙烯酰胺凝胶选用了不同的丙烯酰胺和N,N’-甲叉丙烯酰胺配比,分别为 37.5∶1、29∶1、20∶1 和7.25∶1,分离胶浓度从 5%~20%,电泳时间从 3~15 h,电压从 60~120 V(表 1)。结果发现,采用丙烯酰胺和N,N’-甲叉丙烯酰胺配比为29∶1 的凝胶,3.5% 基层胶,10% 分离胶,以 60 V 电泳6 h,轮状病毒 RNA 基因组的 11 个节段可获得较好的分离。其次我们对银染的条件进行了优化,比较了染色时间和显色时间的长短对同一样品染色效果的影响,结果发现,使用新鲜配制的硝酸银溶液,染色 2 min 即可,延长时间对实验的结果没有影响,显色时间控制在 5 min 以内,可以有效地降低背景染色,提高对比度。重复实验的结果表明,该方法用于检测体外培养的不同代次的轮状病毒 RNA 基因组,结果稳定[3]。
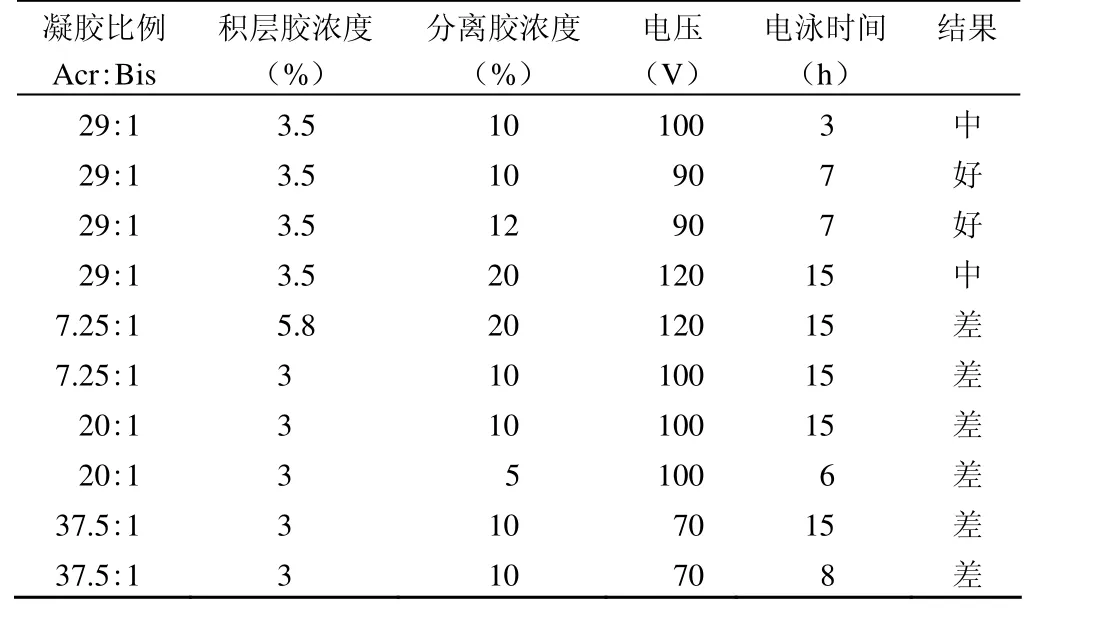
表1 不同凝胶浓度、电泳时间及电压对分离效果的影响
利用上述条件对临床粪便样品中的轮状病毒 RNA 基因组进行检测,结果发现,1 号和4 号样品的 RNA 浓度较低,但是仍能看到轮状病毒的特异基因组带型,1 号和6 号的电泳背景较深,可能与粪便样品的成分有关,5 号样品的带型与 Wa 株相似,6 号和7 号的型别还有待于进一步的鉴定。
用 A 群轮状病毒胶体金试纸检测发现,12 份粪便样品中有 5份样品为抗原阳性,分别为 1、4、5、6、7 号样品。我们采用上述优化后的方法,对这 5 个样品抽提的RNA 进行检测(图 1)。
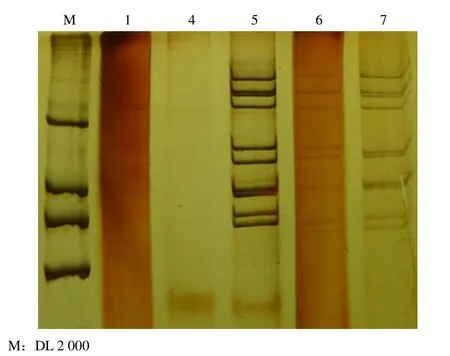
图1 临床粪便样品 1、4、5、6、7 号中轮状病毒 RNA 基因组的电泳图谱
3 讨论
轮状病毒的双链 RNA 基因组在凝胶电泳时分为 11个节段,7、8、9 三个条带的分子量较为相近:第 7 条 RNA与第 8 条 RNA 的大小相差 45 bp;而第 8 条 RNA 与第9 条 RNA 仅相差 3 bp,使用本文所述电泳设备,其制胶长度为 5 cm,这 3 个条带没有得到有效地分离,选用较长的凝胶可以解决这个问题,但是因为这 3 条带的电泳图谱在轮状病毒株型之间差异不明显[4],因此目前的结果已经满足实验样品的检测需要。
聚丙烯酰胺凝胶电泳和银染的方法(PAGE-SS)作为检测轮状病毒 RNA 基因组的方法被广泛使用[5],但是实验设备、实验条件的差异影响电泳结果,使得实验不仅耗时长,而且结果不具有可比性。我们在前期实验的基础上,比较了凝胶浓度、电泳时间、电压、银染的染色和显色时间等参数对 PAGE 结果的影响,优化得到了一个稳定快速的轮状病毒 RNA 基因组 PAGE-SS 检测方法。
[1]Madhi SA, Cunliffe NA, Steele D, et al.Effect of human rotavirus vaccine on severe diarrhea in African infants.N Engl J Med, 2010,362(4):289-298.
[2]Herring AJ, Inglis NF, Ojeh CK, et al.Rapid diagnosis of rotavirus infection by direct detection of viral nucleic acid in silver-stained polyacrylamide gels.J Clin Microbiol, 1982, 16(3):473-477.
[3]Zhang GM, Zhang YX, Liu X, et al.Adaptability of rotavirus P[2]G3 strain in Vero cells.Chin J Biologicals, 2008, 21(12):1078-1079.(in Chinese)张光明, 张永欣, 刘馨, 等.轮状病毒P[2]G3株在Vero细胞上的传代适应性.中国生物制品学杂志, 2008, 21(12):1078-1079.
[4]Estes MK, Cohen J.Rotavirus gene structure and function.Microbiol Rev, 1989, 53(4):410-449.
[5]Giordano MO, Martinez LC, Depetris AR, et al.Rapid vertical agarose: silver stain detection of rotavirus.Viral Immunol, 1997, 10(1):59-64.

