角质细胞生长因子对1C6细胞和4C18细胞的促增殖作用
张卫星,刘彦隆,于洋,龚琦,李校堃,林绍强
角质细胞生长因子(keratinocyte growth factor,KGF)又称成纤维细胞生长因子 7,属于成纤维细胞生长因子家族,是从人胚胎肺成纤维细胞培养上清中分离纯化获得的一种相对分子质量为26 000~28 000 的单链多肽,这种细胞因子具有促进小鼠角质细胞有丝分裂的作用,因此被命名为角质细胞生长因子。随后的一系列研究证明这种细胞因子的靶细胞为上皮细胞,分泌细胞为各种来源的间质细胞,其作用是促进上皮细胞的增殖和生长。近年来的研究表明,KGF 具有广泛的生物学活性,能促进多种细胞中 DNA 的合成,与多种组织、器官的形成和发育有关,在胃肠[1]、口腔黏膜[2]、胸腺[3]、肺[4]等多种器官的损伤修复中发挥重要作用。在胚胎胸腺器官培养实验中,KGF 可诱导胸腺上皮祖细胞和成熟胸腺上皮细胞增殖[5];胚胎期 KGF 受体缺失小鼠由于胸腺上皮细胞缺乏增殖和分化能力而表现出明显的胸腺生成障碍[6]。最近有报道称,KGF 可以明显促进老龄鼠萎缩胸腺的增生[7],同时KGF 也可以促进正常小鼠胸腺和接受骨髓移植后小鼠胸腺的增生[3]。研究表明 KGF 主要通过与胸腺上皮细胞表面的 KGF 受体结合而促进胸腺上皮细胞增殖,最终导致胸腺增生。但由于胸腺上皮细胞较难分离及其在体外存活时间较短,因此KGF 促胸腺上皮细胞增殖的分子机制以及信号途径尚不清楚。1C6 细胞和 4C18 细胞分别是鼠胸腺上皮髓质和皮质来源的细胞系,在此我们拟利用体外细胞培养方法观察 KGF 对 1C6 细胞和 4C18细胞的促增殖作用,为探求 KGF 促胸腺增殖的分子机制提供参考。
1 材料与方法
1.1 材料
1.1.1 细胞系 鼠胸腺上皮髓质来源的 1C6 细胞、皮质来源的 4C18 细胞和鼠腹腔巨噬细胞来源的 RAW 细胞均由中国科学院动物研究所提供。
1.1.2 试剂 KGF 由吉林农业大学提供;DMEM培养基购自美国 Gibco 公司;噻唑蓝(MTT)购自北京赛百盛生物工程公司;二甲基亚砜(DMSO)和牛血清白蛋白(BSA)购自美国 Sigma 公司;10%胎牛血清购自杭州四季青生物工程材料有限公司。
1.2 方法
1.2.1 体外细胞培养 将 1C6 细胞、4C18 细胞和 RAW 细胞分别置于 DMEM 培养液(含 10%胎牛血清、100 U/ml 青霉素、100 U/ml 链霉素)中,在 37℃、5%CO2、饱和湿度的孵箱中培养,2~3 d 传代 1 次。
1.2.2 细胞增殖活性测定 采用 MTT 法测定细胞增殖活性。实验分 KGF 处理组和对照组,每组各设 4 个复孔。分别将 1C6 细胞、4C18 细胞和RAW 细胞以 4×103/孔的密度接种于 96 孔板,待细胞贴壁后,KGF 处理组分别加入含 25、50、100、200、400、800 ng/ml KGF 的完全培养液 200 μl,对照组加入不含 KGF 的完全培养液 200 μl;同时以加入 200 μl 完全培养液作为空白孔。各组细胞经不同处理后分别继续培养 24、48 和 72 h,培养结束后每孔加入 20 μl MTT(5 mg/ml)继续培养4 h。吸弃培养上清液,每孔加入 200 μl DMSO,振荡 10min,使蓝紫色结晶充分溶解,在酶标仪上测定各孔波长 492 nm处吸光度(A)值。按下列公式计算细胞增殖率:细胞增殖率(%)=(实验孔平均A值 - 对照孔平均A值)/对照孔平均A值×100%,并绘制细胞增殖率曲线。
1.3 统计学处理
应用 SPSS13.0 统计学软件进行数据处理,实验组与对照组检测结果的比较采用 Student’st检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 KGF 对 1C6 细胞的促增殖作用
不同浓度(25、50、100、200、400、800 ng/ml)的 KGF 分别作用 1C6 细胞 24 h(图1A)、48 h(图1B)和 72 h(图1C),MTT 法测定A492值并绘制细胞增殖率曲线,结果显示在低浓度(<200 ng/ml)时,细胞增殖率随 KGF 浓度的增加不断升高;当 KGF 浓度为200 ng/ml 时,细胞增殖率达到最高值;而在高浓度(> 200 ng/ml)时,细胞增殖率随 KGF 浓度的增加又逐渐下降。

图1 不同浓度(25、50、100、200、400、800 ng/ml)KGF 作用不同时间对 1C6 细胞的促增殖作用(A:不同浓度 KGF 作用 1C6细胞 24 h;B:不同浓度 KGF 作用 1C6 细胞 48 h;C:不同浓度KGF 作用 1C6 细胞 72 h)Figure 1 Proliferative effect on 1C6 cells affected by different concentrations of KGF (25, 50, 100,200, 400, 800 ng/ml) for different time.A: 1C6 cells were affected by different concentrations of KGF for 24 h; B: 1C6 cells were affected by different concentrations of KGF for 48 h; C: 1C6 cells were affected by different concentrations of KGF for 72 h.
与对照组比较,浓度为100、200、400 ng/ml 的KGF 分别作用 24、48 和 72 h 对 1C6 细胞均具有明显的促增殖作用(均P<0.05)。
2.2 KGF 对 4C18 细胞的促增殖作用
不同浓度(25、50、100、200、400、800 ng/ml)的 KGF 分别作用 4C18 细胞 24 h(图2A)、48 h(图2B)和 72 h(图2C),MTT 法测定A492值并绘制细胞增殖率曲线,结果显示在低浓度(<100 ng/ml)时,细胞增殖率随 KGF 浓度的增加不断升高;当 KGF 浓度为100 ng/ml 时,细胞增殖率达到最高值;而在高浓度(> 100 ng/ml)时,细胞增殖率随 KGF 浓度的增加又逐渐下降。
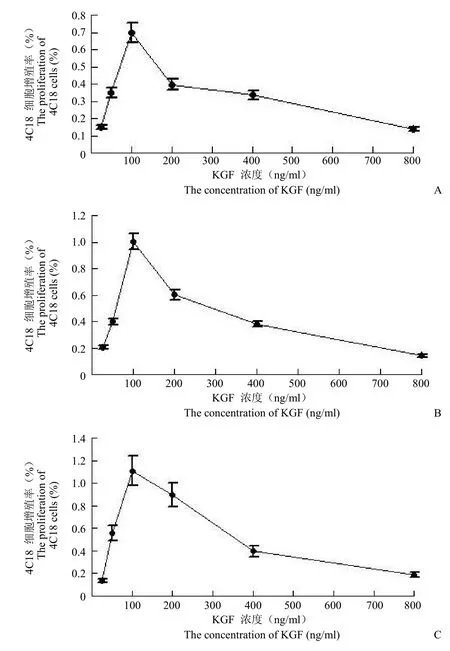
图2 不同浓度(25、50、100、200、400、800 ng/ml)KGF 作用不同时间对 4C18 细胞的促增殖作用(A:不同浓度 KGF 作用 4C18 细胞 24 h;B:不同浓度 KGF 作用 4C18 细胞 48 h;C:不同浓度 KGF 作用 4C18 细胞72 h)Figure 2 Proliferative effect on 4C18 cells affected by different concentrations of KGF (25, 50, 100, 200, 400, 800 ng/ml)for different time.A: 4C18 cells were affected by different concentrations of KGF for 24 h; B: 4C18 cells were affected by different concentrations of KGF for 48 h; C: 4C18 cells were affected by different concentrations of KGF for 72 h.
与对照组比较,浓度为50、100、200、400 ng/ml的 KGF 分别作用 24、48 和 72 h 对 4C18 细胞均具有明显的促增殖作用(均P<0.05)。
2.3 KGF 对 RAW 细胞的促增殖作用
不同浓度(25、50、100、200、400、800 ng/ml)的 KGF 分别作用 RAW 细胞 24、48 和 72 h,MTT 法测定A492值并绘制细胞增殖率曲线,结果显示 KGF 对 RAW 细胞均无明显促增殖作用。
3 讨论
KGF 作为一种有丝分裂原能特异性地促进上皮细胞的增殖和分化[8],本实验结果证明 KGF 对胸腺上皮髓质和皮质来源的 1C6 细胞和 4C18 细胞均具有明显的促增殖作用。有研究报道,KGF 主要通过与胸腺上皮细胞表面 KGF 受体的结合而促进老龄鼠萎缩胸腺以及理化因素所致小鼠萎缩胸腺的增生[7,9]。胸腺上皮构成了胸腺细胞赖以生存的微环境,是 T 细胞发育和成熟的主要场所,为骨髓来源的胸腺前体细胞提供了足够的生存空间,因此胸腺上皮细胞的增生,扩大了 T 细胞的生存环境,促进胸腺细胞生成增加,导致胸腺的增生[10]。但是由于胸腺上皮细胞分离技术尚未成熟及其体外生存时间很短,所以至今为止 KGF 与KGF 受体信号途径对胸腺促增殖作用的具体机制,以及该途径中上游或下游的作用因子尚未阐明。本实验结果表明 KGF 对胸腺上皮髓质和皮质来源的 1C6 细胞和 4C18 细胞均具有明显的促增殖作用,但是对腹腔巨噬细胞来源的 RAW 细胞无促增殖作用,表明 KGF 可特异性对 1C6 和 4C18细胞发挥促增殖作用。这将为下一步探讨 KGF 促进胸腺增生的分子机制和信号途径提供可能性。
[1]Johansson JE, Hasséus B, Johansson P, et al.Gut protection by palifermin during autologous haematopoietic SCT.Bone Marrow Transplant, 2009, 43(10):807-811.
[2]Beaven AW, Shea TC.Recombinant human keratinocyte growth factor palifermin reduces oral mucositis and improves patient outcomes after stem cell transplant.Drugs Today (Barc), 2007, 43(7):461-473.
[3]Rossi SW, Jeker LT, Ueno T, et al.Keratinocyte growth factor (KGF)enhances postnatal T-cell development via enhancements in proliferation and function of thymic epithelial cells.Blood, 2007,109(9):3803-3811.
[4]Sadovski J, Kuchenbuch T, Ruppert C, et al.Keratinocyte growth factor prevents intra-alveolar oedema in experimental lung isografts.Eur Respir J, 2008, 31(1):21-28.
[5]Berzins SP, Uldrich AP, Sutherland JS, et al.Thymic regeneration:teaching an old immune system new tricks.Trends Mol Med, 2002,8(10):469-476.
[6]Revest JM, Suniara RK, Kerr K, et al.Development of the thymus requires signaling through the fibroblast growth factor receptor R2-IIIb.J Immunol, 2001, 167(4):1954-1961.
[7]Min D, Panoskaltsis-Mortari A, Kuro-O M, et al.Sustained thymopoiesis and improvement in functional immunity induced by exogenous KGF administration in murine models of aging.Blood,2007, 109(6):2529-2537.
[8]Loprinzi CL, Martenson JA.Martenson, Keratinocyte growth factor:not yet ready for prime time.J Clin Oncol, 2003, 21(8):1429-1430.
[9]Alpdogan O, Hubbard VM, Smith OM, et al.Keratinocyte growth factor (KGF) is required for postnatal thymic regeneration.Blood,2006, 107(6):2453-2460.
[10]Zhang L, Sun L, Zhao Y.Thymic epithelial progenitor cells and thymus regeneration: an update.Cell Res, 2007, 17(1):50-55.

