牛蒡子中牛蒡苷和牛蒡苷元的超声提取工艺研究
武娟霞, 王志祥, 余祥英, 信秀灵, 杜起光
(中国药科大学制药工程教研室,江苏南京 210009)
牛蒡子(Fructus arctii)为牛蒡(Arctium lappaL.)的干燥成熟果实,而牛蒡苷(Arctiin、ARC)、牛蒡苷元(Arctigenin、ARC-G)是牛蒡子的主要有效成分[1],具有抗菌、抗肿瘤、降血糖、抑制血小板以及抗衰老等方面的作用[2]。
文献报道的牛蒡苷和牛蒡苷元的提取方法主要包括传统的提取方法[3]以及超临界萃取法[4]。但传统提取方法的提取时间一般较长,提取效率低;而超临界萃取法须将极性较大的牛蒡苷水解为极性较小的牛蒡苷元才能提取的较为完全,提取步骤比较繁琐。而超声波作为一种新型的提取技术,具有简单、高效、低成本、高收率等特点。本文对超声波提取牛蒡子中牛蒡苷和牛蒡苷元的工艺进行了研究,着重考察了超声功率、药材粒径、液固比、提取时间、提取温度以及占空比等因素对牛蒡苷及牛蒡苷元提取率的影响,并通过正交试验设计优化了工艺条件。
1 仪器和材料
1.1 仪器
超声波提取设备(北京弘祥隆超声波提取设备有限公司),岛津LC-10ATvp高效液相色谱仪(日本岛津公司),JY1002型电子天平(上海精密科学仪器有限公司天平仪器厂),FW100高速万能粉碎机(天津市泰斯特仪器有限公司),SHZ-D(Ⅲ)循环水式真空泵(巩义市英峪予华仪器厂)。
1.2 材料
药材牛蒡子(购自安徽省亳州市华申药业有限公司),牛蒡苷标准品(批号110819-200606,中国药品生物制品检定所),牛蒡苷元标准品(批号081026,上海融禾医药科技发展有限公司),乙醇(工业级,南京化学试剂有限公司),甲醇(色谱纯,南京化学试剂有限公司),纯净水(乐百氏(无锡)食品材料有限公司),去离子水(实验室自制)。
2 方法与结果
2.1 分析方法
将牛蒡子进行粉碎,分别经过10目、20目、40目、60目、80目、100目及120目筛,各取等量混匀备用。称取牛蒡子粉末至超声提取器的反应杯中,加入50%乙醇溶液后,超声提取,过滤得上清液,用移液枪精密量取提取液200 μL,置于5 mL量瓶中,用流动相定容,经0.22 μm的微孔滤膜过滤后进样到高效液相色谱仪,记录色谱图。结果见图1。
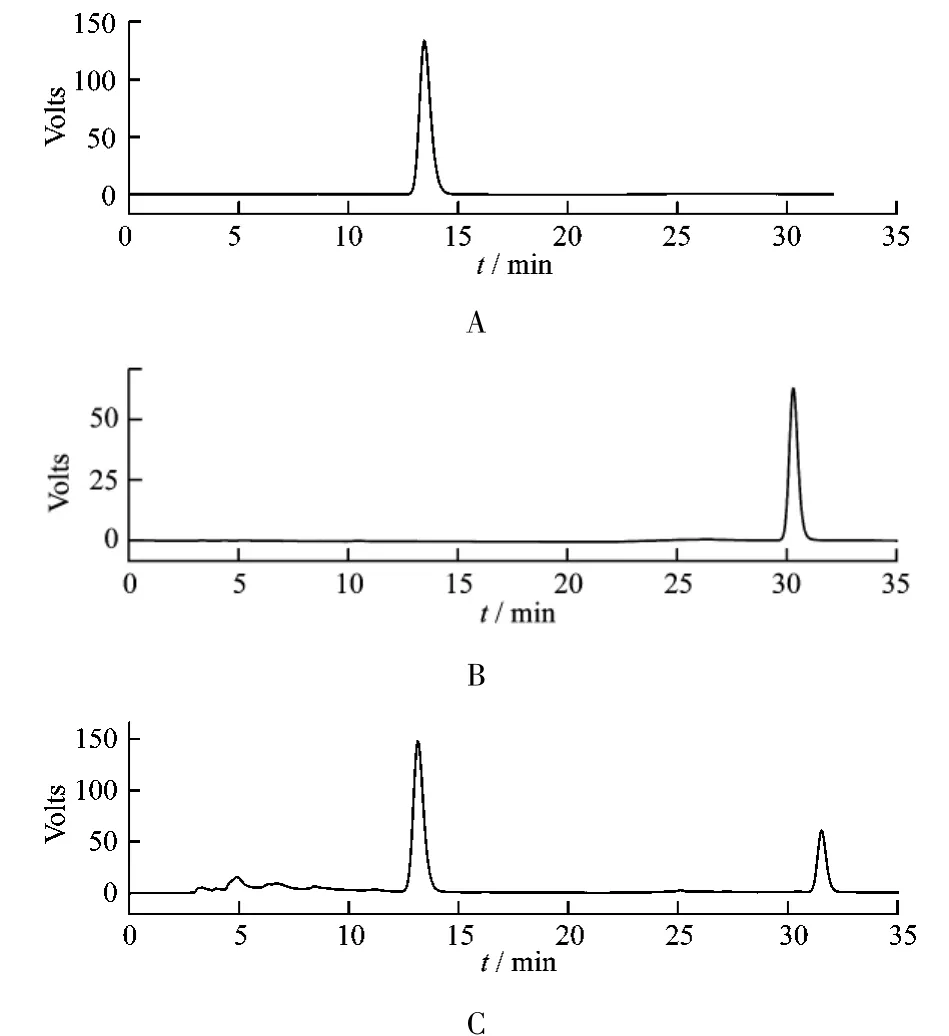
图1 牛蒡苷、牛蒡苷元色谱图
色谱条件为:VP-ODS色谱柱(4.6 mm×250 mm,5 μm),流动相为甲醇-水,流速为 0.6 mL/min,检测波长280 nm,柱温为25℃。
采用梯度洗脱,具体流动相组成如表1所示。
2.2 标准曲线的绘制
精密称取牛蒡苷标准品8.06 mg,牛蒡苷元标准品2.40 mg,分别用甲醇溶解后用流动相定容于10 mL量瓶中,摇匀。经0.22 μm的微孔滤膜过滤后分别取样进样,记录色谱图。
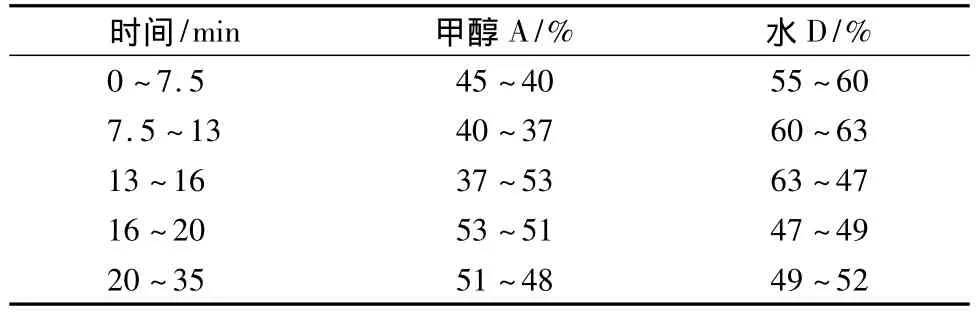
表1 梯度洗脱流动相组成
以峰面积分值/1 000为纵坐标(Y),样品浓度(mg/mL)为横坐标(X)绘制标准曲线。结果表明,牛蒡苷及牛蒡苷元分别在40.31~806.2 μg/mL、15.00~240.00 μg/mL范围内呈良好线性关系。通过线性回归得回归方程分别为:牛蒡苷:Y=-89.200 35+17.803 5X;牛蒡苷元:Y=68.196 99+27.859 1X。
2.3 重复性试验
精密称取同一批号牛蒡子颗粒5份,按供试品溶液制备法制备,并按以上色谱条件测试,RSDARC为4.47% ,RSDARC-G为 5.10%(n=5)。
2.4 单因素对牛蒡苷和牛蒡苷元提取率的影响
2.4.1 提取温度的影响
以10~120目混合粒径的牛蒡子药材为原料,以50%乙醇为溶剂,在超声功率为400 W,占空比为2∶3,液固比为10 mL/g,提取时间为20 min的条件下,选择不同的提取温度进行试验。其结果如图2所示,随着温度的升高,牛蒡苷和牛蒡苷元的收率均逐渐增大,当温度达到50℃后,收率均随温度的升高而逐渐降低。这是由于温度升高促进有效成分的扩散,但由于牛蒡苷和牛蒡苷元对热不太稳定,温度太高反而会使收率降低。此外温度过高时还会使杂质的溶出增多,增加分离难度。可见牛蒡苷和牛蒡苷元的适宜提取温度均为50℃。见图2。

图2 温度对牛蒡苷和牛蒡苷元提取率的影响
2.4.2 占空比的影响
占空比的概念最初是在电学领域提出的,表示在一段连续工作时间内脉冲(高电平)占用的时间与总时间的比值。近几年来,超声波技术也引入这一概念用来表示在间歇式的超声作用时,超声作用时间与总时间周期的比值。
以10~120目混合粒径的牛蒡子药材为原料,以50%乙醇为溶剂,在超声功率为400 W,液固比为10 mL/g,提取温度为50℃,提取时间为20 min的条件下,选择不同的占空比进行试验。其结果如图3所示,连续超声作用时,牛蒡苷的提取率为5.47%,牛蒡苷元提取率为1.14%,均低于间歇式超声作用。可见,占空比对超声提取牛蒡苷和牛蒡苷元影响显著,但其影响变化规律不显著。其作用机制还有待于今后进一步研究。见图3。

图3 占空比对牛蒡苷和牛蒡苷元提取率的影响
2.4.3 液固比的影响
以10~120目混合粒径的牛蒡子药材为原料,以50%乙醇为溶剂,在超声功率为400 W,占空比为2∶3,提取温度为50℃,提取时间为20 min的条件下,选择不同的液固比进行试验。其结果如图4所示,逐渐增大液固比,牛蒡苷和牛蒡苷元的提取率也随之增大,这是由于液固比的增大使溶液中浓度梯度增大,有利于物质的溶出和扩散。但在液固比达到14 mL/g之后,增大的趋势逐渐趋于平缓,这说明此时提取已经充分,再增大液固比对提高提取率的作用已经不大。见图4。

图4 液固比对牛蒡苷和牛蒡苷元提取率的影响
2.4.4 药材粒径的影响
以50%乙醇为溶剂,在超声功率为400 W,占空比为2∶3,液固比为10 mL/g,提取温度为50℃,提取时间为20 min的条件下,选择不同粒径的牛蒡子药材为原料进行试验。其结果如图5所示,药材粒径对牛蒡苷和牛蒡苷元的提取率都有十分显著的影响,两者的提取率均随粒径的减小而增大,这是由于药材粒度减小,传质表面积增大,对物质的溶出有促进作用。当粒径达到80~100目时,提取率达到最大;之后随粒径的减小而降低,这是由于当药材粒径过小的时候,药材细胞已经被破坏,超声波的空化效应对其作用不明显,并且由于颗粒过小吸附作用增强,所以提取率又有所降低。见图5。

图5 药材粒径对牛蒡苷和牛蒡苷元提取率的影响
2.4.5 提取时间的影响
以10~120目混合粒径的牛蒡子药材为原料,以50%乙醇为溶剂,在超声功率为400 W,占空比为2∶3,液固比为10 mL/g,提取温度50℃的条件下,选择不同提取时间进行试验。其结果如图6所示,提取时间达到20 min后牛蒡苷基本提取完全,牛蒡苷元在30 min左右提取完全。由于超声波具有较强的热效应,提取时间越长,体系温度就越不稳定,并且可能会导致一些热敏性物质的破坏,同时能耗等经济成本也会增大。所以提取时间以20 min为宜。见图6。

图6 提取时间对牛蒡苷和牛蒡苷元提取率的影响
2.4.6 超声功率的影响
见图7。以10~120目混合粒径的牛蒡子药材为原料,以50%乙醇为溶剂,占空比为2∶3,液固比为10 mL/g,提取温度50℃,提取时间为20 min的条件下,选择不同超声功率进行试验。其结果如图7所示,牛蒡苷和牛蒡苷元的提取率随超声功率的增大而增大。这是由于超声波功率增大,其空化效应、机械效应以及热效应等均随之增大,促进了有效物质的溶出。但提取率随超声波功率的增大而提高的程度并不十分明显,且过高的超声功率也不利于仪器的保护和节能。在本实验条件下,超声功率以600 W为宜。
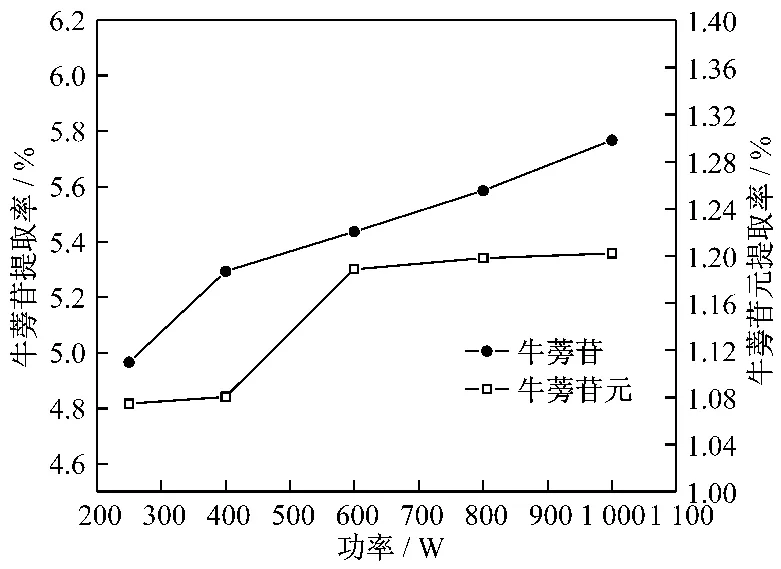
图7 超声功率对牛蒡苷和牛蒡苷元提取率的影响
2.5 正交设计
在前期单因素实验结果的基础上,通过正交试验设计优化超声波提取牛蒡苷及牛蒡苷元的工艺。以50%乙醇为溶剂,占空比为2∶3,选取提取时间,提取温度,超声功率,液固比,药材粒径作为考察因素,进行五因素四水平正交试验。因素水平表如表2所示。

表2 因素水平表
按照L16(45)试验安排分别进行试验,试验结果如表3所示,极差分析如表4所示。

表3 L16(45)正交实验设计及结果
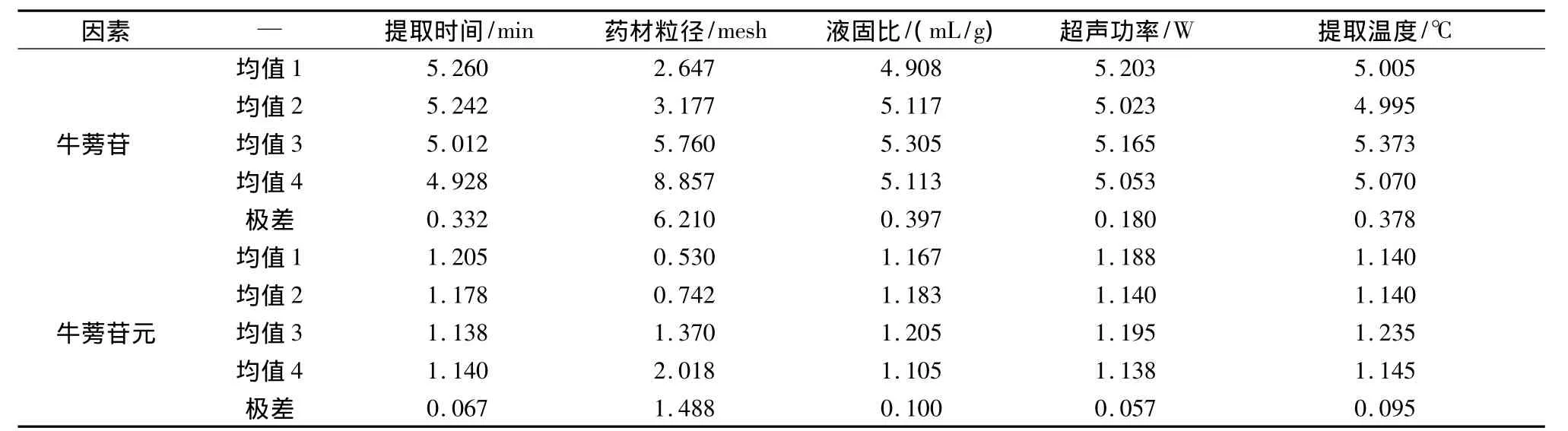
表4极差分析表
将实验结果进行分析,极差分析,方差分析结果如表5所示。

表5 方差分析表
从分析结果可以看出,各因素对牛蒡苷和牛蒡苷元提取率的影响程度分别依次为B>E>A>C>D和B>E>C>A>D,即药材粒径对牛蒡苷和牛蒡苷元的提取均有十分显著的影响,提取温度的影响较小,提取时间,液固比以及超声功率的影响都不显著。牛蒡苷和牛蒡苷元提取的最佳因素水平组合分别为A1B4C3D1E3和A1B4C3D3E3。由于超声功率的影响很小,出于对仪器的保护和节约能量的考虑,综合考虑两个物质的提取条件,选取400 W为最适合功率。所以得到最优提取条件如下:提取时间10 min,提取温度50℃,液固比为14 mL/g,药材粒径为80~100目,超声功率为400 W。
2.6 验证试验
根据上述最优条件进行验证试验,得到牛蒡苷的提取率为9.24%,牛蒡苷元的提取率是2.03%。均为试验范围内的最高值,说明正交试验结果是可信的。
根据王晓琳[3]等所得的回流提取最优条件:70%乙醇,10倍溶剂量,回流60 min,提取三次,牛蒡苷提取率为5.24%,牛蒡苷元提取率为1.09%。由此可见超声提取率远高于回流提取。
3 讨论
超声波提取法作为一种天然产物活性成分分离提取的新技术、新方法,具有方便,高效的特点和较高的实用价值,值得认真探索研究。本文通过试验,分别考察了提取温度,液固比,超声波功率,提取时间,占空比以及药材粒径对牛蒡苷及牛蒡苷元提取率的影响。并在此基础上通过正交设计优化了提取工艺,得到最优提取条件为:药材粒径80~100目,提取温度50℃,液固比14 mL/g,超声功率400 W,提取时间10 min。利用此最优条件得到牛蒡苷提取率为9.24%,牛蒡苷元提取率为2.03%,均高于热回流提取率。
[1]王 劲,侯凤飞,康廷国,等.牛蒡苷的制备与纯化[J].中草药,2002,33(9):783.
[2]鞠玫君,窦德强,康廷国.牛蒡子提取物中牛蒡苷和牛蒡苷元的含量测定研究[J].中国现代中药,2008,10(2):14-16.
[3]王小琳,张玉杰,石任兵.正交实验设计优选牛蒡子的提取工艺[J]. 北京中医药大学学报,2003,26(4):64-65.
[4]董文洪,刘 本.超临界流体萃取牛蒡子中牛蒡子苷的实验研究[J]. 中国中药杂志,2006,31(15):1240-1241.

