慢性吗啡成瘾小鼠海马中RACK1对CREB表达水平的影响*
谢一舟 万莉红 苏岚 汪宇辉 刘延友 朱雨 王正荣△
(1.四川大学时间生物学卫生部重点实验室;2.四川大学华西基础与法医学院药理教研室,四川 成都 610041)
药物成瘾是脑内相关核团和细胞在药物反复作用下发生适应性变化的时间依赖过程。药物成瘾过程与学习记忆过程可能存在相同的神经生物学基础。行为学实验表明二者作用于相同的脑区,学习记忆过程中起关键作用的相关脑区(例如,海马)参与成瘾药物的强化效应,最终通过cAM P反应元件结合蛋白(CREB,cAMP-response element binding protein)调控相应的靶基因改变细胞的可塑性[1]。CREB是目前研究最多的与成瘾记忆密切相关的分子机制之一[2],大多数成瘾药物都可以通过直接或间接途径增加多巴胺的释放,然后通过作用于D1受体增加cAM P的释放从而活化PKA,使CREB磷酸化调控靶基因的转录,调节成瘾药物的行为效应[3]。
本实验我们试图通过对与研究学习记忆密切相关的脑区海马中CREB的mRNA以及蛋白表达与RACK 1 mRNA以及蛋白表达的关系,探求干扰RACK 1对慢性吗啡成瘾小鼠可能的治疗作用。
1 材料与方法
1.1 材料
1.1.1 动物
雄性ICR小鼠,4~6W,60只。控制饲养及实验环境条件(温度:22℃、湿度:55%、光照循环12:12),自由进食进水。
1.1.2 试剂
shRACK1和空质粒由本实验室汪宇辉博士合成,盐酸吗啡(四川医药总公司),Trizol(上海英俊生物技术有限公司),RT-PCR试剂盒(大连宝生物工程有限公司),引物序列由上海英俊生物技术有限公司合成,序列见表1。

表1 引物序列
1.2.1 慢性吗啡成瘾小鼠模型建立
实验前小鼠自由活动3d,确定小鼠的天然偏爱,并测定其CPP值。 第4d开始,以 2d为一周期,第 1d,10:00注射吗啡(MIC MIR,10mg◦kg-1)或者生理盐水(CONC),并将小鼠置于白侧适应0.5h。次日10:00均注射生理盐水,并将小鼠置于黑侧0.5h,每天 16:00分别注射 shRACK1(M IR)和空质粒(MIC,CONC)。持续8d,重复4周期后,进行CPP测试。
1.2.2 RT-PCR检测RACK 1、CREB mRNA的表达
处死小鼠,快速取脑组织,冰上分离海马组织,Trizol法提取组织总 RNA,分光光度计鉴定总 RNA。采用半定量RTPCR特异性扩增RACK 1和CREB mRNA,分析其表达水平。
1.2.3 免疫组化检测RACK1、CREB蛋白的表达
用4%的甲醛溶液将海马组织标本固定48h,等级脱水后石蜡包埋,切片。石蜡切片常规脱蜡,3%H202室温孵育15min,以阻断内源性过氧化物酶,热抗原修复10min,室温冷却30min。10%正常山羊血清封闭15min,滴加1:100稀释的一抗RACK1和BDNF,4℃过夜,生物素化二抗 37℃孵育 15min,滴加辣根酶标记链酶卵白素工作液,37℃孵育15min,DAB显色剂显色5min,苏木素复染,封片。采用盲法请有经验的病理科医生对切片进行观察并作半定量分析,以胞浆内出现棕黄色颗粒为阳性细胞,每张切片在×400下随机取10个视野,根据细胞染色的深浅和视野中显色细胞所占的比例评分,两项评分的乘积作为积分数。
1.3 统计分析方法
2 结果
2.1 shRACK1对小鼠CPP的影响
给药前各组在白箱停留时间差别均无统计学意义(p>0.05)。建立模型后,B:空质粒+吗啡组(MIC)与A:空质粒+生理盐水组(CONC)相比,小鼠在白箱内停留时间明显增加(见图1,*p<0.05);C:RACK1干扰质粒+吗啡组(MIR)与空质粒+吗啡组(MIC)相比,小鼠在白箱内停留时间明显减少(见图1,#p<0.05)。
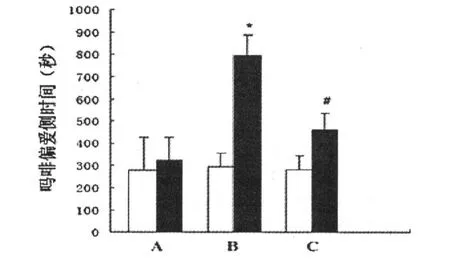
图1 各组小鼠条件性位置偏爱测试
2.2 shRACK1对小鼠海马RACK 1和CREB mRNA表达的影响
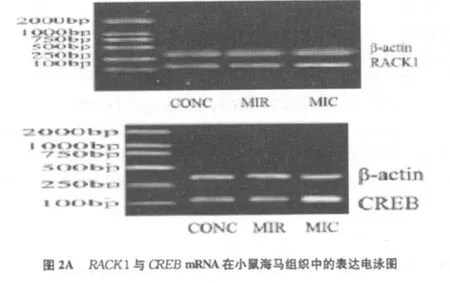
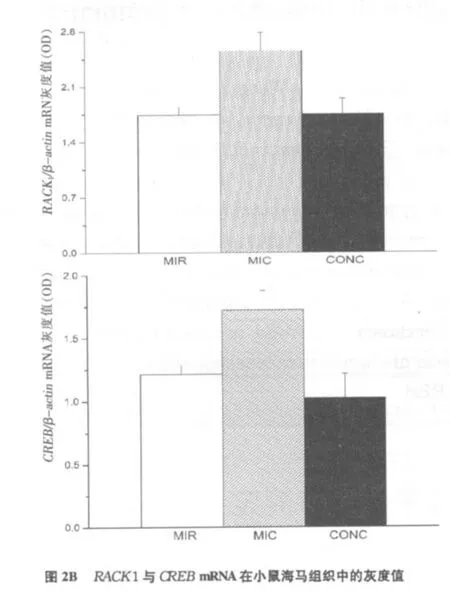
空质粒+吗啡组(MIC)海马中RACK 1和CREB mRNA的表达增高;而shRACK1+吗啡组(M IR)海马中 RACK 1和CREB mRNA的表达明显降低(见图2A)。经RT-PCR所得条带的(OD)值,,计算 Rtime1=ODRACK1/ODβ-actin,Rtime2=ODCREB/ODβ-actin。检测出与 MIR和CONC组相比,MIC组中RACK 1和CREB mRNA表达明显增高(p<0.05)(见图2B)。
2.3 shRACK1对小鼠海马RACK1和CREB蛋白表达的影响
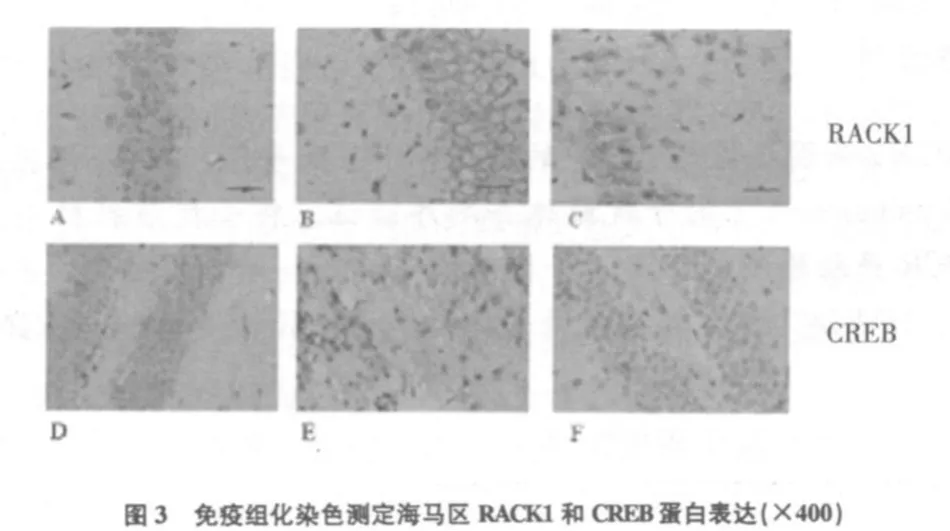
RACK1和CREB在生理盐水对照组海马的齿状回和CA1区呈现弱阳性表达,shRACK1+吗啡组(MIR)海马的齿状回和CA1区呈现强阳性表达,而RACK1干扰质粒+吗啡组(MIR)小鼠海马的齿状回和CA1区表达明显降低,呈现弱阳性(见图3)。
3 讨论
CREB是分子量为43KD的蛋白质,定位于细胞核内,为DNA活性转录因子家庭中的成员之一,它能被蛋白激酶 A(PKA)磷酸化,是大脑内一种主要的转录调节因子。急性给药,药物可通过不同机制使相关脑区多巴胺(DA)含量增加,从而抑制脑内多种类型神经元内环磷酸腺苷(cAMP)酶活性[4-7]。而慢性反复给药,脑内多种核团特别是边缘中脑多巴胺系统相关核团则发生持续的对抗性适应反应,包括cAM P信号通路、阿片类受体和DA受体活性、多种神经元之间递质活动的相应变化[8-13]。
早期的药物成瘾研究发现,急性吗啡使用会导致蓝斑和伏隔核的p-CREB水平降低,然而这种效应在慢性吗啡成瘾时彻底CREB磷酸化的调节作用可能是阿片类物质导致药物成瘾产生的基因表达变化的分子信号通路的一个重要组成部分。慢性吗啡给药后,NAc中CREB的免疫活性降低,NAc中注射反义寡核苷酸后NAc中CREB免疫活性呈特异且持续的降低,反义寡核苷酸可以部分拮抗吗啡的效应,提示CREB在神经系统中可以自主调节cAM P通路[14-15]。CREB的调节及随后的基因表达的变化可能是阿片类药物引起的细胞内长期适应性变化的基础。急慢性吗啡给药后CREB控制的基因的表达却不同[16]。通过对信号级联反应通路的研究发现,慢性吗啡给药导致不同脑区神经细胞cAM P信号转导通路功能上调,PKA催化亚单位上调;同时CaM-CamK信号转导通路激活,钙依赖性蛋白激酶上调,使得细胞内的CREB磷酸化而激活,与CREB结合蛋白(CRE)的结合活性增加,磷酸化后的CREB可以和CBP结合,共同作用于含有CRE调节序列。
本实验建立慢性吗啡成瘾小鼠模型,用RT-PCR技术检测RACK1和 CREB mRNA和蛋白表达水平,结果显示干扰RACK1能够使CREB表达量降低。从而确定了RACK1与慢性成瘾之间的关系以及RACK1干扰质粒慢性成瘾的作用,并揭示了其作用机制在于阻断了细胞内的RACK1-CREB通路。
1 Nestler E J.Common molecular and cellular substrates of addiction and memo ry[J].Neurobiology of Learning and Memory,2002,78(3):637-647.
2 McClung CA,Nestler EJ.Neuroplasticity mediated by altered gene expression[J].Neuropsychopharmacology,2008,33(1):3-17.
3 Carlezon WA Jr,Duman RS,Nestler EJ.The many faces of CREB[J].T rends Neurosci,2005,28(8):436-445.
4 Andersson M,Konradi C,Cenci MA.cAMP response element binding protein is required for dopamine-dependent gene expression in the intact but not the dopamine-denervated striatum[J].J Neurosci,2001,21(24):9930-9943.
5 Lonze BE,Ginty DD.Function and regulation of CREB family transcription factors in the nervous system[J].Neuron,2002,35(4):605-623.
6 Walters CL,Kuo YC,Blendy JA.Differential distribution of CREB in the mesolimbic dopamine reward pathway[J].J Neurochem,2003,87(5):1237-1244.
7 McGough NN,He DY,Logripml,et al.RACK1 and brain-derived neurotrophic factor:a homeostatic pathway that regulates alcohol addiction[J].J Neurosci,2004,24(46):10542-10552.
8 T erwilliger RZ,Beitner-Johnson D,Sevarino KA,et al.A general role for adaptations in G-proteins and the cyclic AM P system in mediating the chronic actions of morphine and cocaine on neuronal function[J].Brain Res,1991,548(1-2):100-110.
9 Nestler EJ,T erwilliger RZ,Walker JR,et al.Chronic cocaine treatment decreases levels of the G protein subunits Gi alpha and Go alpha in discrete regions of rat brain[J].J Neurochem,1990,55(3):1079-1082.
10 Carlezon WA Jr.Duman Rs,Nestler EJ,et al.The many faces of CREB[J].Neurosciences,2005,28(8):436-445.
11 F reeman WM,Nader M A,Nader SH,et al.Chronic cocaine-mediated changes in non-human primate nucleus accumbens gene expression[J].J Neurochem,2001,77(2):542-549.
12 Sakai N,Thome J,Olson VG,et al.Regulation of cocaine reward by CREB[J].Science,1998,282(5397):2272-2275.
13 Dworkin S,Heath JK,deJong-Curtain TA,et al.CREB activity modulates neural cell proliferation,midbrain hindbrain organization and patterning in zebrafish[J].Dev Biol,2007,307(1):127-141.
14 Widnell K L,Self DW,Lane SB,et al.Regulation of CREB expression:in vivo evidence fo r a functional role in morphine action in the nucleus accumbens[J].J Pharmacol Exp Ther,1996,276(1):306-315.
15 Barrot M,Olivier JD,Perrotti LI,et al.CREB activity in the nucleus accumbens shell controls gating of behavioral responses to emotional stimuli[J].Proc Natl Acad Sci U S A,2002,99(17):11435-11440.
16 Bilecki W,Przewlocki R.Effect of opioids on Ca2+/cAMP responsive element binding protein[J].Acta Neurobiol Exp(Wars),2000,60(4):557-567.

