表皮细胞生长因子对角质形成细胞体外增殖作用的研究
杨晓波 王思斯 卿钦 王沼丹 杨云霞△
(1.四川省双流县中医医院药剂科,四川 成都 610200;2.四川大学华西医学中心,四川 成都 610044)
细胞增殖、分化、成熟的调控依赖多种活性蛋白质及多肽,统称为生长因子。目前已发现包括表皮生长因子(epidermal growth factor,EGF)在内的多种生长因子。重组人表皮生长因子(recombinant human EGF,rhEGF)是通过人工合成的表皮生长因子基因片段在大肠杆菌表达系统进行有效表达而获得的可促进多类细胞生长的多肽类物质,其活性和结构与天然产物高度一致[1]。具有广泛的促进细胞增殖和组织再生的生物学活性,对体表创伤、烧伤和溃疡等创面的治疗具有较大的临床应用价值。临床手术无菌切口情况下,由于没有感染存在,rhEGF对创面是否像其他创面一样有效,在临床应用方面尚有一定的争议。rhEGF对人角质形成细胞的细胞周期尚未见报道,本文就rhEGF对人角质形成细胞的增殖作用及其细胞周期进行分析研究。
1 材料与方法
1.1 材料
1.1.1 细胞 角质形成细胞,由小儿包皮环切术后标本制得。实验时将细胞悬液按一定细胞密度接种于培养皿中,置37℃,5%CO2孵箱中;2-3d换液一次;当细胞长满瓶皿70-80%时,根据需要传代或冻存细胞。
1.1.2 试剂 rhEGF,经细菌发酵获得,冻干粉保存,临用时用生理盐水配制成所需浓度。DMEM、PRMI-1640培养基(Gibco),小牛血清、胎牛血清(成都哈里生物工程有限公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(M TT)(Sigma)。金因肽(JYT):无色透明液体,规格:15ml◦支-1,2000IU◦ml-1,批号:20030904;(深圳市华生元基因工程发展有限公司)。
1.1.3 仪器 SANYO CO2培养箱(SANYO Labo Autoclave);超净工作台(苏净集团苏州安泰空气技术有限公司);Epics-XLII型流式细胞仪(美国);31007R型液体闪烁计数器(美国)。
1.2 方法
1.2.1 MTT法测定细胞的增殖 取对数生长期细胞1.5×105接种于96孔培养板内,每孔 100μ l,设 6个复孔。加 rhEGF使浓度为0,5,10,20,50,100 ng◦ml-1及调零孔加100μ l培养液,继续培养48h,结束前4h,加 10μ l M TT,常规终止实验,与DG3022A型酶联免疫检测仪上测各孔吸光值,波长490nm。按下列公式计算相对增殖率(Relative growth rate,RGR):RGR=给药孔吸光度值/对照孔吸光度值×100%。
1.2.2 不同作用时间对细胞增殖的影响 取对数生长期细胞1.5×105接种于96孔培养板内,每孔100μ l,设6个复孔。分别在不同时间(6,12,24,48,72h)加浓度为10 ng◦ml-1rhEGF培养,结束前4h,加10μ l MTT,常规终止实验,按照2.1的方法测定吸光值并计算相对增殖率。
1.2.33HtdR掺入法测细胞生长率 以每孔2×105个细胞的浓度加入六孔板中,设4个复孔。待细胞贴壁后加入不同浓度的rhEGF作用与细胞48h,然后加入3HtdR(3H标记的胸腺嘧啶核苷)(终浓度为0.5μ Ci◦ml-1)。6h后收集细胞,纸片法在液体闪烁计数仪测定细胞的液体闪烁计数(cpm)值。
1.2.4 流式细胞仪检测细胞周期 接种2×105个细胞于75ml培养瓶中,待细胞贴壁后加入不同浓度的rhEGF作用于细胞48h,收集细胞,流式细胞仪激发光源为15mW 氩离子激光器,激发波长488mm,应用Expo 32 ADC进行免疫荧光数据分析,用Muticycle AV分析软件对DNA细胞周期拟合;根据细胞周期时相,计算细胞的增殖指数(PI):PI=(S+G2/M)/(G0/G1+S+G2/M)×100% 。
1.3 统计学处理 数据用“均数±标准差”表示,用SPSS11.5软件进行统计学分析,组间两两比较采用t检验及x2检验。
2 结果
2.1 MT T法测定细胞的增殖 结果见表1,rhEGF在浓度为5~100 ng◦ml-1均可以促进人角质形成细胞的生长,在 10 ng◦ml-1时促进细胞的生长的作用最为明显。
2.2 不同作用时间对细胞增殖的影响 结果见表2,浓度为10 ng◦ml-1的rhEGF在各时间点均可以促进人角质形成细胞的生长,作用48h促进细胞的生长的作用最为明显。
表1 重组人表皮细胞生长因子对表皮细胞吸光值及增殖率的影响±s,n=6)
组别(ng◦ml-1) 光密度 相对增殖率(%)对照组 0.69±0.020 rhEGF 5 0.93±0.019 134.7810 0.99±0.010 143.4820 0.95±0.018 137.6850 0.92±0.013 133.33100 0.91±0.011 131.88
表2 重组人表皮细胞生长因子作用不同时间对表皮细胞吸光值及增殖率的影响(,n=6)
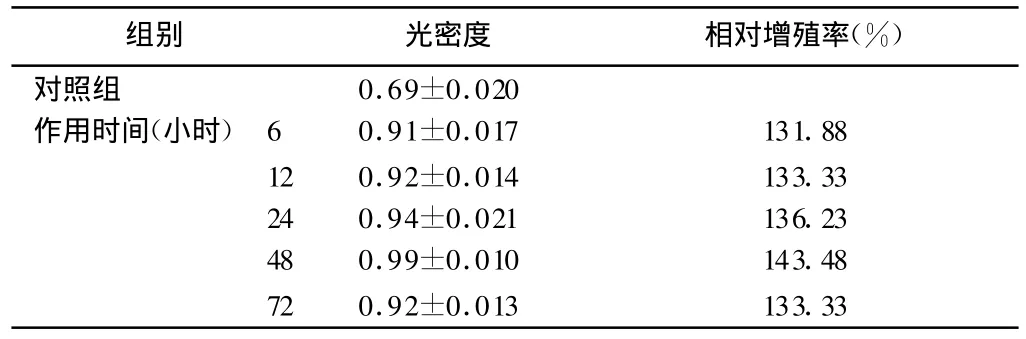
表2 重组人表皮细胞生长因子作用不同时间对表皮细胞吸光值及增殖率的影响(,n=6)
组别 光密度 相对增殖率(%)对照组 0.69±0.020作用时间(小时) 6 0.91±0.017 131.8812 0.92±0.014 133.3324 0.94±0.021 136.2348 0.99±0.010 143.4872 0.92±0.013 133.33
2.33HtdR掺入法测细胞生长率 不同浓度的rhEGF作用与细胞48h,用3HtdR掺入法测定细胞生长,结果发现rhEGF在浓度为5~50 ng◦ml-1均可以促进角质形成细胞的生长,在10 ng◦ml-1时促进细胞的生长的作用最为明显,经t检验各浓度rhEGF与对照组相比有明显差异(P<0.01)(表3)。
表3 重组人表皮细胞生长因子促进角质形成细胞生长的cpm值(,n=4)

表3 重组人表皮细胞生长因子促进角质形成细胞生长的cpm值(,n=4)
与对照组相比:△△P<0.01
组别(ng◦ml-1) Cpm值对照组 875.67±332.85 rhEGF 5 2541.67±38.40△△10 3304.33±134.24△△50 2982.33±88.56△△
2.4 流式细胞仪检测细胞周期 rhEGF处理组的细胞在DNA合成前期减少,而处于DNA合成期的细胞相对增加,S和G2/M期细胞数增加,G0/G1细胞数减少,增殖率较未用rhEGF组明显增高,相比具有统计学差异。表明重组人表皮细胞生长因子可以促进角质形成细胞的分裂增殖,结果见表4。
表4 重组人表皮细胞生长因子对角质形成细胞周期的影响以及增殖指数的变化(,n=6)
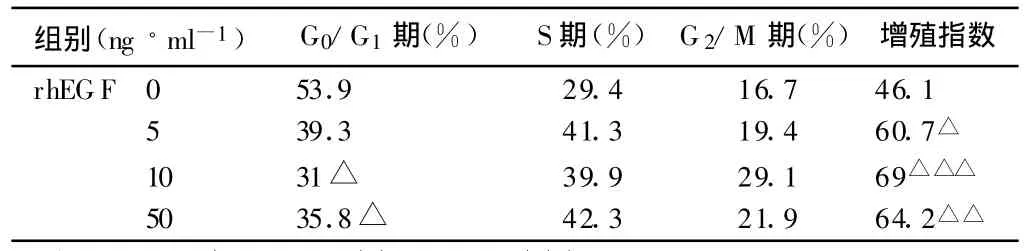
表4 重组人表皮细胞生长因子对角质形成细胞周期的影响以及增殖指数的变化(,n=6)
与对照组相比:△P<0.05,△△P<0.01,△△△P<0.001
组别(ng◦ml-1) G0/G1期(%) S期(%)G2/M期(%) 增殖指数rhEGF 0 53.9 29.4 16.7 46.15 39.3 41.3 19.4 60.7△10 31△ 39.9 29.1 69△△△50 35.8△ 42.3 21.9 64.2△△
3 讨论
表皮生长因子(EGF)是广泛存在于人体多种组织的一种多肽因子,具有刺激上皮细胞增生,加快创伤愈合的作用[1]。创面愈合能力除与创面产生原因有关外,还与创面修复内环境的改变、内源性生长因子含量或受体活性等因素有关。EGF与其受体结合可激活直接调控或诱导细胞增殖的调节生长基因,参与体表创伤的愈合过程。在创伤修复过程中,由于组织中的EGF含量普遍较低,难以满足细胞增殖和肉芽组织发育的需要,因此,理论上外源性的EGF可加速创面的愈合速度[2]。
目前,重组人表皮生长因子已成为多种创伤的治疗药物,如在烧伤及各种慢性创面、消化系统溃疡、口腔溃疡、角膜溃疡的治疗中取得了一定进展。临床手术无菌切口情况下,由于没有感染存在,愈合比感染伤口为快,rhEGF对创面是否像其他创面一样有效,在外科手术后切口应用的实际价值方面尚有一定的争议。有研究显示,在小儿腭裂修复时使用基因重组人表皮生长因子,能有效地促进和加快切口愈合[3]。为此我们从小儿包皮环切术后皮肤标本制得角质形成细胞,观察 rhEGF对其是否具有增殖作用,结果显示,rhEGF对人角质形成细胞具有促增殖作用,而且在10 ng◦ml-1时作用最为明显;MT T法和3HtdR掺入法测细胞生长率结果一致,作用48h促进增殖作用最为明显。流式细胞术的进一步研究表明rhEGF处理细胞48h后处于DNA合成期的细胞增加,细胞增殖率分别较阴性对照组增加,表明rhEGF促进细胞增殖与加快细胞周期有关,可促使更多的细胞进入分裂期。以往的动物研究显示rhEGF可以促进创伤愈合[4-5]。
EGF的量效关系有不同的报道,一般认为在适当浓度时可有效刺激表皮细胞的增殖,过高浓度的rhEGF并不促进细胞的增殖,生物学效应反而降低,其机制可能是rhEGF受体活性的下调[6]。本实验结果表明rhEGF小、中、大剂量之间未见明显的量效关系,在所选的剂量范围内均能有效地促进表皮细胞增殖,促进创伤的愈合,但小剂量就能够达到有效的治疗目的。
1 Jahovic N,Guzel E,Arbak S,et al.The healing-promoting effect of saliva on skin burn is mediated by epidermal growth factor(EGF):role of the neutrophils[J].Burns,2004,30(6):531-538.
2 Hardwicke J,Ferguson EL,M oseley R,et al.Dextrin-rhEGF conjugates as bioresponsive nanomedicines for wound repair[J].J Control Release,2008,130(3):275-283.
3 王怀谷,汪春兰,李光早,等.基因重组人表皮生长因子在腭裂修复术中的应用[J].蚌埠医学院学报,2008,33(1):41-42.
4 郝杰,彭波,杨云霞,等.重组人表皮生长因子加速皮肤创伤修复的实验研究[J].四川生理科学杂志,2006,28(4):156-158.
5 缪世坤,彭波,杨云霞,等.重组人表皮生长因子对大鼠皮肤烧伤愈合的促进作用[J].四川生理科学杂志,2007,29(3):107-108.
6 Duconge J,Prats PA,Valenzuela C,et al.Topical disposition of two strengths of a 125I-rhEGF jelly in rat skin wounds[J].Biopharm Drug Dispos.,2004,25(5):193-201.

