Rack 1对慢性吗啡成瘾小鼠海马BDNF表达和动物行为偏爱的影响*
苏岚 万莉红,2 谢一舟 汪宇辉 刘延友 王正荣△
(1.四川大学华西基础医学与法医学院时间生物学卫生部重点实验室,四川 成都 610041;2.四川大学华西基础与法医学院药理教研室,四川 成都 610041)
目前我国药物滥用所致成瘾的人数日益增多,其机制主要与一些神经递质的紊乱和失调有关[1],且这些药物通过不同通路激活大脑中的奖赏中枢即中脑边缘多巴胺系统[2]。海马主要通过乙酰胆碱、5-羟色胺等神经递质参与脑的学习记忆过程[3],大量研究证实药物依赖的实质是一个恶性学习记忆过程,通过影响神经递质及受体导致学习记忆功能不同程度的下降[3]。同时研究发现酒精依赖可以导致大脑中脑源性神经营养因子(BDNF)表达的改变,这一作用过程是由C激酶受体1蛋白(Rack1)所介导的[4]。然而Rack1在慢性吗啡所导致的药物成瘾过程中是否也有作用尚无报道。因此,本研究亦在探讨Rack1在慢性吗啡成瘾小鼠海马中的作用及初步分子机制。
1 材料和方法
1.1 实验动物及分组
4~6周龄健康雄性ICR小鼠30只,由成都达硕动物中心提供。小鼠饲养于22℃、55%的湿度、光暗循环 12:12的条件下,均可自由摄取食物和水。按照随机分组原则,分为空质粒+生理盐水对照组(A),空质粒+吗啡成瘾组(B),shRack1+吗啡成瘾组(C),每组10只。
1.2 实验试剂
shRack1和对照质粒由本实验室汪宇辉博士提供,盐酸吗啡(四川医药总公司),Trizol(Invitrogen),RT-PCR试剂盒(大连宝生物工程有限公司),引物(上海英骏生物技术有限公司)序列见表1,DL2000 DNA Marker(TaKaRa),鼠抗人 Rack1单抗、鼠抗羊BDNF单抗(Santa),兔抗鼠 IgG/HRP(中杉公司),免疫组化试剂盒(武汉博士德公司)。
1.3 实验方法
1.3.1 条件性位置偏爱实验(CPP)测定吗啡奖赏效应
预试期:小鼠自由活动后第3d测试小鼠的天然倾向。将测试箱中的隔板打开,把小鼠放入白箱中,允许探索黑、白箱5min,记录每只小鼠15min内在白箱中的停留时间。
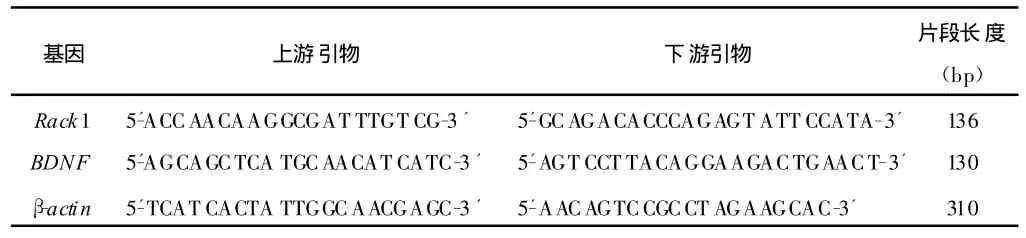
表1 引物序列
给药及训练期:第4-11d给药。用隔板封闭黑白箱通道。受试动物10:00分别皮下注射生理盐水(A组,10mg◦kg-1)和吗啡(B、C组,10mg◦kg-1),放入白箱内停留30min。次日全部注射生理盐水,放入黑箱内停留30min。并且每日16:00脑室注射空质粒(A、B组)和 shRack1质粒(C组)20μ l,共 8d。
测试期:第12d不给药,打开中间隔板,将小鼠放入黑、白两箱中间,让其自由活动,记录15min内小鼠在白箱中停留时间。如果小鼠在白箱中停留的时间延长,表示它对该侧偏爱。
1.3.2 RT-PCR测定海马Rack1以及BDNF mRNA的表达
将小鼠处死,快速开颅取脑,碎冰上分离出海马,按照试剂说明提取组织总RNA,用分光光度计鉴定总RNA样品。取总RNA 2μ g,根据RT-PCR试剂盒说明书合成cDNA。Rack1 PCR扩增条件为:变性 94℃2min;94℃30s,52℃30s,72℃2min,共30个循环,72℃延伸8min。BDNF PCR扩增条件为:变性94℃2min;94℃30s,51.4℃30s,72℃2min,共 30个循环,72℃延伸8min。β-actin PCR扩增条件为:变性94℃2min;94℃30s,52℃30s,72℃2min,共30个循环,72℃延伸8min。PCR产物经15g◦L-1的琼脂糖凝胶电泳,凝胶成像系统成像,Quantity One专业分析软件读取条带灰度值(IOD值),以目的条带和β-actin条带的比值作为目的基因的相对表达量。
1.3.3 免疫组化测定海马Rack1以及BDNF蛋白的表达
用4%的甲醛溶液将海马组织标本固定48h,等级脱水后石蜡包埋,切片,厚度约 3~5μ m。石蜡切片常规脱蜡,3%H202室温孵育15min,以阻断内源性过氧化物酶,热抗原修复10min,室温冷却30min。10%正常山羊血清封闭 15min,滴加1:100稀释的一抗 Rack1和BDNF,4℃过夜,二抗37℃孵育15min,滴加辣根酶标记链酶卵白素工作液,37℃孵育15min,DAB显色剂显色5min,苏木素复染,封片。
1.4 统计学方法
2 结果
2.1 shRack1对慢性吗啡成瘾小鼠CPP的影响
给药前各组小鼠在白箱停留时间差异均无统计学意义(P>0.05)。给药后与A组相比,B、C组小鼠在白箱停留时间明显增加(P<0.05),说明吗啡成功诱导小鼠产生位置偏爱,而C组与B组相比,C组小鼠在白箱的停留时间较少(P<0.05),说明shRack1抑制了吗啡诱导的CPP效应(见表2)。
表2 各组小鼠在白箱内停留的时间(,n=10)

表2 各组小鼠在白箱内停留的时间(,n=10)
△注:与 A 组相比,*P<0.05;与B组相比,△P<0.05(下同)A:空质粒+生理盐水对照组,B:空质粒+吗啡成瘾组,C:shRack1+吗啡成瘾组(下同)
组别 给药前(s) 给药后(s)A 255.500±172.062 297.330±111.182 B 294.600±58.282 794.800±64.363*C 283.000±60.469 462.800±72.530△
2.2 shRack1对慢性吗啡成瘾小鼠海马 Rack1以及BDNF mRNA表达的影响
与A组相比,B组的Rack1以及BDNF mRNA的表达明显增高,说明吗啡对其有促进作用,C组与B组相比,Rack1 mRNA的表达下调(P<0.05),说明 shRack1干扰成功,BDNF mRNA表达下调,说明shRack1对其有抑制作用(见图1、表 3)。

图1 小鼠海马Rack1和BDNF mRNA的电泳结果
表3 shRack1对慢性吗啡成瘾小鼠海马Rack1和BDNFmRNA表达的影响±s,n=10)

表3 shRack1对慢性吗啡成瘾小鼠海马Rack1和BDNFmRNA表达的影响±s,n=10)
组别 Rack1(OD) BDNF(OD)A 1.75±0.1 1.61±0.15 B 2.62±0.1* 2.25±0.2*C 2.2±0.2△ 1.65±0.1△
2.3 shRack1对慢性吗啡成瘾小鼠海马Rack1以及BDNF蛋白表达的影响
B组与A组相比,海马区有阳性表达,说明慢性吗啡成瘾可导致Rack1以及BDNF蛋白表达增加。C组与B组相比,海马区的阳性表达明显减少,说明shRack1干扰成功,且对BDNF蛋白表达有抑制作用(见图2)。

图2 小鼠海马Rack 1和BDNF蛋白的表达情况(免疫组化SP×400)
3 讨论
药物成瘾可看作是一个恶性学习记忆过程,产生成瘾记忆[5]。海马为脑内学习记忆的主要器官[6],在药物成瘾过程中同样发挥着重要作用。有研究表明,药物成瘾的相关大脑回路与已知的记忆存储相关回路有很多相似之处,通过电刺激成瘾模型大鼠海马的谷氨酸丰富区,会引起动物对成瘾药物的强烈渴望,而刺激其它脑区则无效,进一步说明了海马记忆中心及其神经回路在成瘾过程中的关键作用[7]。
BDNF属于神经营养因子家族,又称神经营养素。主要分布在海马、杏仁核和皮质,可通过靶源性、自分泌、旁分泌方式与神经细胞上高亲和性的酪氨酸激酶受体B(TrkB)以及低亲和性的p75神经肽受体结合,产生细胞内的级联反应[8-11]。这些细胞内的信号机制可以通过多巴胺和谷氨酸神经递质的刺激而激活[12-13]。当成瘾药物刺激后,多巴胺增多,谷氨酸的N-甲基-D-天冬氨酸(NMDA)受体显著上调[2],这就意味着成瘾药物通过对这些递质的作用可能会激活BDNF的通路,从而激活下游级联反应。Rack1具有7个W40结构域,能够结合SH2结构域和Fyn[14-15]。有研究表明,当cAMP/PKA信号通路的激活导致Rack1从NR2B和Fyn上解离并释放出来时,在体外培养的海马神经元细胞中,大量释放出的Rack1入核,这些进入核内的Rack1反过来调节BDNF的表达[16]。
通过条件性位置偏爱实验,我们发现给药组小鼠在白箱停留时间明显长于生理盐水组,这说明小鼠通过训练对白箱给药行为产生了记忆。与对照组相比,吗啡组小鼠海马区的BDNF的mRNA和蛋白质表达水平都有明显的升高,但是在Rack 1干扰质粒的作用下,却都有明显的下降,说明在吗啡作用后,激活了BDNF的通路,从而使cAMP/PKA信号通路激活,Rack 1从NR2B和Fyn上解离并释放出来,进而反过来调节了BDNF的表达。药物依赖是一个复杂的神经过程,涉及了各种神经递质以及不同的脑区,而Rack1在其他脑区的作用还值得我们进一步的研究。
1 盛瑞,顾振纶.罂粟中阿片依赖机制及药物治疗进展[J].中国野生植物源,2002,21(1):5-7.
2 闫凤武,赵阿勐,吴凡.药物依赖的中枢主要作用位点及其分子机制[J].齐齐哈尔医学院学报,2006,27(2):192-193.
3 张艳杰,陈晓东,潘桂兰.饮酒对学习记忆相关递质的影响[J].包头医学院学报,2009,25(3):75-77.
4 McGough NN H,He DY,Logrip M L,et al.Rack1 and brain-derived neurotrophic factor:a homeostatic pathway that regulates alcohol addiction[J].Neurobiology of Disease,2004,24(46):10542-10552.
5 Boening JAL.Neurobiology of an addiction memory[J].J Neural Transm,2001,108(6):755-765.
6 龙再浩,朱永平.学习记忆与药物成瘾[J].中国药物依赖性杂志,2003,12(2):86-89.
7 王浩然,高祥荣,张开镐,等.药物成瘾及成瘾记忆的研究现状[J].生理科学进展,2003,34(3):202-206.
8 Klein R,Nanduri V,Jing SA,et al.The trkB ty rosine protein kinase is a receptor for brain-derived neurotrophic factor and neurotrophin-3[J].Cell,1991,66(2):395403.
9 Heerssen HM,Segal RA.Location,location,location:a spatial view of neurotrophin signal transduction[J].T rends Neurosci,2002,25(3):160-165.
10 Kaplan DR,Miller FD.Neurotrophin signal transduction in the nervous sy stem[J].Curr Opin Neurobiol,2000,10(3):381-391.
11 Patapoutian A,Reichardt LF.T rk recepto rs:mediators of neurotrophin action[J].Curr Opin Neurobiol,2001,11(3):272-280.
12 Valjent E,Pascoli V,Svenning sson P,et al.Regulation of a protein phosphatase cascade allows convergent dopamine and glutamate signals to activate ERK in the striatum[J].P roc Natl Acad Sci USA,2005,102(2):491-496.
13 Berhow M T,Hiroi N,Nestler EJ.Regulation of ERK(extracellular signal regulated kinase),part of the neurotrophin signal transduction cascade,in the rat mesolimbic dopamine sy stem by chronic exposure to morphine or cocaine[J].J Neurosci,1996,16(15):4707-4715.
14 Chang BY,Conroy KB,Machleder EM,et al.RACK1,a receptor for activated C kinase and a homolog of the beta subunit of G proteins,inhibits activity of src ty rosine kinases and g rowth of NIH 3T 3 cells[J].Mol Cell Biol,1998,18(6):3245-3256.
15 Mourton T,Hellberg C B.,Burden-Gulley,et al.T he P TPmu protein-tyrosine phosphatase binds and recruits the scaffolding protein RACK1 to cell cell contacts[J].J Biol Chem,2001,276(18):14896-14901.
16 Yaka R,He DY,Phamluong K,et al.Pituitary adenylate cyclaseactivating polypeptide(PACAP(138))enhances N-M ethyl-D-aspartate receptor function and brain-derived neurotrophic factor expression via RACK1[J].J Biol Chem,2003,278(11):9630-9638.

