原花青素对肺癌 SPC-A-1细胞 X射线放射增敏作用
张小芳 赵健雄
原花青素(procyanidins,Pc),是广泛存在于水果、蔬菜、种籽、花朵和树皮中的一类多酚化合物的总称[1],其中葡萄籽原花青素提取物(grape seed procyanidin extract,GSPE)为最早提取成功的原花青素,对其研究也最为广泛。由于 GSPE安全性(GSPE:口服急性毒性 LD50>5 000mg/kg,急性皮肤毒性 2 000mg/kg)、高效和高生物利用率等,使原花青素在食品、医药、化妆品等领域得到了广泛的应用[2]。尤其是近几年原花青素抗肿瘤的作用越来越受到人们的关注,据报道原花青素对皮肤癌、口腔癌、乳腺癌、肝癌、肺癌、前列腺癌、胰腺癌、胃癌、结肠癌等都有一定的预防或治疗作用,但单独应用疗效并不理想。基于此我们研究 GSPE对于肺癌的放疗增敏作用,为扩大 GSPE的临床应用和肺癌的放射增敏治疗提供借鉴。
1 材料与方法
1.1 材料
GSPE:天津市尖峰天然产物研究开发有限公司;小牛血清:杭州四季青公司产品;RMPI-1640培养基干粉:GIBCO公司产品;噻唑蓝(MTT)和碘化丙啶(PI):SIGMA公司产品。倒置相差显微镜:OLYMPUS IX70,OLYMPUS公司产品;BIO-RAD iMark自动酶标仪,日本 BIO-RAD公司;流式细胞仪(FCM):EPICS XL,COULTER公司产品。
1.2 方法
1.2.1 MTT法检测 GSPE对 X射线增敏作用 取对数生长期细胞,0.25%胰酶消化,吹打均匀,计数,稀释至 5×104个 /ml,细胞悬液以 90μl/孔接种至 96孔板,培养贴壁 24 h后加药处理。实验设阴性对照组(细胞悬液 +PBS,用于计算抑制率)、空白对照组(无细胞的 DMEM完全培养液 +PBS,用于消除培养液颜色误差)、原花青素各剂量组(细胞悬液 +不同浓度的原花青素),原花青素各剂量颜色对照组(无细胞的DMEM完全培养液 +不同浓度的原花青素,用于消除药物的颜色误差),10μl/孔加药,每个浓度设 3复孔。阴性对照组和空白对照组加 pH 6.8的磷酸盐缓冲液,置培养箱培养 24 h后进行 X射线照射。照射参数:6 MeV直线加速器下,在 2.5 Gy/min时以不同剂量照射,源皮距为 100 cm。照射结束后继续培养 4天,取出每孔中加入 MTT 10μl(5mg/m l),再培养 4 h后,吸去培养液,加入二甲基亚砜(DMSO)150μl,震荡10min,酶标仪单波长 490 nm测定每孔吸光度值(OD)。按下列公式计算抑制率(IR)。
抑制率(IR,%)=[(阴性A均值 -空白A均值)-(实验 A均值 -颜色 A均值)]/(阴性 A均值 -空白 A均值)×100%
1.2.2 集落形成法检测 GSPE对 X射线照射后细胞增殖的抑制作用 对数生长期的各组细胞,0.25%胰酶消化制备细胞悬液。60 mm培养皿中分别按药物剂量不同种入不同数量的细胞。细胞贴壁后,分别给予不同剂量药物(0、25、100、200 μg/m l)作用 24 h,再给予 0、1、5、9 Gy剂量照射,每组 3个复孔。照射后置37℃、5%CO2的恒温培养箱中培养 8~10天。取出后倒去培养液,PBS漂洗 2次,用醋酸甲醇固定,姬姆萨染色 10min,在解剖镜下计数直径大于 50 m(或含 50个细胞以上)的细胞克隆。按以下公式计算存活分数。
存活率 =某剂量的集落形成数/某剂量下种植的细胞数 ×100%
1.2.3 流式细胞仪检测肿瘤细胞凋亡和细胞周期分布 取对数生长期细胞,消化,计数,调整细胞浓度至5×105/m L,贴壁 24 h后,对照组加 PBS液,实验组加入 GSPE,培养 48 h后,X射线照射,照射结束继续培养 48 h后收集细胞。1 000 r/min离心 5 min,用冷的PBS洗 2次,弃上清,加入 300μg/mL PBS,制成细胞悬液。将0.7mL预冷的无水乙醇沿管壁分多次加入,4℃固定过夜。上机前用 PBS洗 2次,加入 100μg/m LRNA酶,37℃消化 30min,酶切 RNA;加 50μg/mL碘化丙啶(PI),4℃避光染色。用 200目细胞筛过滤后在流式细胞仪上检测(激发波长 488 nm,吸收波长 600 nm)。
1.3 统计方法
MTT各组吸光度值值差异采用单因素方差分析,SPSS 13.0统计软件。集落形成存活率分析采用单击多靶模型曲线拟合,graphpad Prism 5.0软件。用计算机自带 Multicycle(Phoenix Flow System,San Diego,CA,USA)软件分析,计算出细胞周期分布和凋亡情况。
2 结果
2.1 MTT检测 GSPE增敏杀伤作用
检测不同药物浓度在不同剂量的 X射线照射下的增敏作用,抑制率结果见表 1。对数据进行单因素方差分析,结果表明:X射线和 GSPE均可显著影响肿瘤细胞的存活率,并且两者之间存在协同关系,统计有显著性差异(P<0.01)。
但两者对细胞杀伤的贡献不同,为进一步分析两者之间的相关性,固定其中 1个因素水平即 X射线剂量,研究各浓度药物的增敏作用。结果表明,在药物浓度小于 25μg/mL时,药物对肿瘤细胞没有杀伤作用,也无增敏作用;药物浓度 50μg/mL时,药物对肿瘤细胞无杀伤作用,但有增敏作用;100μg/mL时,药物对肿瘤细胞有杀伤作用,同时也有增敏作用;大于 200 μg/m L时,药物对肿瘤细胞的杀伤作用强于 X射线的杀伤,表现为协同作用。所以 50~100μg/mL可以认为是 GSPE的有效增敏浓度。
表1 MTT检测GSPE合用X射线对SPC-A-1细胞抑制率±s)

表1 MTT检测GSPE合用X射线对SPC-A-1细胞抑制率±s)
药物浓度(μg/m L)X射线剂量(Gy)0 1 3 5 7 9 12.5 0.00±0.35 0.00±2.46 0.00±2.07 0.00±3.44 4.50±6.22 17.36±0.26 25 4.51±0.05 3.32±4.69 2.29±3.80 5.46±1.09 11.36±0.79 25.06±0.05 50 7.57±1.22 14.10±1.26 10.66±2.32 13.76±9.98 21.82±11.30 41.38±1.05 100 24.31±7.53 37.37±2.71 40.48±2.35 35.35±6.02 45.09±3.91 56.55±2.20 200 44.58±2.27 44.68±1.61 53.46±1.73 58.04±1.25 77.47±0.14 75.50±0.31 400 51.57±0.51 54.75±1.77 67.50±1.33 68.41±1.31 86.29±2.73 83.01±0.16 800 55.18±1.24 57.93±2.33 68.42±0.18 71.25±0.03 87.90±1.07 83.05±0.63
2.2 集落形成法研究药物和 X射线对肺癌细胞的增殖抑制作用结果
肿瘤细胞具有无限增殖的潜力,但以药物干预或X射线照射后会使部分未立即死亡细胞在继续分裂数代后停止增殖。所以集落形成法观察细胞的增殖抑制作用,结果见表 2。以“多靶单击模型”进行曲线拟合,“多靶单击模型”方程:SF=1-(1-e-D/D0)N,Dq=D0lnN,Dq=lnN/k,其中 SF为存活分数,D为放射剂量(Gy),D0代表平均致死量,Dq代表准域剂量,N为外推数,它是曲线指数区存活分数下降 63%所需的照射剂量,反应不同细胞对射线敏感性和同 1种细胞放射敏感性的变化;存活分数(SF)的计算方法为:处理组集落形成率/对照组集落形成率。增敏比 SER=单纯照射组的 D0/增敏照射组的 D0。通过一系列实际实验的D和得到的相应的一系列 SF,通过曲线拟合出其中的K和 N这两个参数,所以 K和 N是通过曲线拟合计算出的数值,K没有具体意义,其意义有 D0来表示。其他参数比如 D0,Dq等都可以根据 K、N两个参数求出。集落形成结果表明 GSPE为 100μg/m l对 X射线增敏作用明显,药物作用后 D0值降低,表明细胞对 X射线敏感性增加;Dq变小,说明细胞修复亚致死损伤的能力变弱,N值减小则细胞在低剂量区时对亚致死损伤的耐受性降低,增敏比为 2.56,见表 3。
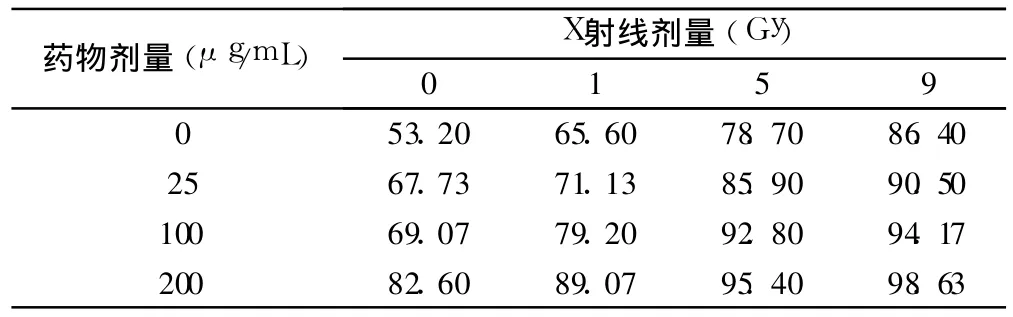
表2 集落形成法测定药物和X射线对肺癌细胞的抑制率(%)
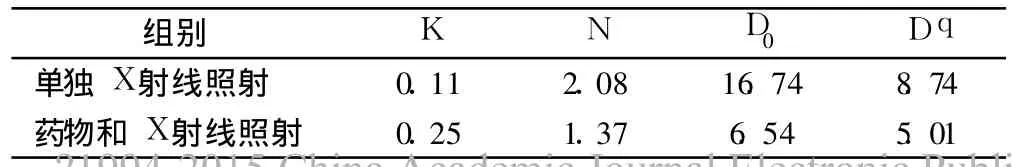
表3 100μg/mLGSPE剂量增敏曲线分析
2.3 流式细胞术检测细胞凋亡
分别比较空白对照组(0 Gy),单独 X射线照射组(1 Gy,5Gy)和药物增敏 X射线组(100μg/m L原花青素 1 Gy,5 Gy)流式细胞术 PI染色图的差异。我们发现药物增敏 X射线组细胞出现了明显的凋亡峰,提示亚二倍体 DNA含量的细胞数量明显增加,细胞凋亡率(28.2%)显著高于单纯照射组(14.9%)及空白对照组(5.3%),见图 1。药物增敏 X射线组与对照组及单独 X射线照射组比较,差异均有非常显著性意义(P<0.01)。实验结果说明:原花青素可以诱导细胞凋亡,并将细胞阻滞于 G1期。
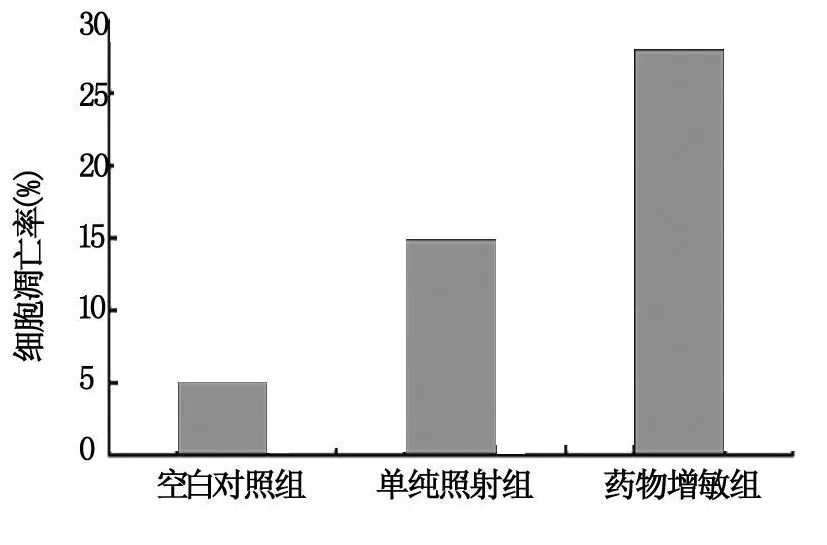
图1 药物增敏X射线组对细胞凋亡的影响
3 讨论
恶性肿瘤是危害人类生命和健康的 1种严重疾病,其中肺癌是导致全球人群死亡数最多的恶性肿瘤,癌症的放射治疗越来越受到人们的重视。但由于肿瘤异质性的存在,不可避免的存在放射抵抗,使肿瘤对放疗的治疗反应不一,它是影响放疗治疗剂量的主要因素之一,也直接影响了肿瘤放疗的效果。提高肿瘤的放疗敏感性一直是医学上的热点和难点。原花青素(PC)是由不同数量的儿茶素或表儿茶素缩合而成的一大类酚类化合物,广泛分布于植物界,许多食品和饮料中都含有丰富的原花青素。近年来的研究显示,具有极强的抗氧化活性,是 1种很好的氧游离基清除剂和脂质过氧化抑制剂,它还有清除自由基、调节免疫抗弹性酶,抗诱变等多种药理活性[3]。除此之外,它可抑制皮肤癌、口腔癌、乳腺癌、肝癌、肺癌、前列腺癌、胰腺癌、胃癌、结肠癌等多种肿瘤细胞的生长,诱导多种肿瘤细胞凋亡[4]。Huyny等[5]发现,用 PC处理的人体乳腺癌细胞中测得的凋亡数比未处理的同种细胞高的多;而在正常人乳腺细胞样品中,PC并不明显改变凋亡的数量。Shih等[6]研究了原花青素不仅抑制胃腺癌细胞的增殖,而且可以诱导其凋亡。Bomser等[7]研究了抑制诱导的小鼠皮肤肿瘤发展的活性。有学者研究原花青素对肺癌的治疗作用,对肺癌细胞和大鼠多脏器癌症模型的肺癌均有较好的治疗和预防作用,因此,本实验设计研究 GSPE的放疗增敏作用。实验结果表明 GSPE对肺癌 SPC-A-1细胞有较好的放疗增敏作用,增敏剂量在 50~100μg/mL之间,低于该剂量增敏效果不显著。在增敏剂量下对单独 X射线照射和药物作用后 X射线照射细胞存活分数进行曲线拟合,分析结果表明,GSPE对 X射线有显著的增敏作用,药物作用后 D0值降低,表明细胞对 X射线敏感性增加;Dq代表准域剂量,它反映肩区的大小,表明细胞亚致死损伤修复能力。药物作用后,Dq变小,说明细胞修复亚致死损伤的能力变弱,N值减小则细胞在低剂量区时对亚致死损伤的耐受性降低,增敏比为 2.56。既往研究认为,细胞的放射敏感性与细胞凋亡水平有关,细胞凋亡反应越强放射敏感性越高,快速凋亡细胞的放射敏感性最强。流式细胞术(PI染色法)结果发现原花青素与放疗联合应用凋亡率较对照组和单纯放疗组明显增加,提示原花青素能增强 SPC-A-1细胞对放疗诱导凋亡的敏感性,推测这可能与原花青素改变细胞周期的分布有关。在实验中发现它能使 G0/G1期细胞比例明显增加,S期和 G2/M期减少,这样便相应抑制了肿瘤细胞进入 DNA合成期和有丝分裂期,促进了细胞的凋亡,增加了放疗的敏感性。
[1] Bagchi D,Bagchi M,Stohs SJ,et al.Free radicals and grape seed proanthocyanidin extract:importance in human health and disease prevention〔J〕.Toxicology,2000,148:187.
[2] Ray S,Bagchi D,Lim P,et al.Acute and long-term safety evaluation of a novel IH 636 grape seed proanthocyanidin extract〔J〕.Res-Commun-Mol-Pathol-Pharmacol,2001,109(3~4):165.
[3] 郑 敏,梅贤臣,鲍翠玉.大蒜多糖体外抗柯萨奇病毒B 3作用〔J〕.中国现代应用药学杂志,2005,22(1):4.
[4] 李素梅,穆春兰.原花青素的研究进展〔J〕.黑龙江医药,2006,19(3):201.
[5] Huyny TH,Teel RW.Selective induction of apop tosis in human mammary cancer cells(MCF-7)by pycnogenol〔J〕.Anticancer Res,2000,20(4):2417.
[6] Shih PH,Yeh CT,Yen GC.Effects of anthocyanidin on the inhibition of proliferation and induction ofapoptosis in human gastric adenocarcinoma cells〔J〕.Food Chem Toxicol,2005,43(10):l557.
[7] Bomser J,Madhavi DL,Singletary K,et al.In vitro anticancer activity of fruit extracts from Vaccinium species〔J〕.Planta Med,1996,62(3):212.

