脂肪组织分泌的瘦素通过中枢神经系统调控哺乳动物骨骼代谢的研究进展
刘静波 陈代文* 余 冰
(1.四川农业大学动物营养研究所,雅安 625014;2.动物抗病营养教育部重点实验室,雅安 625014)
骨骼代谢主要包括破骨细胞对已经存在的骨骼进行的骨吸收和成骨细胞主导的骨形成,破骨细胞和成骨细胞这2种细胞系功能的稳定对维护骨骼的健康至关重要。人从青春期至中老年期,由上述2种细胞系维持的骨骼代谢总是维持在一个平衡状态,但是中年妇女绝经后这种平衡状态被打破,从而出现骨骼代谢紊乱。这主要是因为性腺功能衰退使得破骨细胞上的雌激素α受体介导的信号途径减弱而导致破骨细胞骨吸收增加[1],进而使骨量减少,甚至出现骨质疏松症[2]。骨骼代谢疾病已经成为威胁当今世界各国中老年人健康的主要代谢疾病之一,因此,通过一定的手段维持骨形成与骨吸收之间的平衡对于减少骨骼代谢疾病的发生具有重要的意义。
临床研究已经揭示了一个不争的事实,即中老年妇女性腺功能衰退之后,通常伴随着脂肪沉积增加和骨质疏松,这暗示哺乳动物的繁殖系统、脂肪沉积和骨骼代谢可能通过相同的激素调控[3]。自被发现以来,瘦素(leptin)基因及其受体一直被认为是调控能量代谢和繁殖的重要信号分子[4-5],而且流行病学的研究发现,当人进入中老年后适度的肥胖能够降低骨折的发生率,提示leptin可能参与调节骨骼代谢[6]。近年以基因敲除小鼠为动物模型的研究发现,leptin与其受体结合之后启动的信号转导对骨骼代谢的调控非常重要[3,7]。因此,本文主要就leptin调控骨吸收和骨形成的相关信号转导途径做一简要综述,为增进人类骨骼健康提供重要参考。
1 leptin基因(ob/ob)及其受体基因(db/db)敲除对骨骼代谢的影响
为了研究leptin对骨骼代谢的影响,Ducy等[7]通过基因手段敲除lep tin基因(ob/ob)和lep tin受体基因(db/db),发现ob/ob小鼠和db/db小鼠的骨量和骨密度均显著增加,且除了肥胖之外,ob/ob小鼠和db/db小鼠还出现了性腺功能衰退以及皮质酮增多症。前人的研究表明,性腺功能衰退导致的雌激素减少[1,8]和皮质醇增多症[9]均能够诱导骨吸收增加,导致骨量减少,但是Ducy等[7]的研究却发现ob/ob小鼠和db/db小鼠骨量均显著增加,说明了leptin对骨量的影响甚至超出了雌激素和皮质酮的作用。
骨骼代谢是由骨形成和骨吸收来维持的,因此leptin信号缺失小鼠的骨形成和骨吸收势必受到影响,进而导致骨量增加。钙黄绿素(calcein)是反映骨形成的重要指标,研究发现3月龄和6月龄ob/ob小鼠的钙黄绿素显著增加,骨形成比野生型小鼠分别增加了70%和60%[7],而反映骨吸收功能的指标脱氧吡啶诺林显著高于野生型小鼠[10],尽管如此,ob/ob小鼠破骨细胞的数目却出现增加[7]。这说明leptin基因及其受体基因敲除后,成骨细胞的骨形成功能和破骨细胞的骨吸收功能并未受到损坏,只是二者功能的平衡发生了变化。因此,尽管ob/ob小鼠和db/db小鼠出现的性腺功能衰退和皮质酮增多症本应该诱导骨吸收,但是这2种基因敲除的小鼠均出现了骨量增加的现象,从而揭示出leptin信号途径在骨骼代谢中的重要作用。
2 lep tin通过中枢神经系统调控骨骼代谢
骨骼的代谢是一个动态过程,是成骨细胞和破骨细胞的功能的统一体。ob/ob小鼠和db/db小鼠的成骨细胞和破骨细胞的功能在leptin信号缺失之后均受到了影响[7],因此leptin可能通过直接作用于成骨细胞或者破骨细胞来影响这2种细胞系的功能。有报道指出,在体外条件下leptin可以促进骨髓巨噬细胞分化为成骨细胞[11],Cornish等[12]通过实时聚合酶链反应(RT-PCR)研究表明leptin功能性受体在成骨细胞表达,且在体外条件下能够调控骨细胞的功能。但是lep tin受体同时存在于外周和中枢神经系统,因此围绕leptin到底是通过外周还是中枢途径调控骨骼代谢一直存在争议。Takeda等[13]的研究不认为leptin是通过外周途径调控骨骼代谢的,主要体现在:第一,体外原代培养成骨细胞时,在培养基中添加生理水平的lep tin并未检测到leptin的效应分子信号转导和转录激活因子3 (STAT3)的磷酸化,只有当leptin的添加量远远超过生理水平时才能观察到成骨细胞的分化;第二,体外培养db/db小鼠的成骨细胞发现,缺失了leptin受体的成骨细胞系在体外产生的骨胶原低于野生型小鼠;第三,通过转基因手段在成骨细胞中过量表达leptin并没有对小鼠骨骼代谢产生显著影响。为了解决lep tin到底是通过外周还是中枢神经系统影响骨骼代谢的问题,Shi等[14]通过基因工程手段分别特异性地敲除外周成骨细胞系和中枢下丘脑神经元的leptin受体,结果发现特异性敲除外周成骨细胞系leptin受体的小鼠骨量没有发生变化,但是特异性敲除中枢下丘脑神经元lep tin受体的小鼠骨量显著增加,证实leptin是通过中枢神经系统来完成对骨量的调节的。
leptin发挥功能的途径是通过与其受体结合启动信号转导来完成的,leptin的功能性受体在下丘脑的神经元表达量极其丰富,这也进一步提示leptin是通过下丘脑途径来调控骨骼代谢的。Ducy等[7]、Takeda等[13]和Elefteriou等[15]对ob/ob小鼠进行脑室灌注leptin,发现脑室灌注leptin可使ob/ob小鼠的骨量降低至野生型小鼠的水平。对羊连续3个月进行脑室灌注leptin,发现其骨量显著减少[16]。为了进一步研究leptin作用于下丘脑的具体区域,Takeda等[13]用谷氨酸单钠盐(MSG)和硫金葡萄糖(GTG)分别特异性地破坏ob/ob小鼠的弓状核(ARC)和下丘脑腹内侧核(VMH),并且对以上2种小鼠模型的脑室内灌注lep tin,发现ARC神经元被破坏后,脑室灌注leptin仍然能够继续降低骨量,而VMH神经元被破坏后,脑室灌注lep tin不影响骨量,说明lep tin是作用于VMH来调控骨骼代谢的。
3 交感神经系统(SNS)介导lep tin对骨骼代谢的调控
由于SNS在leptin基因缺失之后其活性受到了很大的影响[17],学者开始研究SNS对ob/ob小鼠骨骼代谢的影响。SNS系统的信号途径主要是通过肾上腺素能受体来完成的,Takeda等[13]通过基因工程手段突变肾上腺素能受体的配体产生关键酶多巴胺β-羟化酶(DBH),抑制体内的肾上腺素和去甲肾上腺素(ISO)分泌,结果发现,12月龄的DBH基因缺失(Dbh-/-)小鼠的骨量明显增加,脑室灌注lep tin降低了Dbh-/-小鼠的脂肪沉积,但是却没有影响骨骼代谢,体现了SNS在lep tin调节骨骼代谢的过程中发挥着重要的信号传递作用。
M oore等[18]通过RT-PCR和Northern杂交发现,只有成骨细胞存在肾上腺素能受体2 (Adrb2),而破骨细胞不表达Adrb2的编码基因。通过对1月龄ob/ob小鼠连续6个月进行ISO处理,结果发现ISO处理的ob/ob小鼠骨量显著减少,成骨细胞的数量和骨形成率下降,而用Adrb2的拮抗剂(β-blocker)处理却得到相反的效果[13]。通过基因工程手段敲除Adrb2基因,发现Adrb2基因缺失(Adrb2-/-)小鼠的骨量显著增加[15],而且该小鼠模型伴随着leptin抵抗性的骨量增加[19]。人临床上的研究表明,服用β-b locker的病人的骨密度增加[20],发生骨折的几率下降[21-22],说明leptin通过SNS作用于成骨细胞的Adrb2影响骨骼代谢过程。
3.1 lep tin-SNS信号途径对成骨细胞的影响
无论leptin通过哪种信号途径发挥作用,均是通过影响成骨细胞或破骨细胞的功能来实现的,因为这2种细胞系功能平衡的变化是导致骨量变化的直接原因。leptin基因及其受体基因被敲除后,成骨细胞的数目和功能都显著提高[7,13],说明ob/ob小鼠和db/db小鼠的成骨细胞功能变化是导致高骨量的重要原因。通过细胞转染试验,用野生型小鼠骨髓巨噬细胞转染Adrb2-/-小鼠,Adrb2-/-小鼠的骨量恢复正常,且在体外细胞分化时可检测到野生型小鼠的成骨细胞;相反,用Ad rb2-/-小鼠骨髓巨噬细胞转染野生型小鼠,野生型小鼠的骨量增加,且在体外细胞分化时可检测到Adrb2-/-小鼠的成骨细胞,证明成骨细胞在lep tin-SNS信号途径中发挥着重要作用[15]。
3.2 leptin-SNS信号途径对破骨细胞的影响
ob/ob小鼠和接受β-b locker处理的野生型小鼠不仅成骨细胞的骨形成增加,而且破骨细胞主导的骨吸收也显著增加[7,13],但是Adrb2-/-小鼠在性腺摘除之后破骨细胞的骨吸收功能显著降低[15],这与Ducy等[7]所发现的ob/ob小鼠和db/db小鼠在性腺衰退后骨吸收增加的结果迥异。Elef teriou等[15]在RANKL(成骨细胞的分化因子)、M-CSF (破骨细胞的增殖因子)存在的情况下培养野生型和Adrb2-/-小鼠的骨髓巨噬细胞,发现这2种小鼠的骨髓巨噬细胞均能够分化到破骨细胞,而且敲除Adrb2基因和ISO处理均不影响破骨细胞的骨吸收功能和传代,说明破骨细胞的功能并未受到影响,从而排除了SNS直接作用于破骨细胞的可能性。
交感信号的响应受体Adrb2仅在成骨细胞表达,推测lep tin-SNS信号途径通过成骨细胞来间接调控破骨细胞的功能。研究发现,当野生型小鼠的成骨细胞和ISO共同培养时,增加了破骨细胞的传代以及RANKL的表达,但Adrb2-/-小鼠的成骨细胞和ISO共同培养却没有增加破骨细胞的传代和RANKL的表达,这说明leptin可以通过Adrb2上调成骨细胞分泌的RANKL来完成对破骨细胞功能的调节[15]。
尽管ISO诱导的RANKL表达能够促进破骨细胞分化和骨吸收,但是不能够解释Adrb2-/-小鼠在性腺摘除之后破骨细胞的骨吸收功能显著降低这一现象,说明leptin诱导的SNS信号途径在Ad rb2-/-小鼠中受到了其他因素的影响。鉴于此,研究人员将研究重点放到那些受到lep tin调控且基因失活之后不影响食欲和生育能力的基因。可卡因-苯丙胺调节转录肽(CART)是一种内源性神经肽,研究发现,CART的表达在ob/ob小鼠中降低,但是在Adrb2-/-小鼠上却正常,而且CART基因缺失(Cart-/-)小鼠没有明显的内分泌及繁殖系统的表型紊乱(排除代谢激素和繁殖激素的影响),6月龄Cart-/-小鼠出现骨量降低,破骨细胞的表面积和数量增加了2倍,当对Cart-/-小鼠脑室内灌注leptin时,却增加了骨量,说明leptin能够通过CART调控破骨细胞的功能,抑制骨吸收[15]。Cart-/-小鼠的RANK L的表达量上升,说明CART是通过调控RANKL的表达来发挥功能的,从而体现lep tin还可以通过CART下调RANKL的表达减少破骨细胞的分化而增加骨量(图1)。因此,leptin通过2种相反的方式来调控破骨细胞的功能:第一,通过SNS-Adrb2影响成骨细胞RANKL的分泌来促进破骨细胞的分化;第二,通过CART来抑制破骨细胞的分化。
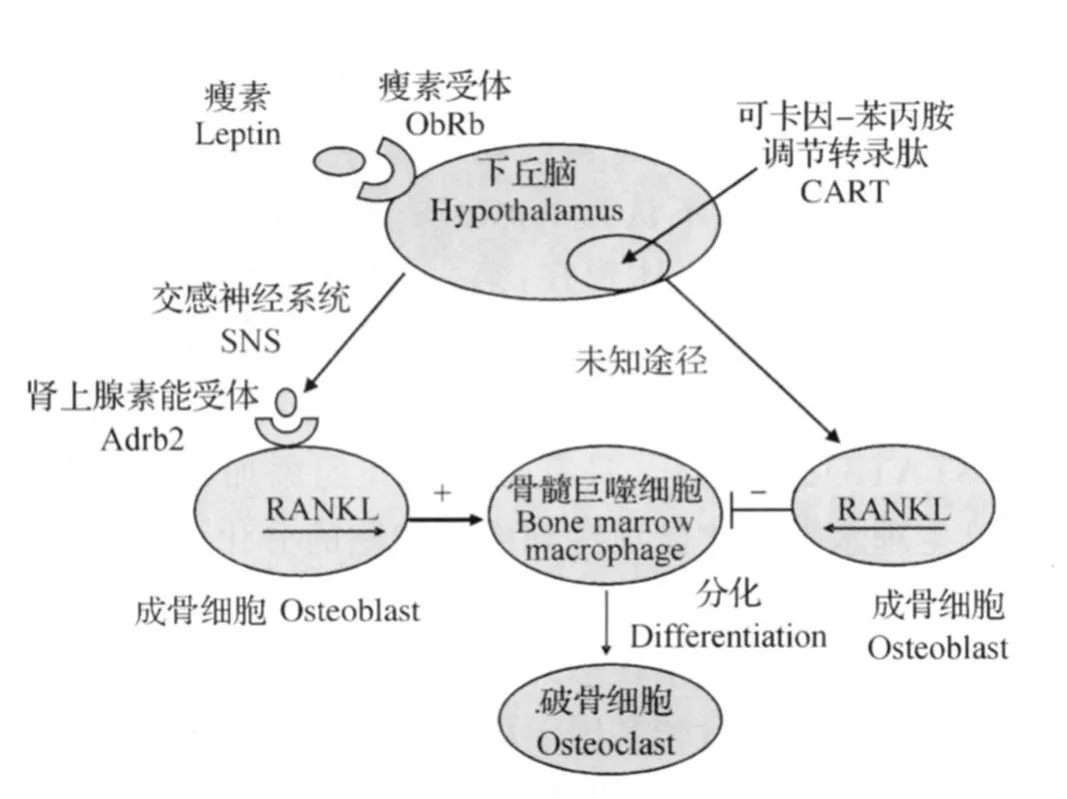
图1 leptin对破骨细胞分化的双向调节Fig.1 Bidirectional regulation of lep tin on dif ferentiation of osteoclast
4 分子钟(molecu lar clock)基因在leptin调控骨骼代谢中的作用
4.1 分子钟对成骨细胞活性的影响
骨骼代谢包括破骨细胞的骨吸收和成骨细胞的骨形成,二者的功能稳衡对于骨骼的功能正常至关重要,由于这是一个稳衡的过程,提示分子钟可能参与了leptin对骨骼代谢的调控。Per是分子钟基因的一种,通过敲除Per基因发现,Per基因缺失(Per-/-)小鼠出现了显著的骨量增加。当用ISO分别处理野生型和Per-/-小鼠时,发现Per-/-小鼠成骨细胞的分子钟基因的表达不受影响,而野生型小鼠却显著提高,说明成骨细胞的分子钟基因通过SNS的调节来影响骨骼代谢。分析Per-/-小鼠的2种骨细胞系发现:破骨细胞没有受到影响,但是成骨细胞却出现了显著的增殖。通过细胞增殖试验发现,培养16 h后,到达G2期的Per-/-小鼠成骨细胞的数量是野生型小鼠的3倍,且Per-/-小鼠成骨细胞的G1期细胞周期蛋白(cyclins)的表达量显著高于野生型小鼠,说明Per基因可以调控成骨细胞的有丝分裂,延长细胞周期,降低细胞增殖的速度[23]。
4.2 分子钟通过转录因子活化蛋白-1(AP-1)促进成骨细胞的增殖来增加骨量
Per-/-小鼠和Adrb2-/-小鼠在许多细胞和分子水平上的特点都是相似的,但是却有一个比较特殊的现象,即当脑室灌注leptin时,Per-/-小鼠的骨量增加,但是对Adrb2-/-小鼠却没有影响。这说明leptin-SNS除了通过分子钟途径抑制成骨细胞增殖之外,还可以通过lep tin-SNS的其他下游信号途径增强成骨细胞的功能。研究成骨细胞增殖和分化的转录因子的表达情况发现,c-fos(AP-1成员之一,能够调节成骨细胞的转化,对于调控骨骼发育非常重要[24])在Per-/-小鼠中的表达差异最为明显,ISO处理之后c-fos是上调最明显的基因。通过基因敲除手段发现,当同等密度下培养成骨细胞时,c-fos基因缺失(c-fos-/-)小鼠的成骨细胞生长速度明显低于野生型小鼠,说明c-fos可控制成骨细胞分化。此外,受到分子节律基因调控的细胞周期基因c-myc和细胞周期蛋白D1 (cyclin D1)在c-fos-/-小鼠的成骨细胞中显著下调,说明leptin-SNS信号系统能够通过AP-1来增加成骨细胞的增殖,这种途径可能是通过增加一些细胞周期蛋白的调节因子来完成的。成骨细胞的SNS能够触发2种相反的信号途径调节成骨细胞的增殖,而且还存在信号之间的交联,Per基因能够下调AP-1的表达,c-fos在Adrb2-/-小鼠中表达过量是由于这些细胞的分子钟基因的表达下调所引起的。因此,在当分子钟的表达受到影响时,AP-1也可相应地调节成骨细胞的增殖来调节骨量[23]。lep tin通过SNS-Ad rb2对成骨细胞增殖的双向调节如图2所示。
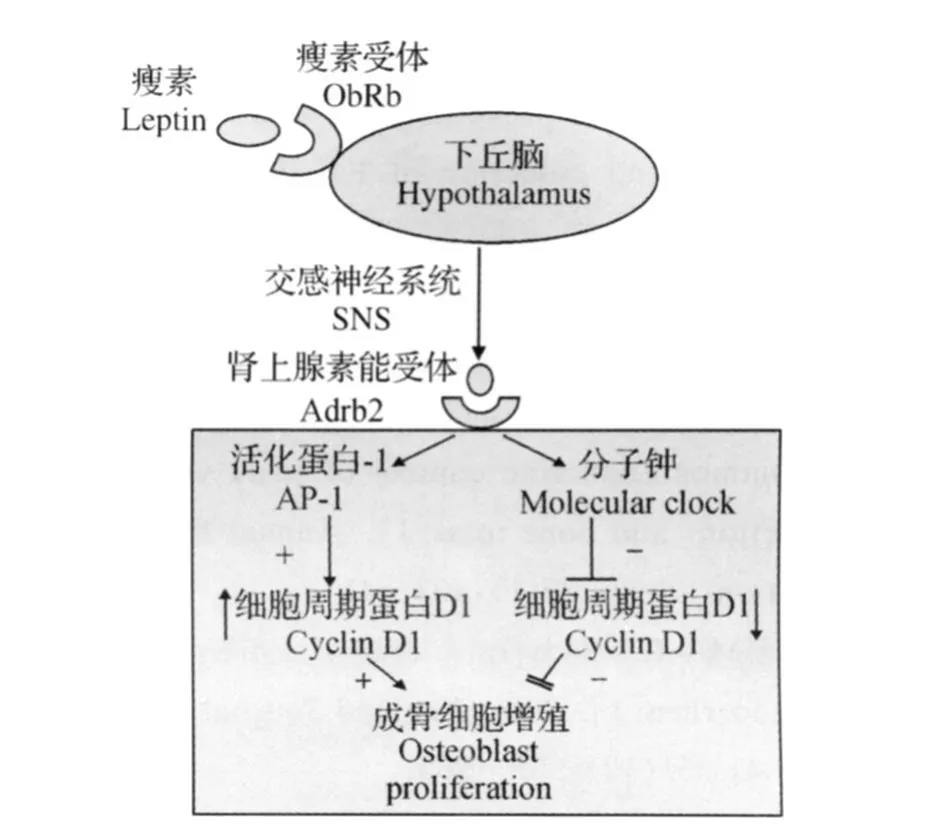
图2 leptin通过SNS-Adrb2对成骨细胞增殖的双向调节Fig.2 Bidirectional regulation o f lep tin on p ro liferation of osteob last through SNS-Ad rb2
5 脂肪组织分泌的lep tin对骨骼代谢的调控
血液循环中的leptin主要来源于脂肪细胞, Elef teriou等[25]通过原位杂交技术发现小鼠下丘脑表达的lep tin极少,脑脊液中的lep tin主要来源于血液,通过转基因手段提高血清leptin水平导致骨量降低,当过量表达lep tin受体降低血清lep tin水平之后骨量升高,从而证明调控骨骼代谢的leptin来源于外周脂肪组织分泌的leptin,而并不是大脑分泌的lep tin。Prouteau等[26]对举重运动员的研究表明,与正常状态相比,赛前体重减少导致血清leptin水平降低64%,赛后体重恢复后血清leptin水平升高276%,期间血清leptin水平的变化伴随着骨吸收参数的显著变化。因此,由外周脂肪组织分泌的lep tin是下丘脑中枢神经系统调控骨骼代谢的重要来源。
6 小 结
综上可知,脂肪组织分泌的lep tin是通过中枢神经系统对骨骼代谢进行调节的,但是leptin对成骨细胞和破骨细胞的功能均具有正负2方面的调控,正确认识其中的信号转导途径对于治疗骨骼代谢疾病具有非常重要的作用。
[1] NAKAM URA T,IMA I Y,MATSUMOTO T, et al.Estrogen prevents bone loss via estrogen recep torαand induction o f Fas ligand in osteoclasts [J].Cell,2007,130(5):811-823.
[2] RA ISZ L.Screening for osteoporosis[J].New England Journal of M edicine,2005,353(2):164-171.
[3] TAKEDA S,ELEFTERIOU F,KARSENTY G. Comm on endocrine con tro l of body weight,reproduction,and bone mass[J].Annual Review of Nutrition,2003,23(1):403-411.
[4] AH IMA R.Body fat,lep tin,and hypothalam ic amenorrhea[J].New England Journal of Medicine, 2004,351(10):959-962.
[5] SPIEGELMAN B,FLIER JS.Obesity and the regulation of energy balance[J].Cell,2001,104(4): 531-543.
[6] RAVN P,CIZZA G,BJARNASON N,et al.Low body mass index is an im portant risk factor for low bonem ass and increased bone loss in early postmenopausalw omen[J].Journal of Bone and M ineral Research,1999,14:1622-1627.
[7] DUCY P,AM LING M,TAKEDA S,et al.Lep tin inhibits bone form ation through a h ypothalam ic relay:a central control o f bonem ass[J].Cell,2000, 100(2):197-207.
[8] RIGGS B.The mechanisms of estrogen regulation of bone resorp tion[J].Journal of Clinical Investigation,2000,106(10):1203-1204.
[9] TORLONTANO M,CH IOD IN I I,PILERI M, et al.A ltered bonem ass and turnover in fem ale patients w ith adrenal incidentaloma:the ef fect o f subclinical hypercortiso lism[J].Journal of Clinical Endocrinology&Metabolism,1999,84(7):2381-2385.
[10] EYRE D,DICKSON I,VAN NESS K.Collagen cross-linking in human bone and articular cartilage. Age-related changes in the content of m ature h ydroxypyridinium residues[J].Biochem ical Journal,1988,252(2):495-500.
[11] THOMAS T,GOR I F,KHOSLA S,et al.Lep tin acts on human m arrow stromal cells to enhance differentiation to osteob lasts and to inhibit differentiation to adipocytes[J].Endocrinology,1999,140 (4):1630-1638.
[12] CORNISH J,CALLON K,BAVA U,et al.Lep tin directly regu lates bone cell functionin vitroand reduces bone fragilityin vivo[J].Journal of Endocrinology,2002,175(2):405-415.
[13] TAKEDA S,ELEFTERIOU F,LEVASSEUR R, et al.Leptin regulates bone form ation via the sympathetic nervous system[J].Cell,2002,111(3): 305-317.
[14] SH I Y,YADAV V,SUDA N,et al.D issociation o f the neuronal regulation of bone m ass and energy metabolism by leptinin vivo[J].Proceedings of the National A cademy of Sciences of the United States o f America,2008,105(51):20529-20533.
[15] ELEFTERIOU F,AHN J,TAKEDA S,etal.Leptin regu lation of bone resorp tion by the sympathetic nervous system and CART[J].Nature,2005,434: 514-520.
[16] POGODA P,EGERMANN M,SCHNELL J,et al. Lep tin inhibits bone formation not only in rodents, but also in sheep[J].Journal o f Bone and M ineral Research,2006,21:1591-1599.
[17] BRAY G,YORK D.The MONA LISA hypothesis in the tim e o f lep tin[J].Recent Progress in Hormone Research,1998,53:95-117.
[18] MOORE R E,SM ITH C K,BA ILEY C S,et al. Characterization of beta-adrenergic receptors on rat and human osteoblast-like cells and demonstration that beta-recep tor agonists can stimu late bone resorp tion in organ cu lture[J].Bone M iner,1993, 23:301-315.
[19] BOUXSEIN M,DEVLIN M,GLATT V,et al. M ice lackingβ-adrenergic receptors have increased bone mass but are not p rotec ted from deleterious skeletal effects of ovariectom y[J].Endocrinology, 2009,150(1):144-152.
[20] REID I,LUCAS J,WATTIED,etal.Ef fec ts of a β-b locker on bone turnover in normal postmenopausalw om en:a random ized controlled trial[J].Journal of Clinical Endocrinology&Metabolism,2005, 90(9):5212-5216.
[21] SCHLIENGER R,KRAENZLIN M,JICKS,et al. Use ofβ-b lockers and risk o f fractures[J].The Journal of American M edical Association,2004,292 (11):1326-1332.
[22] PASCO J,HENRY M,SANDERS K,et al.β-adrenergic blockers reduce the risk of frac ture partly by increasing bonem ineral density:geelong osteoporosis study[J].Journal o f Bone and M ineral Re-search,2004,19:19-24.
[23] FU L,PATELM,BRADLEY A,et al.Themo lecu lar clock mediates lep tin-regulated bone formation [J].Cell,2005,122(5):803-815.
[24] GRIGORIADIS A,WANG Z,WAGNER E.Fos and bone cell development:lessons from a nuclear oncogene[J].Trends in Genetics,1995,11(11): 436-441.
[25] ELEFTERIOU F,TAKEDA S,EBIHARA K, et al.Serum leptin level is a regulator of bonem ass [J].Proceedings o f the National A cademy of Sciences of the United States o f America,2004,101 (9):3258-3263.
[26] PROUTEAU S,BENHAMOU L,COURTEIX D. Relationships betw een serum leptin and bone m arkers during stable w eight,w eight reduction and weight regain in male and fem ale judoists[J].European Journal of Endocrinology,2006,154(3): 389-395.
*Correspond ing au thor,p rofessor,E-m ail:chendwz@sicau.edu.cn
(编辑 菅景颖)

