低聚木糖对草鱼非特异性免疫功能的影响
庞丽姣 吴志新 熊 娟 张 朋 余剑敏 曲 艺 何超军 杨 丽 陈孝煊
(华中农业大学水产学院,武汉 430070)
低聚木糖对草鱼非特异性免疫功能的影响
庞丽姣 吴志新*熊 娟 张 朋 余剑敏 曲 艺 何超军 杨 丽 陈孝煊
(华中农业大学水产学院,武汉 430070)
本试验旨在研究低聚木糖对草鱼非特异性免疫功能的影响。将525尾规格、体重基本一致的健康草鱼随机分为5组(每组设3个重复,每个重复 35尾),分别饲喂在基础饲料中添加 0(A0组)、1(A1组)、2(A2组)、4(A3组)和6 g/kg(A4组)低聚木糖的饲料。分别于试验第0天、第7天、第14天、第28天、第56天检测草鱼血液中白细胞吞噬活性,血清溶菌酶、超氧化物歧化酶活性和补体C3含量。在养殖试验(56 d)结束后连续攻毒14 d,计算各组试验鱼攻毒后死亡率。结果表明,与对照组相比,在整个试验期内,各试验组草鱼的各项免疫指标均有不同程度的提高。其中,A3组的白细胞吞噬活性,血清溶菌酶、超氧化物歧化酶活性和补体C3含量均显著高于A0组(P<0.05),并分别于第28天、第28天、第 7天、第28天达到最大值,而且其攻毒后死亡率最低。结果提示,饲料中添加低聚木糖可提高草鱼非特异性免疫功能,其最佳添加量为4 g/kg。
低聚木糖;草鱼;非特异性免疫功能
近年来,随着鱼类大规模集约化养殖的发展,病害也越来越严重。因此,水产动物的疾病防治及健康养殖已越来越受到人们的关注。药物防治只是暂时性的应急手段,广谱抗生素杀死或抑制了药敏细菌而保留了耐药的致病菌,破坏或干扰了鱼体或水体原有正常微生物区系的生态平衡,从而增加了水产养殖动物感染病菌的机会[1-2]。并且,抗生素在水产养殖动物体内的残留最终会对人体产生危害。因此,世界上许多国家致力于寻找和开发更为安全有效的动物促生长剂和保健剂。
功能性寡糖(functional oligosaccharides)是一种新型饲料添加剂,其常用的主要有果寡糖(fructooligosaccharides)、低聚木糖(xy lo-oligosaccharides)、甘露寡糖(m annan-oligosaccharides)、寡葡萄糖(gluco-oligosaccharides)、半乳寡糖(galactooligosacchharides)等。功能性寡糖的作用主要有:1)选择性地增殖肠道有益菌,使肠道有益菌形成竞争优势;2)作为肠道病原微生物的凝集源,阻止病原菌在肠道的黏附;3)作为免疫源引起动物自身免疫应答反应,提高动物自身免疫力[3]。作为一种高效安全的饲料添加剂,功能性寡糖的研究与应用近年来受到广泛的关注。低聚木糖又称木寡糖,是以木聚糖为底物通过内切木聚糖酶水解木聚糖的 β-1,4糖苷键而得到的以木二糖、木三糖为主要成分的低聚木糖混合物。低聚木糖是植物半纤维素的重要成分,一般占到植物干重的7%~30%,而在如小麦、甘蔗、棉花等一些1年生植物的籽壳中,低聚木糖含量高达30%以上[4-6]。低聚木糖作为一种新型的绿色添加剂,具有稳定性好、用量小及来源丰富等特点,其对双歧杆菌等有益菌有高选择性增殖,提高机体免疫力及促进生长等作用。目前,低聚木糖在水产动物方面的研究较少,尤其是低聚木糖对鱼体非特异性免疫功能方面的研究。草鱼是我国主要养殖鱼类,但其抗病力差,与草鱼相关的疾病很多,严重制约其养殖。本试验以草鱼为研究对象,研究低聚木糖对草鱼非特异性免疫功能的影响,为其在水产健康养殖中的应用提供参考。
1 材料与方法
1.1 试验鱼及试验条件
试验鱼购自武汉市水产良种站,选择体质健壮、无病无伤、规格基本一致的体重在50 g左右的草鱼(Ctenopharyngodon idellus)。试验鱼饲养于华中农业大学水产养殖基地,水缸体积为300 L,采用流水养殖,全天24 h充氧。试验鱼用1%的食盐水消毒,驯养14 d后,开始正式试验。每日按体重的3%~5%投喂2次(09:00和16:00),整个试验期间水温为22~28℃,pH为6.4~7.0。
1.2 试验设计
取规格、体重基本一致的健康草鱼525尾,随机分为5组,每组设3个重复,每个重复35尾。对照组(A0组)投喂基础饲料,试验组分别饲喂在基础饲料中添加1(A1组)、2(A 2组)、4(A 3组),6 g/kg(A4组)低聚木糖的饲料,试验进行56 d。低聚木糖购自于山东龙力生物有限公司,浓度≥95%。基础饲料组成及营养水平见表1。

表1 基础饲料组成及营养水平(风干基础)Tab le 1 Com position and nutrient levels of basal diet(air-dry basis) %
1.3 测定指标与方法
1.3.1 样品采集
试验开始和结束时称重,计算各组试验鱼的增重率和饲料系数。分别于试验前(第0天)和试验开始后第7天、第14天、第28天和第 56天从各组随机取5尾鱼,尾静脉采血,将所得的血液分为2份,其中一份用肝素抗凝,用于白细胞吞噬活性的测定;另一份首先在室温下静置1 h待其凝固后,置4℃冰箱4 h,以2 000 r/m in离心15m in,收集血清,供测定血清溶菌酶、超氧化物歧化酶(SOD)活性和补体C3含量。血清溶菌酶活性参照周显青等[7]的方法测定,超氧化物歧化酶活性采用南京建成生物研究所生产的试剂盒测定,补体C3含量采用上海玉兰生物技术有限公司生产的试剂盒测定。
1.3.2 白细胞吞噬活性的测定
将金黄色葡萄球菌(Staphylococcus aureus)接种在淡水鱼类琼脂培养基(FW A)上,37℃培养36 h,集菌,并用无菌生理盐水离心洗涤2次,制成菌悬液(1.0×108CFU/m L)。在金黄色葡萄球菌悬液中加入终浓度为0.5%的福尔马林,37℃灭活24 h。将用福尔马林灭活的金黄色葡萄球菌菌体作为本试验中的吞噬原。经过平皿法证实此菌已被彻底灭活后,置4℃冰箱中保存备用。
在0.25m L抗凝血中加入0.1m L浓度为1×108CFU/m L的菌悬液,摇匀后置于28℃恒温水浴锅中,孵育1 h。每个血样做血涂片5张,自然晾干,甲醇固定,姬姆萨(Giemsa)染色2 h,水洗晾干后置油镜下观察计数,并按下式计算白细胞吞噬百分比(phagocytic percentage,PP)和吞噬指数(phagocytic index,PI)。
吞噬百分比(PP,%)=(100个白细胞中参与吞噬的细胞数/100)× 100;
吞噬指数(PI)=被吞噬的细菌数/吞噬细菌的细胞数。
1.3.3 攻毒后的死亡率
饲养试验结束时,各组取40尾鱼进行攻毒,按每千克体重1.0×108CFU的注射量(剂量据预试验而定),经胸鳍基部注射病原性嗜水气单胞菌(Aeromonas hydrophia)活菌,饲养观察 14 d。记录感染鱼的发病和死亡情况,对死亡鱼进行解剖、细菌分离并确认死因,统计各组的死亡率。
1.4 数据统计与分析
试验数据以平均值±标准差表示,采用STATISTICA 6.0软件进行统计分析,组间差异采用Duncan氏多重比较,显著水平为P<0.05。
2 结 果
2.1 低聚木糖对草鱼生长性能的影响
由表2可知,低聚木糖能不同程度的提高草鱼的生长性能。其中,A3组增重率显著高于对照组(P<0.05);各试验组饲料系数均低于对照组,且A2组、A3组与对照组差异达显著水平(P<0.05)。

表2 低聚木糖对草鱼生长性能的影响Tab le 2 Effects of xylo-oligosaccharides on growth perform ance of grass carp
2.2 低聚木糖对草鱼白细胞吞噬活性的影响
由表3可知,在试验第0天和第7天,白细胞吞噬百分比各组间无显著差异(P>0.05);在试验第14天、第 28天和第56天,除第14天的A1组和A4组外,各试验组的白细胞吞噬百分比均较对照组显著提高(P<0.05)。在试验第0天和第14天,白细胞吞噬指数各组间无显著差异(P>0.05);在试验第28天和第56天,各试验组的白细胞吞噬指数均较对照组有所提高,且第28天的A3组和第56天的A3、A4组还达到了显著水平(P<0.05)。此外,各组的白细胞吞噬百分比和吞噬指数均在第28天达到最大值。
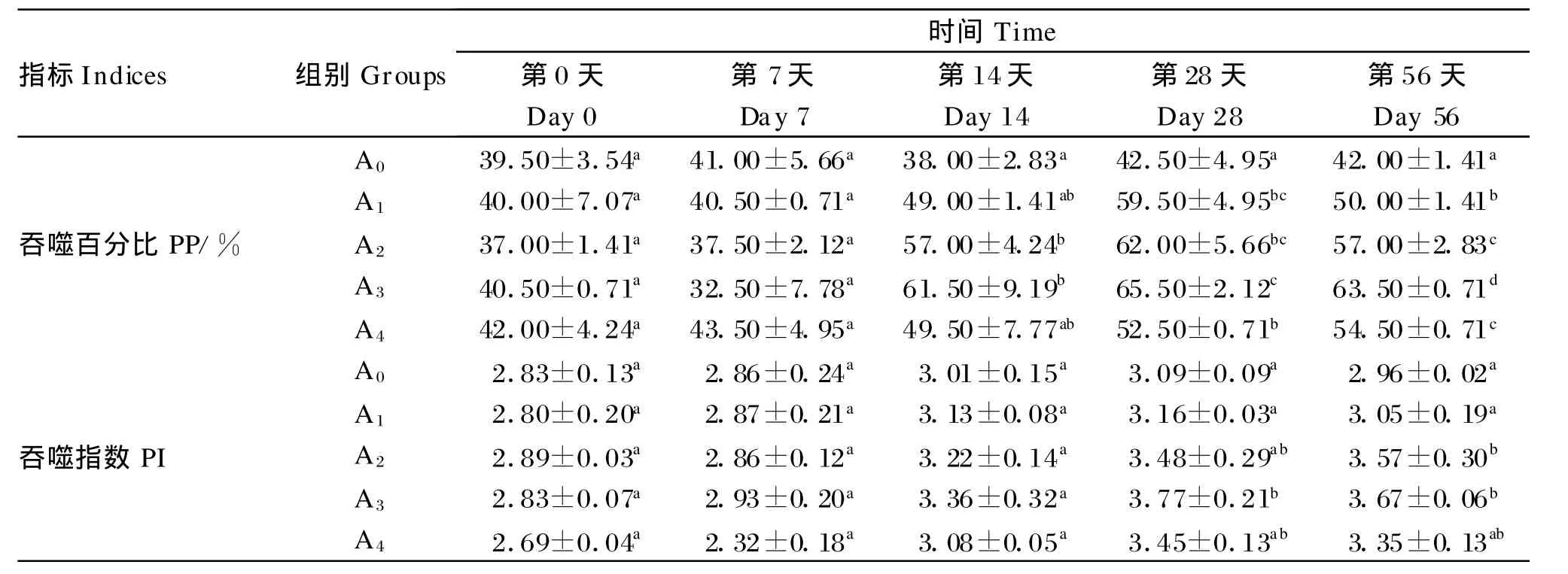
表3 低聚木糖对草鱼白细胞吞噬活性的影响Tab le 3 Ef fects of xylo-oligosaccharides on leucocyte phagocy tic activity of grass carp
2.3 低聚木糖对草鱼血清溶菌酶活性的影响
由表4可知,在试验第 7天、第 14天、第 28天和第56天,A3组的血清溶菌酶活性均显著高于对照组(P<0.05),同时也高于其他试验组,并与第7天的A1组、第14天的其他各试验组、第56天的A2组达到显著水平(P<0.05)。此外,在整个试验期内,各组的血清溶菌酶活性均出现先升高后降低的趋势,并均在第28天达到最高值。
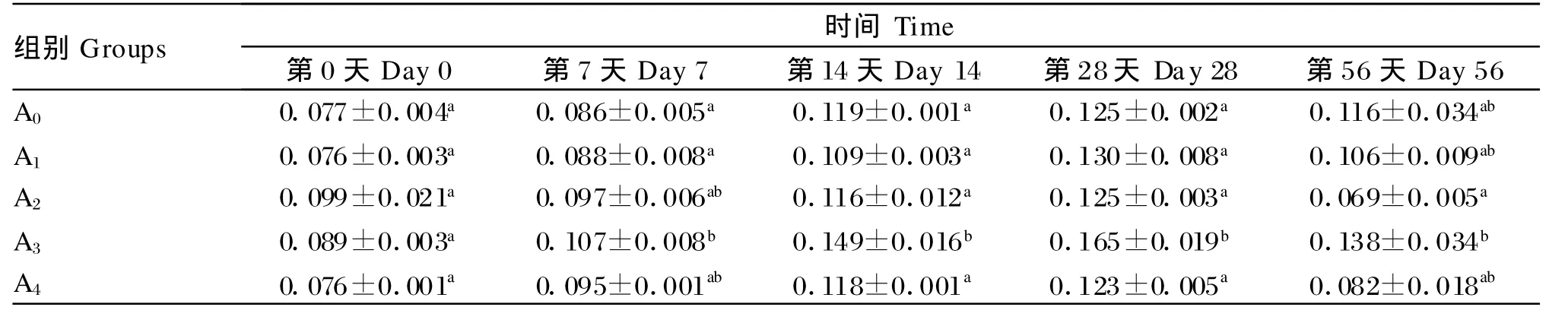
表4 低聚木糖对草鱼血清溶菌酶活性的影响Table 4 Effects of xylo-oligosaccharides on lysozym e activity in serum of grass carp
2.4 低聚木糖对草鱼血清超氧化物歧化酶活性的影响
由表5可知,在试验第7天和第28天,各试验组的血清超氧化物歧化酶活性均显著高于对照组(P<0.05);在试验第14天,A2组和A3组的血清超氧化物歧化酶活性均显著高于对照组(P<0.05);在试验第56天,A1组、A2组和A3组的血清超氧化物歧化酶活性均显著高于对照组(P<0.05)。在整个试验期内,A 2组和A3组的血清超氧化物歧化酶活性在各试验组间均一直处在较高水平。此外,在整个试验期内,各组的血清超氧化物歧化酶活性均出现先升高后降低的趋势,其中A2组在第14天达到最高值,A3组在第7天达到最高值。

表5 低聚木糖对草鱼血清超氧化物歧化酶活性的影响Table 5 Effects of xylo-o ligosaccharides on superoxide dism utase activity in serum of grass carp U/m L
2.5 低聚木糖对草鱼血清补体C3含量的影响
由表6可知,在整个试验期内,A2和A3的血清补体C3含量均显著高于对照组(P<0.05),同时其在各试验组间也一直处在较高水平。此外,在整个试验期内,各组的血清补体C3含量均出现先升高后降低的趋势,且A2组和A3组均在第28天达到最高值。
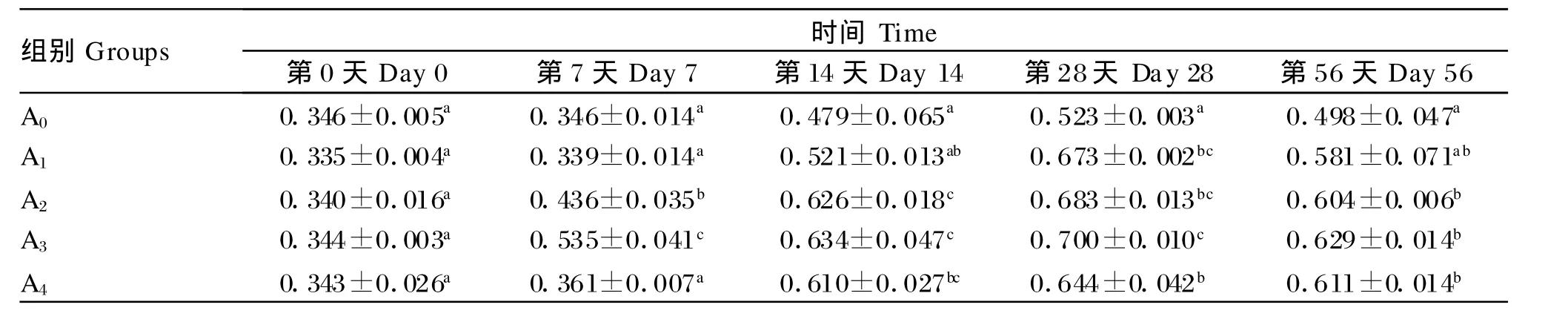
表6 低聚木糖对草鱼血清补体C3含量的影响Table 6 Ef fec ts of xy lo-oligosaccharides on complement C3 conten t in serum of grass carp g/L
2.6 攻毒后的死亡率
试验鱼经嗜水气单胞菌活菌攻毒14 d后,投喂基础饲料的对照组和投喂添加1 g/kg低聚木糖饲料的A1组草鱼死亡率最高,均达到47.5%;其次是投喂添加 6 g/kg低聚木糖饲料的 A4组,为40.0%;投喂添加2和4 g/kg低聚木糖饲料的试验组(A2组和A3组)死亡率较低,分别为32.5%和27.5%。
3 讨 论
白细胞的吞噬功能是动物非特异性免疫的重要组成部分,因此,通过测定血液中白细胞的吞噬功能,可以反映机体的非特异性免疫状态[8],水产动物体内的溶菌酶也是一种重要的非特异性防御因子,是鱼体生理防御水平的一个重要标志,还可以反映病原菌及其他环境因素对鱼体健康的影响[9]。溶菌酶活性提高,表明吞噬细胞活性增加,鱼类的非特异性免疫功能增强。同时,已有研究发现,超氧化物歧化酶活性与生物的免疫水平密切相关,因此,超氧化物歧化酶活性可作为机体非特异性免疫指标来评判免疫刺激剂对机体非特异性免疫功能的影响[10]。补体是机体抵抗微生物感染的重要成分,具有独特的理化性质,激活后具有细胞溶解、细胞黏附、调理、免疫调节、介导炎症反应、中和毒素、免疫复合物溶解和清除等重要的生物学效应,而C3又是补体系统的主要成分[11]。因此本试验选择测定上所述几种指标作为分析鱼类非特异性免疫的指标。
有研究指出,低聚木糖可通过对动物肠道内双歧杆菌的高选择性增殖作用,减少肠道内有害菌的数目,促进肠道理想微生态的形成[12]。Moura等[13]报道,在断奶仔猪饲粮中添加低聚木糖可提高肠道内容物中的双歧杆菌和乳酸杆菌数量。双歧杆菌具有较强的免疫活性,有益菌的增殖可以促进吞噬细胞的吞噬活性,从而增强机体免疫功能。本试验结果表明,当草鱼饲料中低聚木糖添加量为4 g/kg时,其血清溶菌酶、超氧化物歧化酶活性均从第7天开始显著高于对照组,并且血清溶菌酶活性于第28天达到最大值,血清超氧化物歧化酶活性在第7天达到最大值,白细胞吞噬百分比从第14天开始显著高于对照组。当草鱼饲料中低聚木糖添加量为添加量为2和4 g/kg时,其血清补体C3含量从第7天开始显著高于对照组。有研究表明,甘露寡糖能显著提高非洲鲶鱼(Clarias gariepinus)的嗜中性白细胞活性[14],提高鲑鱼(Salmo salar)苗抗鲑气单胞菌的能力[15],提高奥尼罗非鱼(Oreochromisniloticus×O.aureus)的非特异性免疫功能[16]。张红梅[17]在鲤(Cyprinus carpio)的饲料中添加甘露寡糖,随着添加比例的增加,鲤血清溶菌酶和超氧化物歧化酶活性增加,其中0.3%的甘露寡糖的添加量效果最好。有结果表明,在基础饲料中添加一定量的果寡糖,能提高银鲫(Carassius auratus)[18]和中华鳖(Trionyx sinensis)幼鳖[19]白细胞吞噬活性、血清溶菌酶活性、血清超氧化物歧化酶活性和血清补体C3的含量。上述研究结果均与本试验结果一致。研究报道,功能性低聚糖可促进动物生长,提高饲料利用率[16-17,20],本试验中添加不同水平的低聚木糖能不同程度的提高草鱼的生长性能,也验证了这一点。此外,本试验中低聚木糖添加量为4 g/kg时的生长性能最佳,这与非特异性免疫功能提高的程度成正相关,说明低聚木糖通过提高鱼体非特异性免疫功能来促进生长性能。
本研究结果还显示,当低聚木糖的添加量为6 g/kg时,各免疫指标活性较添加量为2、4 g/kg时有所下降,原因可能是过量的低聚木糖限制了肠道部分有益菌的增殖,从而影响了机体的免疫功能。当添加量为1 g/kg时,各项免疫指标活性与对照组差异不显著,原因可能是添加量不足,起不到增加有益菌增殖的效果,进而无法达到增强机体免疫功能的作用。
4 结 论
饲料中添加低聚木糖可提高草鱼非特异性免疫功能,其最佳添加量为4 g/kg。
[1] HSU C H,HW ANG S C,LIU JK.Succession of bacterial d rug resistance as an indicator of antibiotic app lication in aquaculture[J].Journal of the Fisheries Society of Taiw an,1992,19(11):55-64.
[2] LI J,Y IE J,FOO R W T,et al.Antibiotic resistance and plasm id profiles ofVibrioisolates from cultured silver sea bream,Sparus sarba[J].Marine Po llution Bu lletin,1999,39:245-249.
[3] 杨曙明.寡糖在动物营养研究中的进展[J].动物营养学报,1999,11(1):1-9.
[4] 洪丰,钱林,丁长河,等.低聚木糖分离纯化技术的研究概述[J].农产品加工学刊,2006(10):64-66.
[5] MAALEJ-ACHOURI I,GUERFALI M,GARGOURI A,et al.Production of xylo-oligosaccharides from agro-industrial residues using immobilizedTalarom yces thermophilusxy lanase[J].Journal of Molecular Catalysis B:Enzym atic,2009,59(1/3):145-152.
[6] PRADE R A.Xylanases:from biology to biotechno logy[J].Biotechnology and Genetic Engineering Reviews,1995,13(2):101-131.
[7] 周显青,牛翠娟,孙儒泳.维生素C和E合用对中华鳖幼鳖非特异性免疫功能的影响[J].水生生物学报,2004,28(4):356-360.
[8] CHEN D,AINSWORTH A J.Glucan adm inistration potentiates immune de fence mechanisms of channel catfish,Lctalurus punctatusRafinesque[J].Journal of Fish Diseases,1992,15(4):295-304.
[9] DUN IER M,SIWICKI A K,DEMAELA A.Ef fec ts of organophosphorus insecticides:ef fects of trichlorfon and dichlorvos on the immune response of carp(Cyprinus carpio).Ⅲ.In vitroe ffects on lym phocy te p roliferation and phagocytosis andin vivoef fects on humoral response[J].Ecotoxicology and Environmental Safefy,1991,22:79-87.
[10] 李桂峰,钱沛锋,孙际佳,等.维生素C对胡子鲶血清免疫相关酶活性的影响[J].大连水产学院学报,2004,19(4):301-305.
[11] 聂芬,石小涛,李大鹏,等.拥挤胁迫对史氏鲟稚鱼血浆溶菌酶活性和补体水平的影响[J].水生生物学报,2007,31(4):581-584.
[12] ROBERFROID M B,VANLOO JA E,GBSON G R.The bifidogenic nature of chicory inulin and its hyd ro lysis products[J].Journal of Nutrition,1998,128:11-19.
[13] MOURA P,MARQUESS,ALVES L,etal.Effect of xylo-oligosaccharides from corn cobs autohydrolysis on the intestinalm icrobiota of piglets after w eaning[J].Livestock Science,2007,108(1):244-248.
[14] YOSH IDA T,KRUGER R,INGLIS V.Augention of nonspecific p rotection in African catfish,Clarias gariepinus(Burchell),by the long-term oral adm inistration of imm unostim ulants[J].Journal of Fish D iseases,1995(18):195-198.
[15] NEWMAN K.Mannan-o ligosaccharides:natural polym ers with significant impac ton the gast-rointestinalm icroflora and immune system[C]//LYONS T P,JACQUES K A.Biotechno logy in feed industry:p roceedings of A lltech's tenth annual sym posium.Nottingham:Nottingham University Press,1994:167-174.
[16] 刘爱君,冷向军,李小勤,等.甘露寡糖对奥尼罗非鱼(Oreochrom is niloticus×O.aureus)生长、肠道结构和非特异性免疫的影响[J].浙江大学学报:农业与生命科学版,2009,35(3):329-336.
[17] 张红梅.甘露寡聚糖对鲤鱼生产性能及对鲤鱼各项生化指标的影响[D].硕士学位论文.保定:河北农业大学,2003.
[18] 王艳,吴志新,庞素风,等.果寡糖对银鲫非特异性免疫功能的影响[J].水生生物学报,2008,32(4):488-492.
[19] 季高华,刘至治,冷向军.饲料中添加 β-葡聚糖和低聚果糖对中华鳖幼鳖生长和血清SOD、溶菌酶活力的影响[J].上海水产大学学报,2004,3(1):36-41.
[20] 明建华,刘波,周群兰,等.功能性寡糖在水产动物饲料中的应用[J].水产科学,2008,27(9):490-493.
*Correspond ing au thor,associate professor,E-mail:wuzhixin@m ail.hzau.edu.cn
(编辑 菅景颖)
Effectsof Xylo-oligosaccharides on Non-specific Immune Function of Grass Carp(Ctenopharyngodon idellus)
PANG Lijiao WU Zhixin*XIONG Juan ZHANG Peng YU Jianm in QU Yi HE Chaojun YANG Li CHEN Xiaoxuan
(College of Fisheries,Huazhong Agricultu ral University,Wuhan430070,China)
This experim ent was conducted to study the e ffects of xylo-o ligosaccharides on non-specific immune func tion of grass carp(Ctenopharyngodon idellus).Five hundred and tw enty-five healthy grass carp with basically the same size and body w eight were random ly assigned to 5 groupswith 3 replicates in each group and 35 fish in each replicate.G rass carp in 5 groupswere fed with the basal diets supplemented with 0(group A0),1(group A1),2(group A2),4(group A3)and 6 g/kg(group A4)xylo-oligosaccharides,respectively.The activities of blood leukocyte phagocytic,serum lysozym e,and serum superoxide dismutase,and the content of serum comp lement C3were determ ined on day 0,7,14,28 and 56,respectively.Calculating themortality after 14 d of challenge test when the culture experim ent(lasted for 56 d)w as finished.The results show ed that the immune indices of experimental groups were enhanced compared with the control group in the wholeexperiment.Among them,the leukocyte phagocy tic activity,serum lysozyme activity,serum superoxide dismutase activity and serum comp lement C3content in group A3were significantly higher than those in the controlgroup(P<0.05),w hich reached to the top level on day 28,28,7,28 of the experiment,respec tive ly.The group A3also had the low estmortality rate among the 5 groups.These resu lts indicate that xylo-o ligosaccharides can enhance the non-specific immune function of grass carp,and the optimum addition level is 4 g/kg.[Chinese Journal of Anima l Nutrition,2010,22(6):1687-1693]
xylo-oligosaccharides;grass carp(Ctenopharyngodon idellus);non-specific imm une function
S963
A
1006-267X(2010)06-1687-07
10.3969/j.issn.1006-267x.2010.06.032
2010-06-23
国家科技支撑计划项目(2007BAD 37B02);湖北省“十一五”科技攻关项目(2006AA 203A 02,2007AA 203A01)
庞丽姣(1985—),女,湖北孝感人,硕士研究生,研究方向为鱼类营养与免疫。E-mail:plijiao16383@126.com
*通讯作者:吴志新,副教授,硕士生导师,E-mail:wuzhixin@m ail.hzau.edu.cn

