饲料脂肪水平和复合降脂因子对罗非鱼生长性能和肝胰脏代谢、抗氧化指标的影响
林仕梅 罗 莉
(西南大学动物科技学院,淡水生物生殖与发育教育部重点实验室,重庆 400716)
高密度精养模式的可持续发展,要求采用以高脂肪提供能量来节约蛋白质的策略,进而达到降低氮、磷排放,保护养殖水环境的目的。但当饲料中脂肪水平超过需求量时,会导致鱼体的脂肪沉积增加,从而影响水产品品质和货架寿命,严重时甚至会导致大量脂肪在鱼肝细胞内堆积,引起肝细胞变性、坏死,导致肝功能下降甚至衰竭,最后引起鱼发病甚至死亡[1]。近年来,鱼粉价格居高不下,植物性蛋白源在罗非鱼养殖中的使用量不断加大,植物性蛋白源的不合理或大量使用会对罗非鱼肝脏的生理机能带来负面影响[2],使其处于亚健康状态,从而影响其正常的生长。因此,如何保证养殖水产动物肝脏的健康,则成为动物营养学家和饲料生产者面临的又一个难题。目前有关水产养殖动物抗脂肪肝物质的研究往往集中在单一物质的使用效果上[3-5],而关于牛磺酸、甜菜碱、左旋肉碱等这些抗脂肪肝物质的复合使用还未见报道。为此,本试验以奥尼罗非鱼(Oreochrom is niloticus×O.aureus)为试验对象,在实用饲料配方的基础上,进一步探讨复合降脂因子对罗非鱼生长和健康的影响,以便为防治鱼类营养性脂肪肝提供理论依据和解决方案。
1 材料和方法
1.1 试验饲料
在实用饲料配方的基础上,通过添加豆油,配制成3种脂肪水平的等氮(粗蛋白质含量为30%)试验饲料,试验饲料1、2和3的脂肪水平分别为4.5%、6.5%和8.5%。在试验饲料3的基础上添加0.1%的复合降脂因子(牛磺酸︰甜菜碱︰左旋肉碱=3︰4︰2),并相应减少次粉的用量,配制成试验饲料4。试验饲料组成及营养水平见表1。饲料原料均粉碎过40目筛,饲料调质温度为80℃,分别制成直径为1.5 mm的硬颗粒饲料,60℃烘干后,保存于-15℃冰柜中备用。
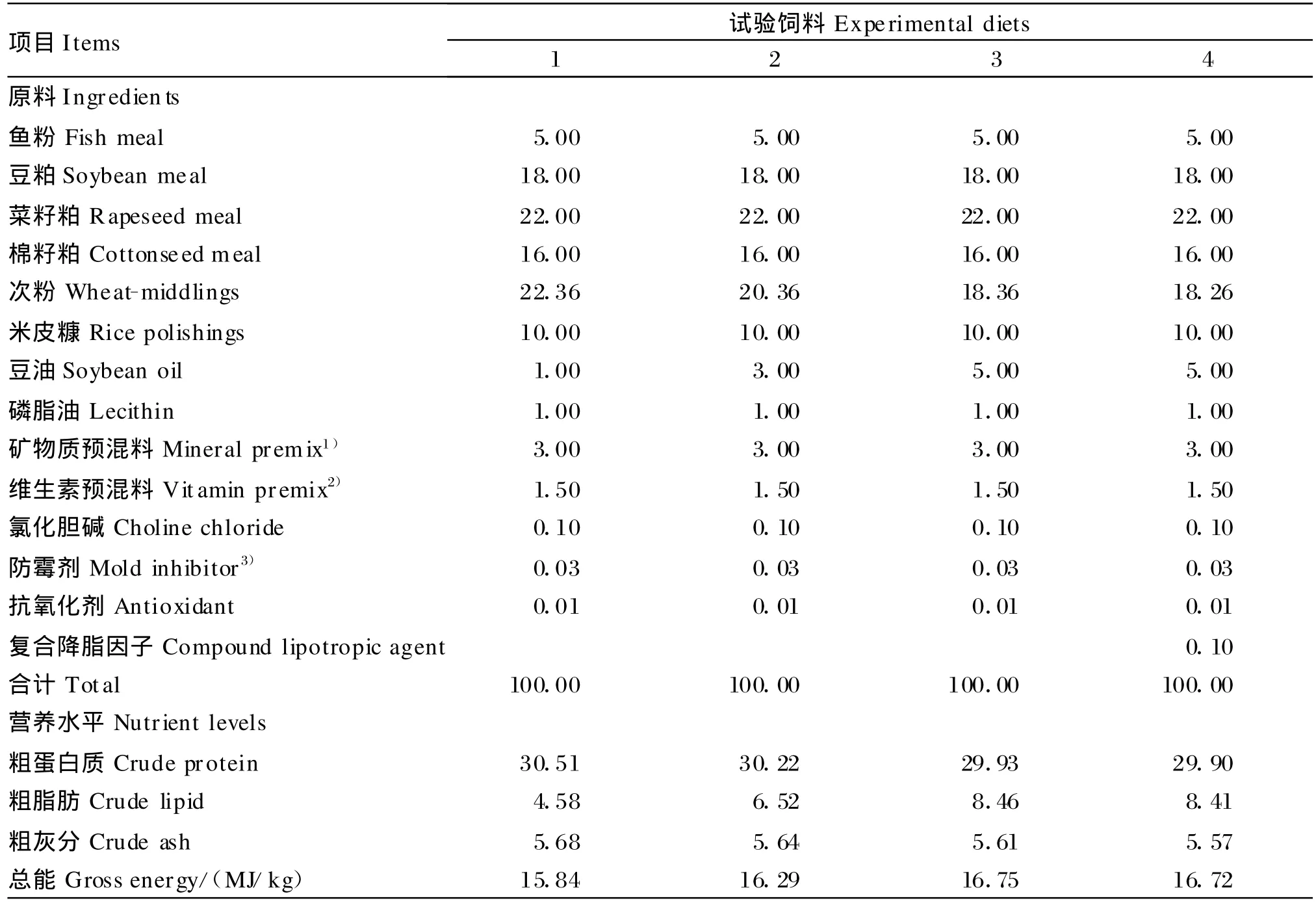
表1 试验饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimen taldiets(air-dry basis)%
1.2 试验设计与饲养管理
试验鱼选用当年培育的全雄性奥尼罗非鱼鱼苗,取自广东茂名三高鱼种场。试验鱼驯食适应环境2周后,选取体质健壮、规格整齐、平均体重为(4.21±0.09)g的奥尼罗非鱼360尾,随机分成4组,分别饲喂试验饲料1、2、3、4。每组设3个重复,每个重复30尾鱼,放养在室内淡水循环玻璃水族箱(有效体积为200 L)中,日投喂率为体重的4%~8%,每天08:00、12:00和17:00各投喂1次,每2周称重1次,调整投饲量。每天早上清除箱内粪便,并换水1/ 3。饲养时间为8周。养殖水源曝气自来水,试验期间水温为(28.3±0.8)℃,pH为7.14±0.40,溶解氧为(6.25±0.70)m g/L,氨氮为(0.05± 0.01)mg/L。
1.3 样品制备与分析
饲养试验结束后,禁食1 d后称重,每箱取3尾鱼作为全鱼体成分分析样品;另取3尾鱼采用捣毁脊髓法处死,取出肝胰脏,立即放入液氮罐中速冻,然后转入-80℃低温冰箱保存。肝胰脏匀浆液在10 000×g4℃条件下离心30 m in,取上清液作为酶活性分析样品,置-20℃冰箱待用。
饲料原料及鱼体样品均在105℃烘干至恒重,然后进行营养成分测定。采用凯氏定氮法测定样品的总氮含量,将测定结果乘以6.25即得粗蛋白质含量,粗脂肪含量采用索氏抽提法,粗灰分含量采用高温(550℃)灰化法测定[6]。
肝胰脏谷草转氨酶(GOT,EC 2.6.1.1)、谷丙转氨酶(GPT,EC 2.6.1.2)、超氧化物歧化酶(SOD,EC 1.15.1.1)、过氧化氢酶(CAT,EC 1.16.1.6)活性以及丙二醛(MDA)含量采用南京建成生物工程研究所生产的试剂盒进行测定。GOT、GPT的活性单位定义为每毫克组织蛋白与基质在37℃下作用60 m in,生成1μm ol丙酮酸所需要的酶;SOD的活性单位定义为每毫克组织蛋白在1m L反应液中SOD抑制率达50%时所反应的SOD量;CAT的活性单位定义为25℃,pH 7.0条件下,每分钟分解1μm ol过氧化氢所需的酶。蛋白质含量采用Brad ford[7]方法测定。
1.4 计算公式
特定生长率(specific growth rate,SGR,%/d)= 100×[ln末重(g)-ln初重(g)]/试验天数(d);
蛋白质效率(protein ef ficiency ratio, PER,%)=100×鱼体增重(g)/蛋白质摄人量(g);
饲料系数(feed conversion ratio,FCR)=总干物质摄食量(g)/鱼体总增重(g);
脏体比(viscerosomatic index,VSI,%)= 100×内脏重湿重(g)/鱼体重湿重(g);
肝体比(hepatosomatic index,HSI,%)= 100×肝胰脏重湿重(g)/鱼体重湿重(g)。
1.5 数据处理与分析
除成活率外,数据均以平均值±标准误表示,采用SPSS 11.0对所得数据进行单因素方差分析(One-w ay ANOVA),若差异达到显著,则进行Tukey多重比较,显著性水平为P<0.05。
2 结果与分析
2.1 饲料脂肪水平和复合降脂因子对罗非鱼生长性能的影响
由表2可知,随着饲料脂肪水平的增加,罗非鱼的SGR显著增加(P<0.05)。罗非鱼的FCR随着饲料脂肪水平的增加而降低,其中1组显著高于2组和3组(P<0.05)。罗非鱼的PER表现出与FCR相反的趋势,即随饲料脂肪水平的增加而升高,其中3组显著高于1组(P<0.05)。在8.5%脂肪水平下添加0.1%复合降脂因子后,罗非鱼的FCR显著降低(P<0.05),PER显著升高(P<0.05),SGR有上升的趋势(P>0.05)。试验期间,各试验组罗非鱼的成活率均为100%。
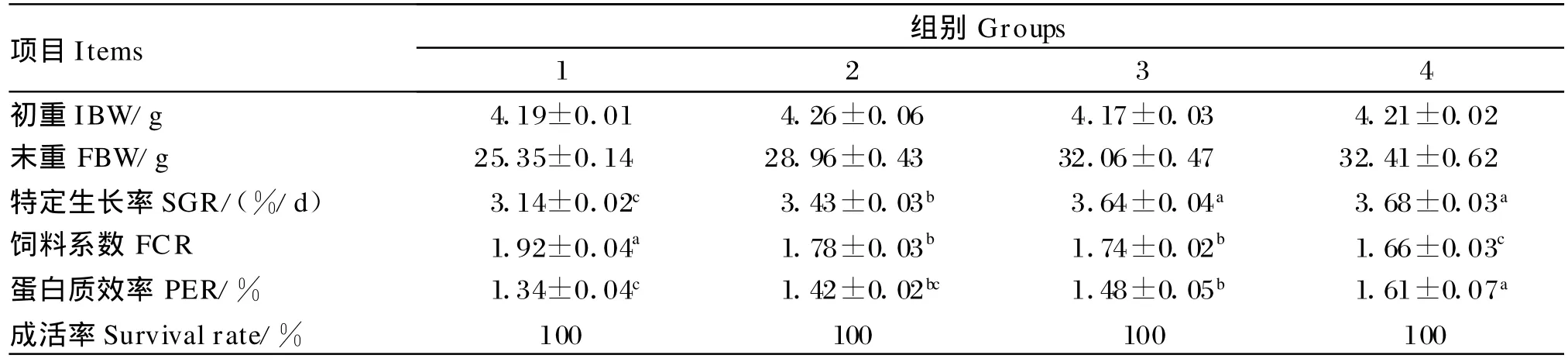
表2 饲料脂肪水平和复合降脂因子对罗非鱼生长性能的影响Table 2 Effec ts of dietary lipid level and compound lipotropic agent on grow th perform ance of tilapia
2.2 饲料脂肪水平和复合降脂因子对罗非鱼体组成的影响
由表3可知,各组罗非鱼的脏体比和肝体比均无显著差异(P>0.05)。罗非鱼的肝脂和体脂(鱼体粗脂肪)含量3组显著高于其他各组(P<0.05),而其他各组间差异不显著(P>0.05)。饲料脂肪水平和复合降脂因子对罗非鱼鱼体干物质、粗蛋白质和粗灰分含量的影响差异均不显著(P>0.05)。
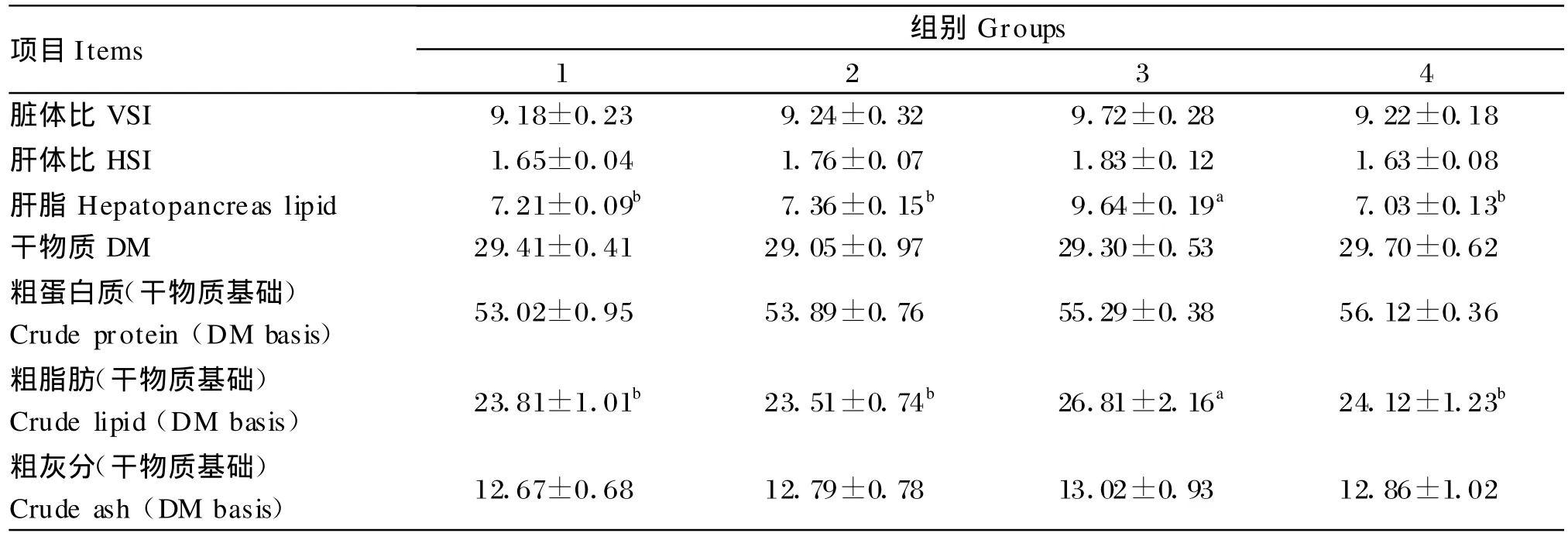
表3 饲料脂肪水平和复合降脂因子对罗非鱼体组成的影响Tab le 3 Effects of dietary lipid level and com pound lipotropic agent on body composition o f tilapia%
2.3 饲料脂肪水平和复合降脂因子对罗非鱼肝胰脏代谢、抗氧化指标的影响
由表4可知,随着饲料脂肪水平的增加,罗非鱼的肝胰脏GPT和GOT活性均显著降低(P<0.05)。在8.5%脂肪水平下添加0.1%复合降脂因子后,罗非鱼的肝胰脏GPT和GOT活性显著提高(P<0.05),并与脂肪水平为4.5%时无显著差异(P>0.05)。4组罗非鱼的肝胰脏SOD活性显著低于2组和3组(P<0.05),其他各组间差异不显著(P>0.05)。随着饲料脂肪水平的增加,罗非鱼的肝胰脏CAT活性显著升高(P<0.05)。在8.5%脂肪水平下添加0.1%复合降脂因子后,罗非鱼的肝胰脏SOD和CAT活性显著降低(P<0.05),并与脂肪水平为4.5%时无显著差异(P>0.05)。罗非鱼的肝胰脏MDA含量随着饲料脂肪水平的增加而升高,且3组显著高于1组和2组(P<0.05)。在8.5%脂肪水平下添加0.1%复合降脂因子后,罗非鱼的肝胰脏MDA含量显著降低(P<0.05),并与脂肪水平为4.5%时无显著差异(P>0.05)。
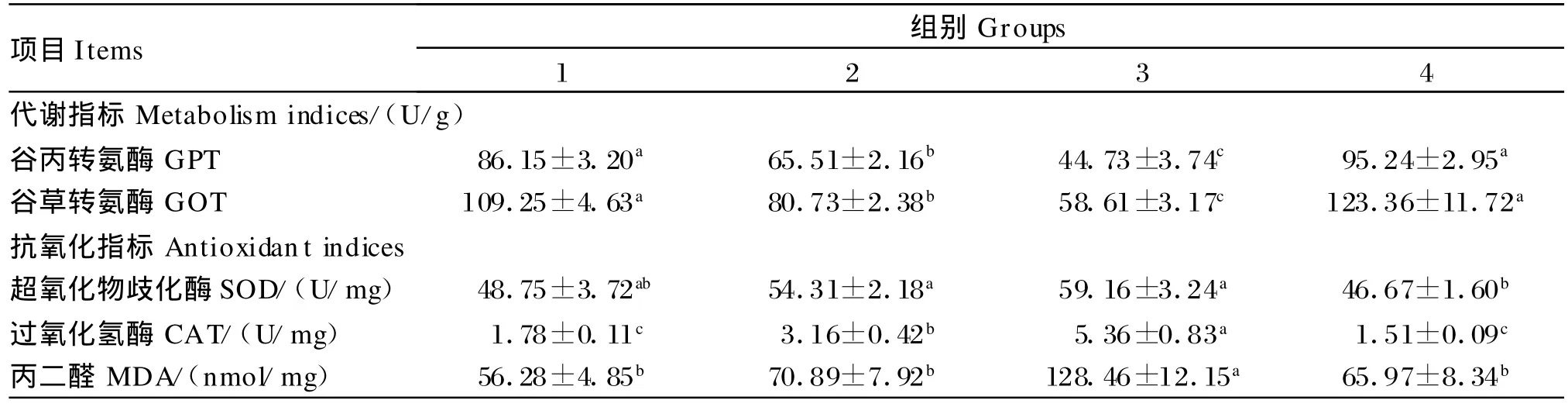
表4 饲料脂肪水平和复合降脂因子对罗非鱼肝胰脏代谢、抗氧化指标的影响Table 4 Effects of dietary lipid level and com pound lipotropic agent on indices ofm etabolic and antioxidant in hepatopancreas of tilapia
3 讨 论
本试验结果表明,随着饲料脂肪水平的增加,罗非鱼的生长性能提高,以8.5%脂肪水平生长效果最好,这与Hanley[8]的研究结果一致。Jauncey等[9]建议罗非鱼饲料中的脂肪水平为6%~10%,也有研究指出罗非鱼幼鱼饲料中适宜的脂肪水平为12%[10],而甘晖等[11]研究指出奥尼罗非鱼幼鱼饲料中适宜的脂肪水平为4%(半纯化饲料)。造成这种差异的原因可能与饲料脂肪酸组成、饲料配方、鱼类生长阶段、饲养条件等有关。本研究的试验设计立足我国的生产实际,其脂肪水平也符合罗非鱼的建议需求量。高能饲料固然能提高饲料效率,并降低氨氮、磷及有机物的排放,但容易提高动物体脂水平,降低产品品质[12]。已有研究指出罗非鱼饲料中脂肪水平达到6%时,会产生一定的蛋白质节约效应[13]。但本研究中各脂肪水平均没有表现出明显的蛋白质节约效果,仅在脂肪水平为8.5%时表现出体脂含量的提高。Han ley[8]研究指出在饲料蛋白质不缺乏的情况下,罗非鱼不能有效利用脂肪作为能源。本研究是否是因为蛋白质水平较高使得蛋白质节约效应没表现出来值得进一步探讨。此外, Chou等[10]在尼罗罗非鱼上的研究发现,高脂肪水平会降低其产脂酶的活性。
众所周知,脂肪是水产动物体内重要的贮能物质,但饲料中脂肪含量过高会导致鱼体出现脂肪肝[2]。肝脂含量的多少是反映肝健康的重要指标,本研究中高脂肪水平(8.5%)使得罗非鱼肝脂含量显著增加,尽管没有影响罗非鱼的生长性能(可能是因为本试验养殖周期仅仅为8周),但长时间饲喂不可避免的会加重肝脏负荷,降低肝的生理机能,影响养殖动物的生长性能,严重的甚至会引起鱼类死亡。鱼类的肝脂主要来自对饲料中脂肪的直接吸收以及饲料中过量蛋白质和糖类的转化合成,因此,可以通过调节和控制肝脏中脂肪的来源和去路,实现对脂肪肝的预防和治疗。目前研究发现,牛磺酸[14-15]、甜菜碱[16-17]、左旋肉碱[18]是鱼类较理想的抗脂肪肝因子,饲料中补充这些物质能够有效降低水产养殖动物肝脂含量。本试验结果表明,上述物质的复合使用亦能够有效降低罗非鱼肝脂含量,改善罗非鱼的生理机能。由于这些抗脂肪肝物质具有不同的生理生化机制以及抑制水产养殖动物脂肪肝形成的作用机理不同,因此,如何调配好这些物质来有效降低养殖动物肝脂含量,是值得进一步深入研究的问题。
当鱼类肝脏病变时(如脂肪肝),由于肝组织的损伤,导致肝细胞破坏或细胞膜通透性增加,致使肝细胞中的酶渗入血液,使血液中的酶活性增加[2]。因此,肝胰脏转氨酶活性反映了肝胰脏受损伤的程度,肝胰脏GPT、GOT活性越低,表明肝脏受损伤越严重。本试验结果表明,饲料脂肪水平增加,罗非鱼的肝胰脏GPT和GOT酶活性显著降低;在8.5%脂肪水平下添加0.1%复合降脂因子后,罗非鱼的肝胰脏GPT和GOT酶活性又显著升高(P<0.05)。这表明复合降脂因子对肝脏起到一定的保护作用,从而促进了营养物质的消化利用。
MDA是脂肪酸过氧化代谢产物,被认为是肝脏损伤的指标[19]。本试验中,脂肪水平为8.5%时罗非鱼肝胰脏的MDA含量较其他脂肪水平增加了近1倍,这表明罗非鱼肝脏脂肪过度沉积的同时大量脂肪酸发生了过氧化。鱼体内有天然的抗氧化系统去除脂肪酸氧化产物,以维持正常的生理功能,其中包括CAT、SOD等抗氧化酶[20]。动物细胞生存要求适当的氧化与抗氧化平衡,但脂肪酸被氧化的量一旦超过体内抗氧化系统的清除能力,肝脏可能产生更严重的损害。CAT和SOD分别作用于过氧化氢和超氧自由基。SOD是底物诱导酶,它的活性升高说明体内超氧自由基或羟自由基含量上升,从而导致动物体内氧化压力过大;CAT能特异性清除体内过多的过氧化氢,保护细胞免受过氧化损伤,这2种酶的测定常用于间接反映体内自由基反应的动态变化及组织损伤情况。本试验结果显示,随着饲料脂肪水平增加,罗非鱼肝胰脏SOD和CAT活性均有不同程度的升高,这表明鱼体处于氧化应激的状态。而在8.5%高脂肪水下添加0.1%复合降脂因子后,SOD和CAT活性得到显著改善,这说明复合降脂因子具有很好的抗氧化活性,推测其肝脏保护作用可能是源于其较高的体内抗氧化活性。
4 结 论
①增加饲料脂肪水平会显著提高罗非鱼的生长性能,但高脂肪水平(8.5%)会降低罗非鱼肝脏的生理机能。
②添加复合降脂因子能够显著改善罗非鱼肝脂含量和肝胰脏酶活性,继而促进生长。
③复合降脂因子可以作为一种安全高效的口服保肝剂应用于罗非鱼的养殖生产。
[1] HUNG S O.Cho line requirem ents o f hatchery-p roduced juvenile white sturgeon(Acipenser transmontanus)[J].Aquaculture,1989,78:183-194.
[2] HALVER JE.Fish nutrition[M].New York:A cadem ic Press,2003:185-212.
[3] W ILSON R,POC W.Choline nutrition o f fingerling channel catfish[J].Aquaculture,1988,68: 65-71.
[4] GEURDEN I,RADÜNZ-NETO J,BERGOT P. Essentiality o f dietary phospholipids for carp(Cyprinus carpioL.)larvae[J].Aquaculture,1995,131: 303-314.
[5] MEYERS S P.Im portance of lipid,lecithin in aquatic diets exam ine[J].Feedstu ffs,1985(23): 20-21.
[6] AOAC.Of ficialm ethods of analysis of AOAC[S]. 16th ed.A rlington,VA:AOAC International, 1995.
[7] BRADFORD M M.A refined and sensitive method for the quantification of m icrogram quantities of p rotein utilizing the p rincip le of p rotein dye-binding [J].Analytical Biochem istry,1976,72:248-254.
[8] HANLEY F.Effects o f feeding supplemen tary diets containing varying levels of lipid on grow th,food conversion,and body composition o f N ile tilapia,Oreochrom is niloticus(L.)[J].Aquaculture,1991, 93:323-334.
[9] JAUNCEY K,ROSS B.A guide to tilapia feeds and feeding[M].Stirling:Institute o f Aquacu lture, 1982:111.
[10] CHOU B S,SH IAU SY.Op tim al dietary lipid leve l for grow th of juvenile hybrid tilapiaOreochrom is niloticus×Oreochrom is aureus[J].Aquacu lture, 1996,143:185-195.
[11] 甘晖,李坚明,冯广朋,等.饲料脂肪水平对奥尼罗非鱼幼鱼生长和血浆生化指标的影响[J].上海水产大学学报,2009,18(1):35-41.
[12] RASM USSEN R S,OSTENFELD T H, RØNSHOLDT B,et al.Manipulation of end-product quality in rainbow trout w ith finishing diets[J]. Aquaculture Nutrition,2000,6:17-23.
[13] DE SILVA SS,GUNASKERA R M,SHIM K F. Interactions of varying dietary protein and lipid levels in young red tilapia:evidence o f p rotein sparing [J].Aquaculture,1991,95:305-318.
[14] PARK G S,TAKEUCH I T,YOLOYAMA M, et al.Op tim al dietary taurine leve l for grow th o f juvenile Japanese flounderParalichthys o livaceus[J]. Fisheries Science,2002,68(4):824-828.
[15] MARTINEZ JB,CHATZIFOTIS S,D IVANACH P,et al.Effect o f dietary taurine supp lementation on grow th perform ance and feed selec tion of sea bassDicentrarchus labraxfry fed with demand-feeders[J].Fisheries Science,2004,70(1):74-81.
[16] RUMSEY G L.Choline-betaine requirements of rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,1991,95:107-116.
[17] 曹俊明,林鼎,薛华,等.四种抗脂肪肝物质降低草鱼肝胰脏脂质积累的替代关系[J].水生生物学报, 1999,23(2):102-110.
[18] HARPAZ S.L-carnitine and its attributed func tions in fish culture and nutrition:a review[J].Aquaculture,2005,249:3-21.
[19] GÜL S,BELGE-KURUTA E,Y ILDIZ E,et al. Pollution correlated m odifications of liver antioxidantsystems and histopathology of fish(Cyprinidae) living in Seyhan Dam Lake,Turkey[J].Environment International,2004,30:605-609.
[20] MOURENTE G,TOCHER D R,DIAZ E,et al. Relationships betw een antioxidants,antioxidant enzyme activities and lipid peroxidation p roducts during early development in Dentex dentex eggs and larvae[J].Aquaculture,1999,179:309-324.
Au thor,LIN Sh imei,associate professor,E-mail:linsm198@163.com
(编辑 菅景颖)

