急性冠脉综合征单核细胞中过氧化物酶体增殖物激活受体δ的表达及其与血清基质金属蛋白酶-9和白细胞介素-10的相关性
杨大春 马双陶 杨永健 谭 艳 唐 兵 李 德 张 鑫 朱 峻 陈劲松
(成都军区总医院心血管内科,四川成都 610083)
过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptors,PPARs)是核受体超家族中的一类配体依赖的核转录因子,包括PPARα、δ和 γ3种亚型。PPARδ不仅在细胞生长、分化及组织损伤、修复过程中起重要作用,还参与脂质代谢、转运及胰岛素信号调节作用[1]。大量的实验表明,PPARδ与脂质代谢有关,可纠正胰岛素抵抗和高胰岛素血症。最近还发现PPARδ可以调节血管炎性反应,从而可能影响动脉粥样硬化的发病过程[2]。但是,PPARδ通过何种机制影响动脉粥样硬化的发生、发展尚不十分清楚。本研究通过观察PPARδ在急性冠脉综合征(acute coronary syndrome,ACS)患者周围血单核细胞的表达及其与血清基质金属蛋白酶-9(matrix metalloprotein-ase-9,MMP-9)及白细胞介素-10(interleukin-10,IL-10)的关系,探讨PPARδ在动脉粥样硬化发病中的作用。
1 资料与方法
1.1 研究对象 2008年9月—2009年8月在我院心血管内科住院的急性冠脉综合征患者52例,发病至入院时间在12 h以内;其中急性心肌梗死(AMI)29例,不稳定型心绞痛患者(UAP)23例;男性38例,女性14例,平均年龄58.9±9.7岁。46例健康对照组的患者为同期门诊健康体检者,其中,男性33例,女性13例,平均年龄 56.7±11.4岁。所有患者知情同意于入院时采取肘静脉血分离单核细胞及分离血清,空腹12 h后于次日采血测血脂、血糖等。
除外合并以下疾病者:感染、肿瘤、全身免疫性疾病、严重肝肾疾病、严重高血压病而血压未能控制在理想值者、糖尿病及用非固醇类消炎镇痛药及免疫抑制药者。
1.2 方法
1.2.1 材料 淋巴细胞分离液购自美国Sigma公司,TRIzol TM 试剂盒(Invitrogen公司)、逆转录试剂盒(Invitrogen公司)、PCRmarker(北京天根生化科技有限公司),PCR扩增引物:GAPDH上游引物5′-GAAGGTCGGAGTCAACGG-3′,下游引物 5′-GCTCAGTGTAGCCCAGGAT-3′(PCR 产物 824 bp);PPARδ 上 游 引 物 5′-TGAGTTCGCCAAGAGC-3′,下 游 引 物 5′-GCCAAGATCACAGGGAC-3′(PCR产物418 bp),由上海博亚生物技术公司合成。MMP-9试剂盒(Amersham Biosciences公司)、IL-10 ELISA试剂盒(上海森雄科技实业有限公司)。
1.2.2 外周血单核细胞分离 采用淋巴细胞分离液密度梯度离心法分离周围血单核细胞。取肘静脉血5 mL加入肝素抗凝管,Hanks液1∶1稀释混匀。将混匀后的血标本沿试管壁缓慢加入含1.5 mL淋巴细胞分离液的EP管内,室温下2 500 r◦min-1离心15 min。细胞分为上中下3层,在上层与中层分界处有一戒指状白色细胞环,为单核细胞层,吸出单核细胞层。将细胞浓度调至3×106个◦mL-1,用于提取细胞RNA。
1.2.3 逆转录聚合酶链反应(RT-PCR)方法检测PPARδ的表达 收集单核细胞,应用Trizol试剂盒提取细胞总 RNA,核酸蛋白定量仪测定 RNA含量,逆转录合成cDNA第1链,PPARδ及GAPDH PCR反应条件均为:95℃预变性5 min,94℃变性45 s,58℃退火30 s,72℃延伸40 s,重复35个循环,72℃延伸5 min。产物经1.5%琼脂糖凝胶电泳,凝胶成像系统对条带扫描,软件分析,分别计算PPARδ与GAPDH吸光度A的比值。
1.2.4 血脂、血糖的测定 采用全自动生化分析仪测定血脂、血糖。
1.2.5 MMP-9、IL-10的检测 MMP-9及 IL-10测定采用双抗体夹心酶联免疫吸附法测定。严格按照试剂盒说明书操作。
1.3 统计学处理 应用SPSS11.5行统计分析,计量资料以¯x±s表示,组间比较用 t检验,相关性采用直线相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 急性冠脉综合征组(ACS)和健康对照组的一般临床资料见表1。两组年龄、性别、体质量指数、血压、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、血糖值无显著差异。

表1 两组患者临床一般情况比较
2.2 两组患者血清中 MMP-9、IL-10的情况ACS患者血清MMP-9水平明显高于健康对照组,IL-10明显低于健康对照组,P<0.01,见表2。

表2 两组患者血清MMP-9及IL-10水平
2.3 周围血单核细胞中PPARδ的表达 周围血单核细胞RT-PCR检测PPARδ表达结果见图1,可见PPARδ在周围血单核细胞中有表达,ACS患者PPARδ的表达(0.13±0.08)明显低于健康对照组(0.34±0.09),P<0.01。

图1 健康对照组及ACS组患者周围血单核细胞单核细胞PPARδ的表达比较(1,3,5为健康对照组,2,4,6为ACS组)
2.4 周围血单核细胞PPARδ表达与血清MMP-9、IL-10的相关性 分别对ACS外周血单核细胞PPARδ表达水平和血清MMP-9及IL-10进行相关性分析,发现外周血单核细胞PPARδ表达水平与MMP-9成负相关(r=-0.421,P<0.05),与 IL-10成正相关(r=0.637,P<0.05),见表3。
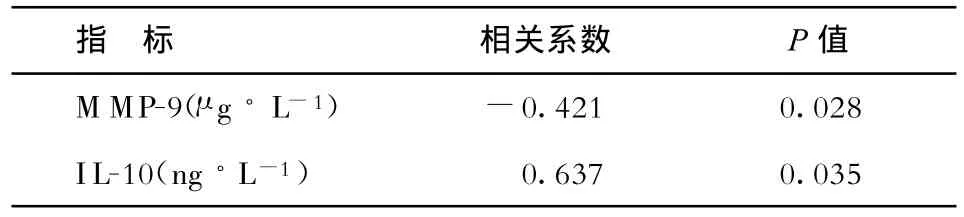
表 3 ACS患者周围血单核细胞 PPARδ表达与血清 MMP-9、IL-10的相关性分析
3 讨 论
动脉粥样硬化(atherosclerosis,AS)是一种血管壁的病变,目前研究表明其发生除了与内皮损伤、脂质向内皮下转移并沉积、泡沫细胞形成、血管平滑肌细胞增殖等因素有关外,局部炎性反应在动脉粥样硬化发生、发展过程中也发挥重要作用[3-4]。研究发现在AS斑块周围,存在大量炎性细胞浸润,如巨噬细胞、淋巴细胞,同时有大量炎性介质的异常表达,如C-反应蛋白、白介素-6、白介素-8及基质金属蛋白酶等。目前认为ACS发生的主要机制是由于冠状动脉斑块的不稳定、破裂、出血、血栓形成,导致急性血流减少或中断。
冠状动脉粥样硬化斑块纤维帽的降解容易导致斑块破裂,在ACS的发病机制中起着重要作用,而基质金属蛋白酶(matrix metalloproteinases,MMPs)可降解斑块局部细胞外基质动脉内膜细胞基质(ECM)从而使纤维帽变薄,导致斑块的不稳定及破裂[5]。MMPs是一类生物活性依赖于锌离子、有降解细胞外基质能力的酶系家族,至今已识别的超过20余种。MMPs根据其功能将其分为几大类:胶原酶、间质溶解素、明胶酶、膜型金属蛋白酶。MMP-9属于 MMPs,主要降解Ⅳ、Ⅴ、Ⅶ、Ⅹ型胶原、明胶、纤维连接蛋白等,通过斑块纤维帽的降解及破裂参与ACS的发病过程。有研究发现,ACS患者周围静脉血MMP-9水平明显增高,且经内科治疗症状稳定后其水平下降,说明MMP-9可能与斑块的不稳定性有关系[6]。本研究发现,急性冠脉综合征患者血清MMP-9明显高于对照组,也进一步证实MMP-9参与了动脉粥样硬化不稳定斑块的形成。
在动脉粥样硬化过程中,不仅有炎性介质的异常表达,同时,体内具有拮抗炎性作用的细胞因子,在AS斑块局部抗炎因子存在异常表达。IL-10是具有潜在抗炎作用的细胞因子,它可以抑制多种细胞反应及细胞凋亡,而这些细胞反应对AS斑块的发展、破裂及血栓形成起着重要作用[7]。IL-10是由激活的淋巴细胞、单核/巨噬细胞和肥大细胞产生的,它有多种抗炎性能:抑制转录因子核因子κB,进而抑制细胞因子、趋化因子的产生;抑制细胞黏附分子产生;抑制基质金属蛋白酶分泌,刺激基质金属蛋白酶抑制剂生成;抑制组织因子及纤维蛋白原的表达,防止血栓形成,在抑制ACS的发生发展中可能发挥重要作用[8]。本研究显示,ACS患者血清中IL-10水平明显低于对照组,提示在不稳定斑块的发生、发展过程中,抗炎因子的拮抗作用减弱可能也是其机制之一。表明致炎作用与抗炎作用的失衡可能是不稳定斑块的形成的重要原因。
过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptors,PPARs)是一类由配体激活的核转录因子,属Ⅱ型核受体超家族成员之一。机体内存在3种过氧化物酶体增殖活化受体(PPAR)亚型 ,即 PPAR-γ,PPAR-α和 PPAR-δ(也称为PPAR-β),组成了核受体亚家族。PPARs与视黄酸X受体(RXR)结合形成异二聚体,与PPARs反应元件(peroxisome proliferator responsive element,PPRE)结合后调节基因转录,从而发挥一系列生物学效应[9]。既往研究发现,PPARs 3种受体亚型都具有抗血管壁炎性反应的作用[1]。在与动脉粥样硬化相关的脂质代谢研究中,有研究发现PPARδ的激动剂GW501516在人巨噬细胞系(THP21)、皮肤成纤维细胞(IBR3N)、肠细胞(FHS74)中能促进胆固醇转运;在鼠与非人灵长类能够提高胆固醇逆向转运子ACBA1(ATP结合盒转运子),促进胆固醇逆向转运,升高循环中的高密度脂蛋白(HDL)水平[10],减少具有致动脉粥样硬化的小而密的 LDL的作用[11]。Graham等[12]给予LDLR/小鼠高脂饮食,同时分别给予PPARδ特异的激动剂GW610742或药物载体,GW610742处理组动脉粥样斑块损伤面积减少达50%。但激动剂对血浆脂蛋白组成影响很小。GW610742处理组主动脉的炎性分子如MCP-1、TNF-α、ICAM-1表达下调,腹膜单核巨噬细胞CD36、TNF-α表达也下调。血浆中炎性因子如 MCP-1、RANTES、IL-12和TNF-α的水平降低。Barish[13]研究发现,PPARδ可通过诱导G蛋白信号基因调节子(RGS)的表达,抑制趋化因子的信号转导,从而抑制动脉粥样硬化的形成。本研究发现,ACS患者周围血单核细胞PPARδmRNA表达明显低于对照组,且其表达量与炎性介质MMP-9成反比,与IL-10成正比。提示PPARδ可能通过抑制MMP-9的表达,促进IL-10的表达,调节抗炎因子与炎性介质之间的比例,从而发挥抑制动脉粥样不稳定斑块形成的作用。表明PPARδ在急性冠脉综合征的发病中可能具有重要作用。
PPARδ通过何种机制调控炎性介质与抗炎因子的表达及维持其正常比例,目前尚不清楚,有待研究。由于本研究样本量较少,尚需进一步积累大样本资料进行深入研究。
1 Robinson E,Grieve DJ.Significance of peroxisome proliferatoractivated receptors in the cardiovascular system in health and disease[J].Pharmacol Ther,2009,122(3):246-263.
2 Stienstra R,Duval C,Muller M,et al.PPARs,Obesity,and Inflammation[J].PPAR Res,2007,20(7):95974.
3 孙淑娴,许 丹,姜玉风,等.血清基质金属蛋白酶-9与急性冠脉综合症的相关性[J].中国临床医学,2007,14(3):284-286.
4 Ross R.Atherosclerosis--an inflammatory disease[J].N Engl J Med,1999,340(2):115-126.
5 Peterson JT,Li H,Dillon L,et al.Evolution of matrix metalloprotease and tissue inhibitor exp ression during heart failure progression in the infarcted rat[J].Cardiovasc Res,2000,46(2):307-315.
6 Blankenberg S,Rupp recht HJ,Poirier O,et al.Plasma concentrations and genetic variation of matrix metalloproteinase 9 and prognosis of patients with cardiovascular disease[J].Circulation,2003,107(12):1579-1585.
7 Smith DA,Irving SD,Sheldon J,et al.Serum levelsof the antiinflammatory cytokine interleukin-10 are decreased in patients with unstable angina[J].Circulation,2001,104(7):746-749.
8 Heeschen C,Dimmeler S,Hamm CW,et al.Serum level of the antiinflammatory cy tokine interleukin-10 is an important prognostic determinant in patients with acute coronary sy ndromes[J].Circulation,2003,107(16):2109-2114.
9 Chinetti G,Fruchart JC,Staels B.Peroxisomeproliferator-activated recep tors(PPARs):nuclear receptors at the crossroads between lipid metabolism and inflammation[J].Inflamm Res,2000,49(10):497-505.
10 Hihi AK,Michalik L,Wahli W.PPARs:transcriptional effectors of fatty acid s and their derivatives[J].Cell Mol Life Sci,2002,59(5):790-798.
11 Lee CH,Olson P,Evans RM.Minireview:lipid metabolism,metabolic diseases,and peroxisome proliferator-activated receptors[J].Endocrinology,2003,144(6):2201-2207.
12 Graham TL,Mook herjee C,Suckling KE,et al.The PPARdelta agonist GW0742X reduces atherosclerosis in LDLR(-/-)mice[J].Atherosclerosis,2005,181(1):29-37.
13 Barish GD,Atkins AR,Downes M,et al.PPARdelta regulates multiple proinflammatory pathways to suppress atherosclerosis[J].Proc Natl Acad Sci U S A,2008,105(11):4271-4276.

