含蟾酥胶囊血清诱导人肝癌细胞株凋亡及机制探讨
顿爱社,张春菊,吕伯实,刘 帅,侯海峰,吕方启
(1泰山医学院,山东泰安 271000;2泰安卫生学校基础护理教研室; 3泰山医学院附属医院)
蟾酥是我国传统的名贵中药材,蟾酥胶囊(CC)是重庆市中医研究院研制的以蟾酥为主要成分的一种蟾酥制剂,动物实验和临床报告表明,蟾酥提取物及各种蟾酥制剂具有治疗肝癌的作用[1,2],而利用血清药理学方法研究蟾酥制剂诱导肝癌细胞凋亡并探讨其诱导机制的报道甚少。近两年,我们采用血清药理学方法,观察CC血清对体外培养的人肝癌细胞株BEL-7402凋亡的诱导作用,并探讨其作用机制。
1 材料与方法
1.1 细胞、药物及主要试剂人肝癌细胞株 BEL-7402购自华西临床医学院移植与免疫实验室,CC水溶液由重庆市中医研究院提供;纯种新西兰大白兔由华西实验动物中心提供。培养基RPMI-1640,碘化丙啶(PI),MTT,二甲基亚砜(DMSO)。兔抗人Bcl-2单克隆抗体,SABC免疫组化SABC试剂盒,DNA提取试剂盒。
1.2 含药血清的制备 参考文献[3]的方法并作改进。20只新西兰大白兔(体质量2.0~2.5 kg)随机分为两组,各 10只,分别用于制备含药血清和无药血清。前者给予CC水溶液灌胃6ml/(kg◦d),后者给予以等量NS灌胃,均3 d,两组均自由进食和饮水。末次灌胃 1 h后,心脏穿刺抽血,4℃冰箱过夜,离心,无菌分离血清,灭活,-20℃保存备用。
1.3 细胞培养及分组 BEL-7402用含10%小牛血清的RPMI-1640培养液常规培养,至对数生长期,消化收集,分别加入无药血清(对照组),含10%(实验1组)、20%(实验2组)、30%(实验3组)CC血清的RPMI-1640培养液重悬调整,以1×105/ml接种于培养瓶,分别培养 24、48 h备测。
1.4 各组细胞形态学观察及细胞抑制率、凋亡率测算 采用倒置显微镜下观察各组细胞形态学变化情况,用MTT比色法测算各组细胞抑制率[4],用流式细胞术测算细胞周期和细胞凋亡率。
1.5 各组细胞DNA梯度条带测定 用琼脂糖凝胶电泳检测。取PBS洗过的BEL-7402(1×106),按试剂盒说明书抽提细胞中DNA,1.5%琼脂糖凝胶、100 V恒压电泳,紫外灯下观察DNA条带,用凝胶成像系统采集图像。
1.6 各组细胞Bcl-2检测 采用免疫组化SABC法染色,按试剂盒说明书操作。用真彩色医学图像分析系统对Bcl-2染色结果进行定量分析,测定其吸光值(A值)。
1.7 统计学方法 采用SPSS13.0统计软件。计量资料用±s表示,组间比较采用t检验和方差分析,两两比较用LSD法。α=0.05。
2 结果
2.1 各组细胞形态学变化 ①细胞贴壁能力变化:诱导培养 24 h时,实验 2组细胞贴壁能力明显下降,部分细胞呈漂浮生长状态,实验 1、3组细胞贴壁能力未见明显变化;48 h时,实验2组细胞贴壁能力进一步下降,大部分细胞呈悬浮生长,实验 1、3组细胞贴壁能力有所下降,少许细胞呈悬浮生长。②细胞集落性的变化:诱导培养 24 h,实验 2组细胞集落生长特性明显降低,部分细胞呈单个生长状态,实验1、3组细胞集落生长特性无明显变化;48 h时,实验1组细胞集落生长特性无明显变化,实验 2组大部分细胞、实验 3组有少许细胞呈单个生长状态。③细胞大小和形状变化:诱导培养 24 h,实验2组大多数细胞仍呈梭形,个别细胞变小、变圆,实验 1、3组细胞大小与形状未见明显变化;48 h时,实验1组细胞大小、形状仍未见明显变化,实验 2组大部分细胞和实验 3组少部分细胞变小、变圆。对照组细胞培养 24 h时呈集落性、贴壁生长,长梭形,胞质饱满,折光性强;48 h后,相邻细胞生长汇合成片,逐渐形成细胞单层,细胞贴壁能力无明显下降,无细胞脱落。
2.2 各组细胞生长抑制率、细胞周期及凋亡率比较见表1。
表1 各组细胞生长抑制率、凋亡率及细胞周期(±s)

表1 各组细胞生长抑制率、凋亡率及细胞周期(±s)
注:与对照组同时点比较,*P<0.05,△P<0.01
组别 细胞生长抑制率(%)细胞凋亡率(%)细胞周期(%) G1期 S期 G2/M期对照组24 h 0 3.3±0.45 55.8 33.6 10.6 48 h 0 4.3±0.22 54.6 29.9 15.4实验1组24 h 10.3±0.17*10.5±0.22*54.3 33.2 12.5*48 h 13.6±0.14*14.6±0.41*44.1* 26.6 29.3*实验2组24 h 26.5±0.25△32.6±0.51△50.6 31.0 18.4*48 h 30.2±0.28△38.5±0.45△40.4* 27.7 31.8*实验3组24 h 15.6±0.24*13.3±0.32*53.3 32.4 14.3*48 h 18.4±0.16*23.6±0.54*43.5* 28.4 28.0*
2.3 各组细胞DNA电泳结果 对照组未见DNA阶梯状电泳条带,各实验组均见典型的DNA阶梯状电泳条带(详见图1)。
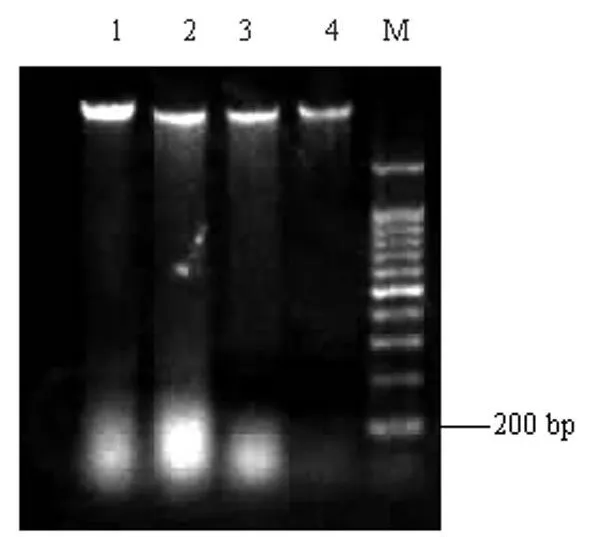
图1 凋亡细胞DNA含量电泳分析
2.4 各组Bcl-2表达结果 细胞培养24 h时,对照组及实验1、2、3组Bcl-2 A值分别为0.80±0.03、0.44±0.03、0.35±0.05、0.42±0.04;48 h时分别为0.75±0.03、0.40±0.04、0.30±0.03、0.32± 0.02。各实验组Bcl-2 A值均低于对照组(P均<0.05),与实验1、3组比较,实验2组48 h时Bcl-2 A值最低(P均<0.05)。
3 讨论
血清药理学由日本学者田代真一在 1984年首届和汉医药学会上首次提出[5]。指将单味或复方中药制剂经口灌胃给动物一定时间后,采集动物血液,分离血清,用此含药血清进行体外实验的方法,从机理上更接近口服中药后体内环境中产生药理效应的真实过程,克服了中药粗制剂在细胞药理实验上的缺点,提高了实验结果的科学性。
有研究证实[6~11],原癌基因 Bcl-2是重要的抑制肿瘤细胞凋亡的基因,在抑制细胞凋亡的过程中起重要作用,可以增强细胞的存活力,参与细胞增殖与凋亡动态平衡的调控,Bcl-2异常表达与肿瘤的发生有关。本研究结果发现,各实验组 BEL-7402与含CC血清共同孵育后,出现了一系列凋亡细胞的生物学特征[12],如细胞变小、变圆,细胞膜完整但有发泡现象等;各实验组细胞生长抑制率和凋亡率均较对照组明显升高,提示含 CC血清可诱导肝癌细胞株凋亡。细胞周期分析发现,G1、S期细胞减少, G2/M期细胞增多;细胞Bcl-2表达明显下调,提示含CC血清诱导细胞凋亡的机制可能是使处于分裂活跃阶段的S期细胞减少,使细胞阻滞于 G2/M期,阻止细胞进入下一个分裂周期,抑制细胞增殖,从而导致细胞生长受抑制。含CC血清诱导BEL-7402凋亡的机制可能与下调细胞 Bcl-2表达有关,这与Green等[13]研究结果一致。
本研究中,各实验组细胞凋亡率均高于对照组,且各实验组之间比较,诱导48 h时较24 h的细胞凋亡率高,以实验 2组在诱导 48 h的细胞凋亡率最高。分析原因可能是细胞凋亡率并非一定随药物浓度及作用时间增加而增加,在药物浓度达到一定量、且作用一定时间后,细胞开始凋亡,凋亡率随着药物浓度的增加和作用时间的延长而升高;开始时细胞凋亡率与药物剂量呈正相关关系;但药物达到一定剂量后细胞凋亡率不再增加,需等到其他周期的细胞过渡到该周期才有可能被诱发凋亡而继续发挥其药物作用。因此我们推测,含 CC血清的最佳浓度应该在20%左右。
总之,CC血清具有良好的诱导肝癌细胞株凋亡的作用,其有望作为一种新的治疗肝癌药物,但其诱导细胞凋亡机制、是否引起肝癌细胞耐药及临床应用剂量和疗效方面尚不十分清楚,有待于进一步研究。
[1].唐静,靳荣,叶云.蟾酥制剂在抗肿瘤方面的应用[J].药学专论,2008,17(20):15-16.
[2]张加梅.蟾酥抗癌作用研究进展[J].齐鲁药事,2008,27(7):417-418.
[3]李秀荣,张丹,齐元富,等.消瘤平移合剂含药血清诱导肝癌H-7402细胞凋亡的实验研究[J].中国中西医结合杂志,2001,21 (9):684-687.
[4]宋金丹.组织和细胞培养技术[M].北京:人民卫生出版社, 2002:111-112.
[5]贺玉琢.日本汉方药血清药理学、血清药化学的研究概况[J].国外医学:中医中药分册,1998,20(5):3-7.
[6]Zhou C,Li X,DuW,et al.Antitumor effects of ginkgolic acid in human cancer cell occur via cellcyclearrest and decrease theBcl-2/ Bax ratio to induce apoptosis.[J]Chemotherapy,2010,56(5):393-402.
[7]Kanematsu S,Uehara N,Miki H,et al.Autophagy inhibition enhances sulforaphane-induced apoptosis in human breast cancer cells [J].Anticancer Res,2010,30(9):3381-3390.
[8]Deeb D,Gao X,Jiang H,et al.Growth inhibitory and apoptosisinducing effects of xanthohumol,a prenylated chalone present in hops,in human prostate cancer cells[J].Anticancer Res,2010, 30(9):3333-3339.
[9]Chaudhry P,Srinivasan R,Patel FD.Expression of themajor fas family and Bc l-2 fam ily of proteins in epithelial ovarian cancer (EOC)and their correlation to chemotherapeutic response and outcome[J].OncolRes,2010,18(11-12):549-559.
[10]Li Y,Xia AZ,Xing SH.Protective effect of edaravone against renal ischem ia/reperfusion injury and compared with ischem ic postconditioning in rats[J].药学学报,2010,45(7):840-848.
[11]Ayhan S,Nalbant OA,Isisag A,etal.Immunohistochem icalanalysisof Ki-67,p53 and Bc l-2 expression related to histological features in gastroesophageal reflux disease[J].Turk JGastroenterol, 2010,21(3):199-205.
[12]宋金丹.医学细胞生物学[M].北京:人民卫生出版社,2005:308-309.
[13]Green DR,Reed JC.Mitochondria and apoptosis[J].Science, 1998,281(5381):1309-1312.

