前列腺癌组织中Ob-R和STAT3的表达变化及意义
徐 健,白铁男,胡海龙,韩瑞发,杨光华
(天津医科大学第二医院,天津 300211)
瘦素是肥胖基因编码的来源于脂肪组织的蛋白质,具有细胞因子特性[1]。瘦素受体(Ob-R)是糖尿病基因编码的跨膜蛋白质。Ob-R的主要生理功能是与瘦素结合,介导发挥抑制食物摄入、促进能量消耗及调节物质代谢等作用。近年来,有研究发现瘦素和Ob-R还与细胞增殖、血管生成等关系密切,与多种肿瘤的发生有关。Janus激酶和信号转录因子及活化子(JAK/STAT)途径是介导瘦素信号传递的主要通路[2]。2008年 1月 ~2009年 12月,我们采用免疫组化方法检测了前列腺癌(PCa)、前列腺上皮内瘤(PIN)、良性前列腺增生(BPH)组织中的Ob-R及信号转导和转录激活因子3(STAT3),探讨Ob-R和STAT3在PCa发生发展中的作用。
1 资料与方法
1.1 临床资料 收集我院手术或前列腺穿刺并经病理检查证实的PCa标本41例(PCa组),PIN标本22例(PIN组),BPH标本25例(BPH组)。其中PCa患者年龄为51~73岁,平均 65岁;组织学分级按照Gleason分级系统:高分化癌(2~4分)12例,中分化癌(5~7分)15例,低分化癌(8~10分)14例;根据2002年美国肿瘤联合会TNM分期系统:T1~T2期18例,T3~T4期23例。PIN患者年龄为56~72岁,平均64岁;低级PIN 10例,高级PIN 12例。BPH患者年龄 51~79岁,平均 66岁。所有患者术前均未接受放化疗或抗雄激素治疗。所有标本均石蜡包埋、4μm厚切片。
1.2 Ob-R及STAT3检测方法 兔抗人Ob-R BA1233即用型和兔抗人STAT3 BA0621即用型免疫组化试剂盒。所有标本均采用免疫组化 SP法染色,操作按试剂盒说明书进行。分别选用已知阳性组织切片作阳性对照,用PBS代替一抗作阴性对照。
细胞质内有棕色颗粒者为Ob-R、STAT3阳性细胞。根据染色强度与阳性细胞百分比分为 3级:胞质内无棕色颗粒或有浅棕色颗粒细胞<50%者为阴性(-);胞质内有浅棕色颗粒细胞>50%者且胞质内有深棕色颗粒细胞<50%为弱阳性(+);胞质内有深棕色颗粒细胞>50%者为强阳性(++)。
1.3 统计学方法 采用SPSS11.5统计软件,数据比较用χ2检验,相关性分析用Spearman等级相关分析法。P≤0.05为差异有统计学意义。
2 结果
2.1 各组中Ob-R和STAT3的表达 见表1。BPH、PIN和PCa组中,Ob-R和STAT3的阳性表达呈递增趋势,Ob-R的阳性表达率分别为56.00%(14/ 25)、72.73%(16/22)、90.24%(37/41),PCa组与BPH组比较 ,P<0.01,余组间两两比较,P均 >0.05;STAT3的阳性表达率分别为60.00%(15/25)、81.82%(18/22)、87.80%(36/41),PCa组与BPH组比较P<0.01,余组间两两比较,P均>0.05。

表1 三组中Ob-R和STAT 3的表达变化(n)
2.2 PCa组织中Ob-R和STAT3的相关性 经Spearman相关分析,Ob-R的表达与STAT3的表达呈正相关(r=0.689 7,P<0.01)。
2.3 Ob-R、STAT3的表达与PCa临床病理特征的关系 见表2。STAT3表达与PCa病理分级有关(P<0.05),与临床分期无关;Ob-R表达与PCa病理分级及临床分期均无关。
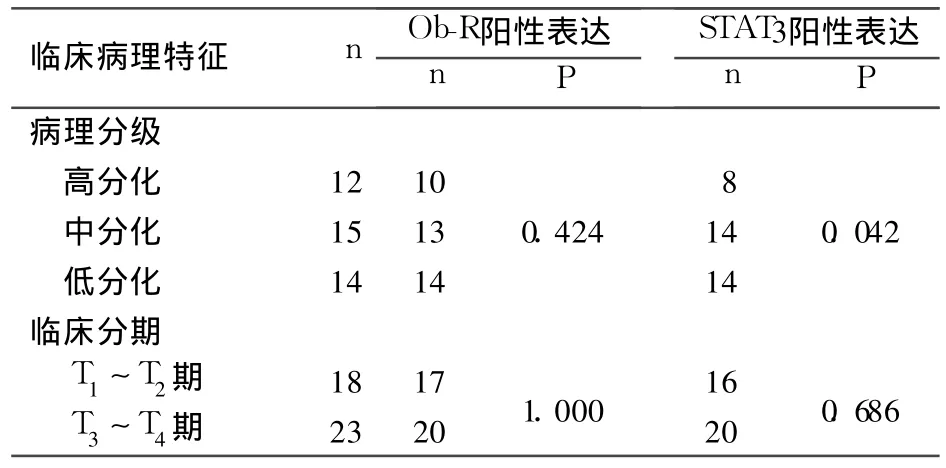
表2 Ob-R和STAT3阳性表达与PCa临床病理特征的关系
3 讨论
PCa是男性泌尿生殖系统中的常见的恶性肿瘤,在欧美国家的发病率很高。近年来,在我国PCa发病率也逐年上升[3]。研究发现[4]高脂饮食及肥胖与PCa的发生发展有一定的相关性,但具体的作用机制还不清楚。瘦素是肥胖基因的表达产物,在下丘脑核区中的 Ob-R介导下,可抑制核区中的基因转录,从而抑制食欲,提高机体代谢,减少脂肪堆积,此外还可与其受体结合后通过多条信号通路参与促进细胞增殖、血管增生及调节免疫功能、多种内分泌激素。瘦素与Ob-R结合后,可以启动多个信号传递途径,其中,JAK/STAT途径是介导瘦素信号传递的主要通路。胞质酪氨酸激酶作为 JAK家族成员,结合于Ob-R上,Ob-R上的第985和1 138位酪氨酸残基被磷酸化后,可作为下游信号分子的结合位点,其中磷酸化的第 1 138位酪氨酸可作为STATs的结合位点,若被丝氨酸取代则可特异地阻断STATs引起的信号传递[5]。
STATs家族是一种存在于细胞质并在激活后能转入核内与 DNA结合的独特的蛋白家族。目前在哺乳动物中已发现STATs家族有7个结构和功能相似的成员,分别由不同的基因编码。在STATs家族中,主要是STAT3参与Ob-R和leptin结合后引起的信号传递[6]。STAT3与细胞膜上的Ob-R特异性结合,酪氨酸被JAK磷酸化后,STAT3与受体解离,形成同型或异型二聚体,进入细胞核内,结合特定的靶DNA启动子序列,调节c-fos、c-jun等癌基因的转录和翻译。因此,我们推测该信号通路可能与肿瘤的发生发展有着及其密切的关系。研究表明[7],在酪氨酸激酶信号途径中STATs蛋白被选择性激活,而此信号途径参与癌症的发生,而且持续性激活的STATs突变体能诱导某些细胞转化,显性负STATs突变体又能阻断某些 STATs依赖的转录和转化。在肿瘤的形成过程中,控制细胞增殖和生存的基因也可以被STATs激活。可见,STATs蛋白可能参与多种肿瘤的形成和发展。
本研究结果表明,在PCa组中Ob-R、STAT3阳性表达率均显著高于BPH组,且Ob-R与STAT3的表达呈正相关关系,说明瘦素与Ob-R结合后激活JAK/STAT信号转导途径参与了PCa的表达,Ob-R和STAT3可作为判断PCa生物学行为的指标。同时本研究中,PIN组Ob-R、STAT3阳性表达率都明显高于BPH组,但可能由于样本量较小,其表达没有统计学意义。在PCa发生的早期,瘦素与Ob-R结合后激活JAK/STAT信号转导途径是否参与了前列腺上皮的恶性转化以及Ob-R和STAT3在PCa发生发展中的作用还需要进一步探索。
本研究结果还发现,STAT3表达与PCa病理分级有关(P<0.05),与临床分期无关;Ob-R表达与PCa病理分级及临床分期均无关;Ob-R的表达与STAT3的表达呈正相关关系(r=0.689 7,P<0.01),说明除了瘦素与Ob-R结合后激活JAK/ STAT信号转导途径参与了PCa的表达和进展,可能还有其他机制激活了STAT3的信号转导,这有待于我们的进一步研究;同时,STAT3的表达与PCa的临床分期无关,所以STAT3是否能体现PCa的恶性程度还需要进一步观察。
[1]Halaas JL,Gajiwala KS,MaffeiM,et al.Weight-reducing effectsof the plasma protein encoded by the obese gene[J].Science,1995, 269(5223):543-546.
[2]Sweeney G.Leptin signaling[J].Cell Signal,2002,14(8):655-663.
[3]Zhau HE,Zhao LS,Chung LW,et al.Comparative studies of prostate cancers among United States,Chinese,and Japanese patinent:characterization ofhistopathology,tumor angiogenesis,neuioendocrine factors,and p53 protein accumulations[J].Urologic Oncol,1995,1 (2):51.
[4]Mydlo JH,Tieng NL,Volpe MA,etal.A pilot study analyzing PSA, serum testosterone,lipid profile,bodymass index and race in a small sample of patients with and without carcinoma of the prostate[J]. Prostate Cancer Prostatic Dis,2001,4(2):101-105.
[5]Minokoshi Y,A lquier T,Furukawa N,et al.AMP-kinases regulates food intake by responding to hormonaland nutrientsignals in the hypothalamus[J].Nature,2004,428(6982):569-574.
[6]林季,颜光涛.瘦素介导的细胞内信号途径在创面愈合中的作用[J].中国修复重建外科杂志,2007,21(11):1254-1258.
[7]Karni R,Jove R,Levitzki A.Inhibition ofpp60c-Src reduces Bcl-xl expression and level T-S the transformed phenotype of cells overexpressing ECG and HER-2 receptors[J].Oneogene,1999,18(33):4654-4662.

