缺血预处理与缺血后处理对大鼠肾脏的保护作用对比观察
江志强,鲍 健,王茂龙,孙 扬,孙立江*
(1青岛大学医学院附属医院,山东青岛266003;2即墨市人民医院)
研究证明[1],机体缺血再灌注损伤(IR)具有普遍性。上世纪 80年代,动物实验发现[2]缺血预处理(IP)和缺血后处理(IPo)能增加动物心脏和肾脏对缺血的耐受性。2008~2009年,我们以大鼠为实验对象,观察IP和Ipo对其肾脏的保护作用,并进行比较。现报告如下。
1 材料与方法
1.1 实验动物与主要试剂 健康Wistar大鼠24只,体质量 200~250 g,由青岛大学医学院附属医院动物实验中心提供。超氧化物歧化酶(SOD)和丙二醛(MDA)、NO、一氧化氮合酶(NOS)分型试剂盒由南京建成生物工程公司提供。
1.2 模型制备及动物分组 肾缺血再灌注模型的制备参照文献[3]进行。实验动物术前 12 h禁食,自由进水,8%水合氯醛5m l/kg腹腔内注射麻醉。麻醉后随机分为4组,各6只:①假手术组(SO组):常规消毒,取上腹正中切口,切开腹壁各层,入腹后分别于结肠肝曲外侧切开腹膜暴露右侧肾脏,游离肾蒂后切除右肾;与结肠脾曲外侧切开外侧腹暴露左侧肾脏,游离肾蒂,并游离输尿管以避免损伤,暴露
45min,用NS纱布覆盖。②IR组:在SO组基础上用无损伤血管夹夹闭左肾动脉(肾脏颜色变为暗红色即可确认阻断成功),造成肾脏缺血45 min后,松开动脉夹,肾脏由暗红色变为鲜红色即可确认血流恢复。夹闭和放开肾蒂时腹腔内各注射林格液20 ml/kg。③IP组:按Lee等[4]方法,在SO组基础上造成肾脏持续缺血前先夹闭肾蒂8 min,再放开 5 min,反复3次后,余操作同IR组。④IPo组:参考尹寿杰等[5]方法,夹闭肾蒂 45min后,反复6次灌注10 s、阻断10 s,再完全恢复血流。余操作同IR组。24 h后在麻醉下腹主动脉取血 5 ml,切取肾脏后处死大鼠。
1.3 观测指标 测定血清Cr、BUN,采用光电比色法测定血清NO水平。取肾组织加NS,用匀浆机制成10%的组织匀浆,用硫代巴比妥酸法测定MDA水平,黄嘌呤氧化酶法测定SOD活性。
1.4 统计学方法 采用SPSS13.0统计软件。组间比较用单因素方差分析及q检验。P≤0.05为差异有统计学意义。
2 结果
2.1 各组血清Cr、BUN和NO水平比较 详见表1。
表1 各组缺血再灌注后血清Cr、BUN、NO水平比较(±s)

表1 各组缺血再灌注后血清Cr、BUN、NO水平比较(±s)
注:与SO组比较,*P<0.05;与IR组比较,△P<0.05
组别 Cr(μmol/L) BUN(mmol/L) NO(nmol/L) SO组 53.35±6.34 5.83±0.68 75.49±6.48 IR组 161.47±13.45* 19.85±2.74* 45.17±4.69*IP组 100.77±6.76*△13.13±1.35*△ 53.37±9.44*△IPo组 108.50±11.83*△14.11±1.82*△ 54.92±7.96*△
2.2 各组肾组织中SOD、MDA水平比较 见表2。
表2 各组大鼠缺血再灌注后肾组织中SOD、MDA水平比较(±s)
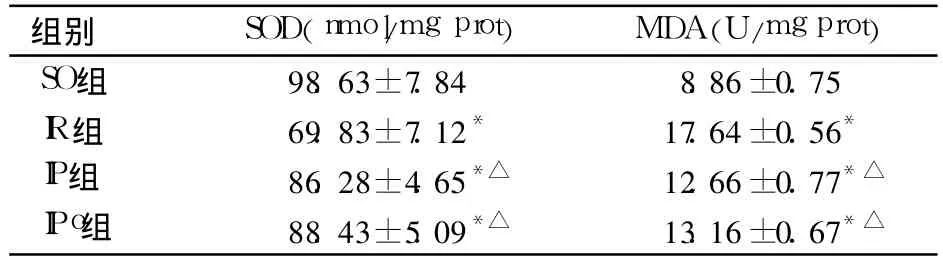
表2 各组大鼠缺血再灌注后肾组织中SOD、MDA水平比较(±s)
注:与SO组比较,*P<0.05;与IR组比较,△P<0.05
组别 SOD(nmol/mg prot) MDA(U/mg prot) SO组 98.63±7.84 8.86±0.75 IR组 69.83±7.12* 17.64±0.56*IP组 86.28±4.65*△ 12.66±0.77*△IPo组 88.43±5.09*△ 13.16±0.67*△
3 讨论
本实验选取对 IR刺激敏感的雄性大鼠[6],并切除一侧肾脏,避免了对侧肾脏的代偿作用[7]。IP由一个或几个短暂的缺血和再灌注过程所产生。我们选择的预处理时间为8min缺血和5min再灌注,共3个周期。IPo是新近应用抗肾脏IR的一种机械性干预策略,在缺血发生后进行,简单方便[8],但必须在再灌注1 min内实施。本实验选择的IPo方案为反复6次的10 s灌注、10 s阻断,而后完全恢复肾脏血流。目前研究[9]认为,多种因素参与了肾脏的IR,其中爆发式产生的氧自由基是引起其细胞生物分子结构变化和细胞功能损伤的重要原因。细胞在缺血缺氧时会产生大量氧自由基,细胞膜磷脂降解,产生大量炎性介质,趋化中性粒细胞进入细胞或黏附于血管内皮;中性粒细胞在参与炎性反应时其本身又能释放趋化物质,激活的中性粒细胞氧爆发增加,产生大量的自由基或溶酶体释放加重组织损伤。SOD和MDA能较好地反映组织内氧自由基水平及氧化损伤程度[10]。SOD可清除体内过剩的氧自由基,其活力的高低间接反映了机体清除自由基的能力;MDA是脂质过氧化的终末产物,检测其水平可反映机体内脂质过氧化的程度,并间接反映组织细胞受自由基攻击的严重程度;NO是重要的细胞内信使,其下降与肾功能损害密切相关[9]。本实验结果显示,与IR组比较,IP和IPo组血清Cr、BUN、NO水平均明显降低,SOD和MDA水平明显升高,说明IP和IPo均可明显降低肾功能损害和肾组织脂质过氧化,但IP、IPo组肾功能损害和肾组织脂质过氧化比较差异无统计学意义(P>0.05),说明IP与IPo均可减轻大鼠肾脏IR,两者效果相当。
综上所述,IP和IPo均能有效预防缺血再灌注造成的肾功能异常和组织损伤,两者相比效果相当(P>0.05),而对于两者是否具有叠加效应本实验未涉及,其他学者对此存在争论,可能与实验动物和实验方法选择的不同有关[11]。
[1]静怡,唐朝枢.缺血再灌注损伤的普遍性及其临床意义[J].北京医科大学学报,1990,22(2):149-152.
[2]Murry CE,JenningsRB,Relmer KA.Pre-conditioningwith ischem ia:a delay of lethal cell injury in ischem ic myocardium[J].Circulation,1986,74(5):1124-1136.
[3]Obal D,Dettwiler S,Favoccia C,et al.Effect of sevoflurane precondition on ischem ia/reperfusion injury in the rat kidney in vivo [J].Eur JAnaesthesiol,2006,23(4):319-326.
[4]Lee HT,Emale CW.Protective effects of renal ischemic preconditioning and adenosine pretreatment:role ofA(1)and A(3)receptors[J].Am JPhysiol RenalPhysiol,2000,278(3):380-387.
[5]尹寿杰,李晨光,姜华茂,等.缺血后处理对大鼠肾脏缺血再灌注损伤的影响[J].辽宁医学院学报,2008,29(3):202-204.
[6]Park KM,Kin JI,Ahn Y,etal.Testosterone is responsible for enhanced susceptibility ofmales to ischem ic renal injury[J].JBiol Chem,2004,279(50):52282-52292.
[7]Toosy N,Momorris EL,Grace PA,et al.Ischaemic preconditioning protects the rat kidney from reperfusion injury[J].Br JU rol Int,1999,84(4):489-494.
[8]Zhao ZQ.Inhibition of myocardial injury by ischem ic postconditioning during reperfusion:comparison with ischem ic preconditioning[J].Am JPhysiol Heart Circ Physiol,2003,285(2):579-588.
[9]Araujo M,Welch WJ.Oxidative stress and nitric oxide in kidney function[J].Curr Opin Nephrol Hyperten,2006,15(1):72-77.
[10]Zhou JF,Chen JX,Shen HC,et al.Abnormal reactions of free radicals and oxidative damages in the bodiesofpatientswith chronic glomerulonephritis[J].Biomed Environ Sci,2002,15(3):233-244.
[11]陈立建,顾尓伟.缺血后处理及其分子机制[J].安徽医药, 2007,11(11):965-967.

