膀胱移行细胞癌组织中Nodal的表达变化及意义
李又空,周家杰,张先觉,杨光华,丁 坤,王建国,朱 敏
(华中科技大学同济医学院附属荆州市中心医院,湖北荆州 434020)
Nodal蛋白是重要的细胞成形素,在胚胎发育及干细胞分化调节中发挥着非常重要的作用[1]。其在发育的胚胎组织及细胞中一过性表达上升,随着胚胎发育成熟及细胞分化其表达不断降低,发育完全的组织细胞中几乎不存在Nodal蛋白的表达。最新研究发现,Nodal蛋白在人皮肤黑色素瘤组织细胞中存在较高的表达,并已证实其在黑色素瘤的生长及转移中发挥着非常重要的作用[2,3]。而肿瘤干细胞理论认为肿瘤是一种干细胞疾病,在胚胎干细胞分化调节中发挥着重要作用的细胞因子,同样也在肿瘤的生长发育中起着非常重要的作用[4]。基于此理论,我们以人膀胱移行细胞癌(下称膀胱癌)组织标本为研究对象,观察其组织中是否存在细胞成形素Nodal蛋白及mRNA的表达,并探讨其表达与膀胱癌病理分级及临床分期之间的关系。
1 资料与方法
1.1 临床资料 17例膀胱癌组织为我院2009年 8月 ~2010年 8月手术切除标本,均经病理证实。17例患者中,男10例,女7例;年龄35~75岁;临床病理分级:Ⅰ级 5例、Ⅱ级 7例、Ⅲ级 5例。TNM分期:Ta期7例、T1期6例、T2~T4期4例。另取距肿瘤5 cm以外膀胱正常组织(病理检查证实)6例为对照。标本切除后速置入液氮中,于 -80℃保存。
1.2 检测方法
1.2.1 主要试剂 小鼠抗人Nodal单克隆抗体,辣根过氧化物酶标记羊抗小鼠二抗。电化学发光物(ECL)试剂盒。RNA提取试剂Trizol Reagent、Taq DNA聚合酶及禽骨髓母细胞瘤病毒(AMV)逆转录酶均购自Fermentas公司,引物均由上海英骏生物技术有限公司合成。
1.2.2 膀胱癌和膀胱正常组织中Nodal蛋白的检测 采用Western blot法。提取各标本总蛋白并定量,8%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质后转膜,37℃封闭1 h,一抗(1∶1 000)4℃孵育过夜,辣根过氧化物酶标记二抗37℃孵育 2 h,洗膜后ECL显影,暗室压片曝光。所有实验重复 3~5次。所得到的蛋白条带经扫描后计算各条带与内参 βactin吸光值(A值)的比值,此代表各标本中Nodal蛋白表达含量。
1.2.3 膀胱癌和膀胱正常组织中Nodal mRNA的检测 采用RT-PCR法。参照Trizol Reagent说明书提取总RNA,RT反应条件:70℃5 min,37℃5 min,42℃60 min,70℃10 min;PCR反应条件:94℃5min,94℃30 s,55℃45 s,72℃1min,循环36次。以β-actin为PCR内参。PCR产物经琼脂糖凝胶电泳和凝胶成像系统分析后,计算待测指标与β-actin A值的比值。
1.3 统计学方法 采用SPSS13.0统计软件。数据以±s表示,组间比较用单因素方差分析。α= 0.05。
2 结果
2.1 膀胱癌和膀胱正常组织中Nodal蛋白、mRNA表达变化 膀胱癌组织中有不同程度的Nodal蛋白、mRNA的表达,膀胱正常组织中均未检测到Nodal蛋白、mRNA。详见图1。
2.2 Nodal蛋白、mRNA表达与膀胱癌分级、分期的关系 见表1。随着病理分级的增高,Nodal蛋白、mRNA的表达均依次增强,Ⅲ级>Ⅱ级(P<0.05)>Ⅰ级(P<0.01);随着膀胱癌临床分期的升高, Nodal蛋白、mRNA表达渐次增强(P<0.05)。

图1 膀胱癌和膀胱正常组织中Noda l蛋白、mRNA表达情况
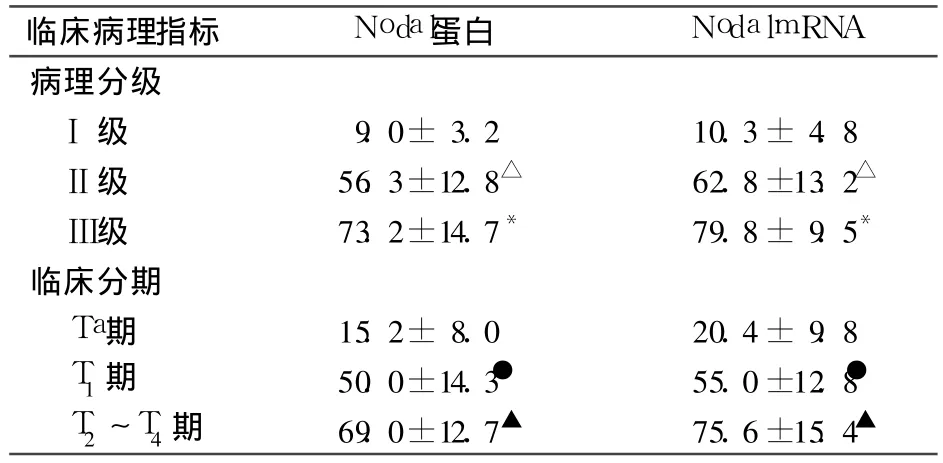
表1 Nodal表达与膀胱癌分级、分期的关系
3 讨论
Nodal是诱导中胚层和内胚层发育及干细胞分化调节的关键信号分子,并在机体左右非对称发育中起着非常重要的作用[5]。Nodal突变小鼠不能形成原条和完整的中胚层,仅形成一些零星的后端中胚层[6]。由Nodal介导的上下游信号通路在维持人胚胎干细胞分化多潜能性中发挥着非常重要的作用,阻断或干扰此信号通路能够影响胚胎细胞的分化发育[5]。而目前研究认为,肿瘤分化的多潜能性与干细胞非常相似,因此有学者推测在胚胎发育及干细胞分化调节中发挥重要作用的细胞因子可能在肿瘤的发生发展及转移中同样起着非常重要的作用[7,8]。
在胚胎干细胞中Nodal主要是通过与TGF-β1的Ⅰ型受体人间变性淋巴瘤激酶(ALKs)和Ⅱ型激活素样激酶受体(ActRⅡB)结合激活下游的Smads蛋白从而发挥生理作用[5]。目前研究认为 TGF-β1/ ALK/Smads信号通路对膀胱癌的发展起着促进作用[9],因此我们推测,随着正常组织向肿瘤组织的癌变,NodalmRNA被激活并开始表达Nodal蛋白,后者通过与ALKs及ActRⅡB所形成的异源二聚体受体复合物结合进行信号传导,这种结合使ActRⅡB激活并磷酸化ALKs,并进一步由ALKs激活磷酸化下游的Smad2/3,从而促进肿瘤组织的浸润生长及转移。
基于此理论,本研究通过Western blot及RTPCR检测膀胱癌组织中Nodal蛋白及mRNA发现,其在膀胱癌组织中呈高表达,在膀胱正常组织中不表达,同时Nodal表达的强弱与膀胱癌病理分级及临床分期存在一定的关系。随着膀胱癌恶性程度的增高及浸润性生长,Nodal的表达不断升高,这与国外研究人员在黑色素瘤中所观察到的结果一致[2,10]。可见Nodal表达的强弱与肿瘤组织的恶性程度之间存在一定的相关性。临床分期 Ta期及病理分级Ⅰ级的膀胱癌组织中即存在Nodal蛋白的表达,通过检测膀胱癌组织中Nodal蛋白或mRNA可间接反映其恶性程度。
本研究结果提示,Nodal蛋白与膀胱癌的发生发展存在着非常密切的联系,其可成为膀胱癌早期检测及治疗的重要靶点。
[1]Shen MM.Nodalsignaling:developmental roles and regulation[J]. Development,2007,134(6):1023-1034.
[2]Topczewska JM,Postovit LM,Margaryan NV,et al.Embryonic and tumorigenic pathways converge via Nodal signaling:role in melanoma aggressiveness[J].Nat Med,2006,12(8):925-932.
[3]Postovit LM,Margaryan NV,Seftor EA,et al.Human embryonic stem cellmicroenvironment suppresses the tumorigenic phenotype of aggressive cancer cells[J].Proc Natl Acad Sci USA,2008,105 (11):4329-4334.
[4]Huntly BJ,Gilliland DG.Cancer biology:summ ingup cancer stem cells[J].Nature,2005,435(7046):1169-1170.
[5]Schier AF,Shen MM.Nodal signalling in vertebrate development [J].Nature,2000,403(6768):385-389.
[6]Sm ith WC,McKendry R,RibisiS Jr,etal.A nodal-related gene defines a physical and functional domain within the Spemann organizer[J].Cell,1995,82(1):37-46.
[7]Monteiro J,Fodde R.Cancer stemnessandmetastasis:therapeutic consequences and perspectives[J].Eur JCancer,2010,46(7):1198-1203.
[8]Kulesa PM,Kasemeier-Kulesa JC,Teddy JM,et al.Reprogrammingmetastatic melanoma cells to assume a neural crest cell-like phenotype in an embryonic microenvironment[J].Proc Natl Acad Sci USA,2006,103(10):3752-3757.
[9]Li Y,Yang K,Mao Q,et al.Inhibition of TGF-beta receptor Iby siRNA suppresses themotility and invasiveness of T2~T4bladder cancer cells via modulation of integrins and matrixmetalloproteinase[J].Int Urol Nephrol,2010,42(2):315-323.
[10]Yu L,Harms PW,Pouryazdanparast P,et al.Expression of the embryonic morphogen Nodal in cutaneousmelanocytic lesions[J]. Mod Pathol,2010,23(9):1209-1214.

