燃煤型氟中毒大鼠睾丸组织中SCFmRNA的表达变化及意义
肖跃海,孙 发*,石家齐,谷 江,李崇斌,谢 春,夏曙华
(1贵阳医学院附属医院,贵阳 550004;2贵阳医学院公共卫生学院)
已有研究证实[1,2],睾丸支持细胞分泌的干细胞因子(SCF)对生精细胞的增殖、分化、发育及凋亡关系密切,同时又有研究表明,氟中毒可导致睾丸生精细胞凋亡增加,精子质量下降[3~6]。但关于睾丸SCFmRNA在燃煤型氟中毒后睾丸组织中的表达目前尚无报道。2008年 1月 ~2010年 8月,我们通过构建燃煤型氟中毒大鼠模型,观察睾丸支持细胞超微结构和睾丸组织中SCFmRNA的表达,探讨燃煤型氟中毒所致雄性大鼠生精障碍的机制。
1 材料与方法
1.1 实验动物及燃煤型氟中毒动物模型制作 雄性SD大鼠20只,重 90~110 g,由贵阳医学院实验动物中心提供。随机分为对照组、低氟组、中氟组、高氟组(后三组为染毒组),各5只。各组饲料成分相同(氟、玉米、豆粉、豆饼、麦麸、面粉、酵母粉、骨粉、芝麻饼、鸡蛋、奶粉、盐、菜油),含氟量及比例不同成分见表 1,余成分所占比例相同。自由饮用自来水。
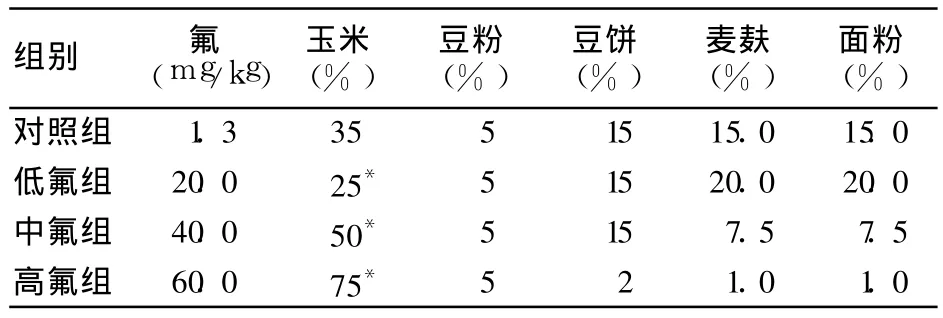
表1 各组动物饲料中氟含量及比例不同成分
1.2 检测方法
1.2.1 主要试剂及器械 Trizol试剂、焦碳酸二乙酯、总RNA提取试剂盒、反转录试剂盒。透射电子显微镜、紫外可见分光光度计、PCR扩增仪、凝胶成像分析系统,高速冷冻离心机。
1.2.2 检测指标及方法 喂饲90 d后,置大鼠于代谢笼,收集每只大鼠 24 h尿,用氟离子选择电极法测定尿氟水平;观察氟斑牙出现情况,参考氟斑牙分度标准[4]给予分度。均采用股动脉放血法处死大鼠,无菌取双侧睾丸。右侧睾丸称重用以计算脏器系数(睾丸系数=睾丸质量/大鼠体质量)。取左侧睾丸取部分组织用以电镜观察,部分组织采用RT-PCR法检测其中SCF mRNA表达变化。
1.2.2.1 睾丸支持细胞超微结构观察 冰盒上剔除白膜取睾丸组织,2.5%戊二醛固定,10%乙二胺四乙酸(EDTA)蔗糖缓冲液,1%锇酸后固定,梯度丙酮脱水,Epon 812浸透、包埋,6℃聚合12 h,制备超薄切片(50~70 nm),经醋酸双氧铀和枸橼酸铅双重染色后,透射电子显微镜观察。
1.2.2.2 RT-PCR法检测大鼠睾丸组织中SCF mRNA表达情况 ①总RNA提取:无菌状态下称取新鲜睾丸组织100 mg,提取总RNA,严格按照试剂盒说明书操作。提取总 RNA后用紫外分光光度计检测RNA纯度良好,经2%琼脂糖凝胶电泳显示3条带,提示RNA完整。②cDNA合成:取各组总RNA 1μl,反转录合成cDNA,按照反转录试剂盒说明书进行操作。③PCR目的片段扩增:从美国国立生物技术信息中心(NCBI)查找大鼠SCFmRNA系列,大鼠SCF引物系列、β-actin经Primer 5.0软件自行设计,由上海金斯瑞公司合成。SCF mRNA上游引物为5′-CAAAACTGGTGGCGAATCTT-3′、下游引物为5′-GCCACGAGGTCATCCACTAT-3′,242 bp; β-actin上游引物为 5′-CAAAACTGGTGGCGAATCTT-3′、下游引物系列为5′-GCCACGAGGTCATCCACTAT-3′,242 bp。PCR反应体系总体积50μl,反应条件:94℃预变性 5min,94℃变性 30 s,60℃退火 30 s,72℃延伸 30 s,共 35个循环,72℃终延伸5m in。分别取PCR产物于2.0%琼脂糖凝胶上电泳,用紫外观察仪进行观察拍照,用ImageJ软件系统半定量分析。以同一体系中目的基因产物电泳条带光密度值与内参照β-actin条带光密度值的比值来表示该样品SCFmRNA的相对表达水平。(100 bp的DNA Marker购自美国MBI公司)。
1.3.6 统计学方法 采用SPSS11.5统计软件。资料用±s表示,用t检验和F检验行统计分析。α =0.05。
2 结果
2.1 各组尿氟水平和氟斑牙发生情况 对照组及低、中、高氟组尿氟分别为(1.7±0.1)、(3.0± 0.1)、(6.0±0.1)、(13.0±0.3)mg/L,发生氟斑牙分别为 0、2、5、5只;低、中、高氟组与对照组比较,P均 <0.01。氟斑牙 0、Ⅰ、Ⅱ、Ⅲ度者,对照组分别为5、0、0、0只,低氟组分别为 3、2、0、0只,中氟组分别为 1、2、2、0只,高氟组分别为 0、1、3、1只,证明成功建立氟中毒模型。
2.2 各组大鼠体质量、睾丸质量及睾丸系数比较见表2。
表2 各组大鼠体重、睾丸重量及睾丸系数比较(±s)

表2 各组大鼠体重、睾丸重量及睾丸系数比较(±s)
注:与对照组相比,*P<0.05,△P<0.01
组别 体质量(g)右侧睾丸质量(g)右侧睾丸系数(%)对照组 377.8±6.18 1.814±0.02 0.480±0.01低氟组 375.4±5.55 1.734±0.03* 0.462±0.01*中氟组 375.8±3.56 1.718±0.02△ 0.457±0.01△高氟组 376.0±4.85 1.620±0.06△ 0.430±0.01△
2.3 各组支持细胞超微结构变化 电镜下对照组呈正常支持细胞表现;低、中、高氟组睾丸支持细胞胞质中初级溶酶体增多,核高度畸形,染色质边集,内质网增生并高度扩张,胞质空泡化,且随染氟剂量的增加核畸形加重。
2.4 SCFmRNA表达 低、中、高、氟组睾丸组织中SCFmRNA相对表达量分别为0.71±0.05、0.68± 0.01、0.49±0.02,均明显低于对照组的 0.73± 0.03(P分别 <0.05、0.01、0.01),且随着氟中毒剂量的增加,低、中、高氟组睾丸组织中SCFmRNA依次降低(P均<0.05)。
3 讨论
大量研究表明[6,7],过量氟可破坏睾丸生殖细胞的形态和功能。氟可直接作用于睾丸组织,破坏睾丸各级生精细胞、支持细胞、间质细胞及精子,导致精子畸形率增加、精子密度和精液质量下降,燃煤型氟中毒是我国特有的氟中毒类型,我们前期研究发现,燃煤型氟中毒和其他类型氟中毒相似,可导致生殖细胞的凋亡,影响精子质量,但氟中毒所致生殖细胞凋亡机制至今尚不清楚。
SCF在睾丸组织中由睾丸支持细胞分泌,由于蛋白水解酶酶切位点不同,SCF分为sSCF和mSCF两类,前者主要在造血系统中起作用,促进骨髓造血细胞的增殖、分化、成熟;后者主要在睾丸组织中起作用,与生精关系密切[8]。在睾丸组织中,mSCF介导生精细胞黏附到支持细胞,诱导精原细胞由G1期向 S期过渡,促进精原细胞增殖分化,减少精原细胞过度凋亡[9]。有研究发现[10],给予大鼠睾丸支持细胞损害剂2,5-己二酮后,总SCF mRNA的表达降低,其中模型mSCFmRNA降低明显,sSCFmRNA无明显变化,表明睾丸组织中SCF mRNA可以反映生精障碍。
本研究结果显示,染氟 90 d后,对照组与各染氟组比较,大鼠的体重的变化不明显,各染氟组大鼠睾丸质量及睾丸系数较对照组有所下降,与文献[11,12]的观点相符。此外,与对照组比较,各染毒组睾丸支持细胞的超微结构发生了明显变化:初级溶酶体增多,核高度畸形,染色质边集,内质网增生并高度扩张,胞质空泡化,胞质电密度增高多突起,细胞间隙大。损伤程度随染剂量的增加而加重。本研究结果还显示,染氟 90 d后,低、中、高氟组睾丸组织中SCFmRNA较对照组下调,并随着氟中毒程度的加重而表达逐渐降低(P<0.05),表明染氟程度与SCF表达有关。
精子的发生是一个复杂的过程。睾丸支持细胞是睾丸中唯一产生SCF的细胞,SCF与生精过程的启动有关,与生精细胞分化、增殖、营养、支持、保育及吞噬密切相关,调控精子排放[1,2,8]。我们推测,氟可能影响睾丸支持细胞的超微结构,从而下调了SCFmRNA的表达,导致生精功能变化。氟影响睾丸组织表达SCFmRNA的具体机制有待于进一步研究。
[1]Reber L,Da Silva CA,Frossard N.Stem cell factor and its receptor c-kitas targets for inflammatory diseases[J].Eur J Pharmacol, 2006,533(1-3):327-340.
[2]姜春霞,范清堂,程学敏,等.染氟大鼠生精细胞凋亡和血清雌二醇水平的关系[J].卫生研究,2006,34(1):32-35.
[3]Krasowska A,W lostowski T.Photoperiodic elevation of testicular zinc protects seminiferous tubules against fluoride toxicity in the bank vole(Clethrionomysglareolus),comp[J].Biochem Physiol, 1996,113(1):81-84.
[4]谢春,张华,喻茂娟,等.燃煤型氟中毒大鼠血清骨保护素的变化[J].中国地方病学杂志,2005,24(4):378-381.
[5]Krasowska A,Włostowski T,Bonda E,et al.Zinc protection from fluoride-induced testicular injury in the bank vole(Clethrionomys glareolus)[J].Toxicol Lett,2004,147(3):229-235.
[6]李红蕾,房慧伶.氟对小鼠生精细胞凋亡的影响及锌的保护作用[J].广西农业生物科学,2008,27(B 06):35-39.
[7]Dvorákorá-HortováK,Sandera M,JursovàM,etal.The influence of fluoridesonmouse sperm capacitation[J].Anim Reprod Sci,2008, 108(1-2):157-170.
[8]Fox RA,Sigman M,Oekelheide K.Transmembraneversus soluble stem cell factor expressionin human testis[J].JAndrol,2000,21 (4):579-585.
[9]Feng LX,Ravindranath N,Dym M.Stem cell factor/c-kit up-regulates cyclin D3 and promotes cell cycle progression via the phosphoinositide 3-kinase/p70 S6 kinase pathway in sper-matogonia [J].JBiol Chem,2000,275(33):25572-25576.
[10]Allard EK,Blanchard KT,Boekelheide K.Exogenous stem cell factor compensates for altered endogenous SCF expression in 2,5-hexanedione induced testicular atrophy in rats[J].Biol Reprod,1996, 55(1):185-193.
[11]Gupta RS,Khan TI,Agrawal D,et al.The toxic effects of sodium fluoride on the reproductive system ofmale rats[J].Toxicol Industrial Health,2007,23(9):507-513.
[12]Ghosh D,Das S,Maiti R,etal.Testicular toxicity in sodium fluoride treated rats:association with oxidative stress[J].Reprod Toxicol, 2002,16(4):385-390.

