光动力疗法在骨肉瘤治疗中的初步实验探讨
龚海洋, 胡 硕, 姚建忠, 蔡郑东
骨肉瘤是高度恶性的间叶组织肿瘤,是儿童和青少年最常见的原发骨恶性肿瘤,大约80%~90%发生于四肢长管状骨干骺端。近25年来,尽管国际诸多研究机构进行了大量的努力,但骨肉瘤生存率依然停滞不前。目前主要治疗方法仍为手术和放化疗[1]。虽然近年来出现了各种手术方式的改良及放化疗方案的改进,但收效甚微。临床中经常遇到的情况是患者在就诊时肿瘤的体积已经很大,完整切除相当困难,广泛切除更是很难实现。邻近关节、重要神经血管的肿瘤在实行保肢手术的同时,瘤床周围可能残留有镜下病灶。发生于脊椎、脊柱旁、骶尾部、腹膜后区的骨与软组织恶性肿瘤往往与周围重要组织脏器粘连,完整切除难以实现。放疗常常损伤临近的血管、神经及重要脏器,疗效亦不甚理想[2]。多药耐药则是骨肉瘤化疗失败的主要原因[3]。
18世纪末,Niels Finsen成功地利用日光和人工光照射治疗皮肤结核病,率先开启了光动力疗法的研究。光动力疗法的基本原理是利用肿瘤细胞及正常组织细胞对光敏剂有不同亲和性的特点,肿瘤组织摄取和存留的光敏剂较多[4],当光敏剂选择性地聚集于病变部位的肿瘤细胞后,使用适当波长(通常500~800 nm)的可见光对病变的部位进行照射。光敏剂吸收光子的能量跃迁到激发态,在氧分子存在的情况下,受激发的光敏剂将能量传递给氧,产生一些氧化活性分子(radical oxygen species, ROS)。ROS通过氧化作用来攻击细胞结构,这种损伤可能造成细胞膜或蛋白的氧化损伤。当氧化损伤的积累超过一定阈值时,肿瘤细胞便开始死亡[5],进而达到治疗目的。进入新世纪以来,国际上关于光动力治疗的基础研究和临床应用不断深入和扩展[6]。目前国内对于光动力疗法(photodynamic therapy,PDT)治疗骨肉瘤的研究还不是很多。本课题小组率先于2009年在国内开展光敏剂苯并叶绿卟啉(BCPD-17)对骨肉瘤细胞(LM-8)杀伤效应的实验研究,报道如下。
1 细胞实验
观察不同照射能量,不同光敏剂浓度下肿瘤细胞抑制率的变化,并在电镜下观察细胞形态学变化。
1.1 材料与方法
1.1.1 细胞株与主要试剂 小鼠骨肉瘤细胞株LM-8,由Tatsuya Asai等建立并赠送;光敏剂BCPD-17 (Benzochloroporphyrin derivative-17) 脂质体剂型(5 mg/mL),由第二军医大学药学院姚建忠教授提供;溴化四氮唑蓝(MTT);二甲基亚砜(DMSO)。
1.1.2 实验分组 分为空白对照组(不加光敏剂,不接受激光照射)、暗毒性组(只加光敏剂,不接受激光照射)、激光组(不加光敏剂,只接受激光照射)、PDT组(加光敏剂及激光照射,同时设置不同的光敏剂浓度和激光的剂量)4组。
1.1.3 MTT法测定抑制率 活细胞线粒体中的琥珀酸脱氢酶能使外源性的MTT还原为难溶性的蓝紫色结晶物并沉积在细胞中,而死细胞无此功能。二甲基亚砜(DMSO)能溶解细胞中的紫色结晶物,应用酶联免疫检测仪在波长为540 nm处测定其光吸收值,可间接反应活细胞的数量并推算死细胞的数量。在一定细胞数范围内,MTT结晶物形成的量与细胞数成正比。按以下公式计算抑制率:
抑制率(%)= (对照孔OD值-实验孔OD值)/对照孔OD值×100%。
1.1.4 电镜观察 激光共聚焦显微镜(LSCM)观察对数生长期细胞形态学改变及细胞器改变。
1.1.5 统计学处理 采用SPSS 12.0统计软件包对结果进行t检验,以P<0.01为差异有统计学意义。
1.2 实验结果
1.2.1 LM-8细胞PDT 24 h后的OD540值及细胞抑制率(见表1、2)

表1 不同BCPD-17浓度、不同激光剂量PDT 24 h后的小鼠骨肉瘤LM-8细胞OD540值
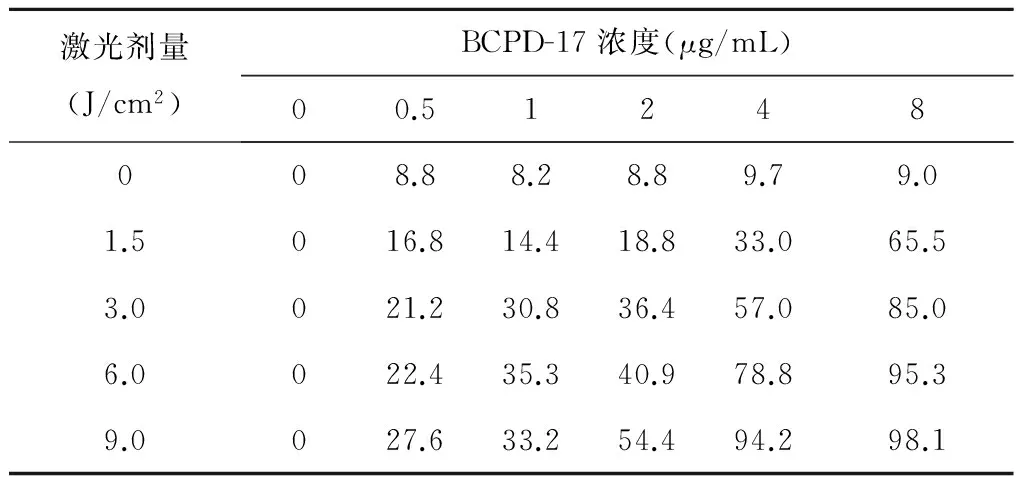
表2 不同BCPD-17浓度、不同激光剂量PDT 24 h后小鼠骨肉瘤LM-8细胞体外抑制率(%)
结果显示:PDT 24 h后,光敏剂BCPD-17对LM-8细胞有明显的杀伤作用。从表1中可见随光敏剂浓度及激光光照剂量的提高,小鼠骨肉瘤LM-8细胞的OD540值显著下降。当BCPD-17>4 μg/mL时,不同剂量激光照射后的OD540值显著下降,结果与空白组比较有统计学意义。从表2中可见单纯的光照和单纯加光敏剂对LM-8细胞均无明显的杀伤作用。当BCPD-17>4 μg/mL和光照能量>3 J/cm2时,抑制率>50%。
1.2.2 细胞形态学变化 暗毒性组、激光照射组及空白对照组LM-8细胞的形态均正常,呈多角形生长,结构完整,生长状态良好(图1)。HE染色见空白对照组的细胞形态正常,呈多角形生长,细胞核大而深染,可见核分裂相,细胞质呈均质红染(图2);2 μg/mL PDT组可见个别的坏死细胞;4 μg/mL组可见细胞坏死比例显著增多,细胞肿胀,胞膜破裂,胞质外流,细胞溶解坏死(图3);8 μg/mL组可见细胞大部分坏死,细胞质已弥散,多见细胞核固缩、崩裂、核膜裂解。

图1 正常小鼠骨肉瘤LM-8细胞,结构完整

图2 正常LM-8细胞HE染色,细胞核大深染,可见核分裂相,胞浆均质红染(×200)
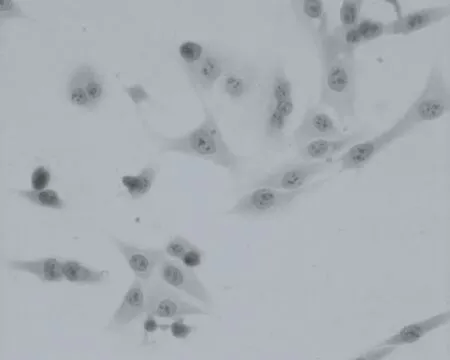
图3 浓度4 μg/mL BCPD-17-PDT组,细胞坏死比例增多,胞膜破裂,胞质外流,细胞溶解坏死(×200)
2 动物实验
建立小鼠移植骨肉瘤皮下模型,手术边缘切除肿瘤后,联合应用BCPD-17介导的光动力辅助治疗,观察是否降低肿瘤的局部复发率。
2.1 材料与方法
2.1.1 实验动物及实验仪器 细胞及光敏剂来源同上;C3H 4周龄雌性小鼠30只,体重18~22 g,由北京维通利华实验动物技术有限公司提供,动物合格证号为SCXK(京)2006-2009;PDT630激光肿瘤治疗仪,为半导体激光机,输出功率0-1W可调,光纤最大输出功率>1W,波长630 nm,由桂林市兴达光电医疗器械有限公司提供;LX-Ⅲ功率计,中国计量研究院生产,矫正系数为0.99,由第二军医大学药学院提供。
2.1.2 LM-8骨肉瘤模型的建立 荷瘤模型成功后,待皮下瘤块直径约10~12 mm时,选取半球形、生长良好、表皮无破溃的小鼠进行光动力实验。
2.1.3 实验分组与治疗方法 荷瘤小鼠肿瘤直径达10~12 mm时,随机分为3组:(1)对照组:仅边缘切除肿瘤而无光动力治疗;(2)手术联合低能量密度PDT组:静脉注射BCPD-17(5 mg/kg),6 h后行肿瘤边缘切除联合激光照射(激光波长630 nm,功率密度200 mW/cm2,能量密度240 J/cm2,照射时间20 min,光斑1.5 cm);(3)手术联合高能量密度PDT组:除激光能量密度为360 J/cm2外,其余操作同(2)。
2.1.4 观测指标 小鼠肿瘤边缘切除后观察4周,观测对照组与手术联合光动力治疗组的肿瘤复发情况。
2.1.5 统计学方法 各组实验数据以例数表示,检验比较各组复发率的情况,统计软件为SPSS 12.0,P<0.05为差异有统计学意义。
2.2 实验结果
手术联合光动力疗法后,大大抑制肿瘤边缘切除后的局部复发,减少了复发率,其中高能量密度组与对照组的差异有统计学意义(表3)。光动力治疗4周后,对照组10只小鼠中,仅1只小鼠没有复发,其余9只小鼠在病灶切缘出现隆起肿块,表明局部复发(图4)。治疗组中,早期各组小鼠的手术区中心下陷,光照区形成焦痂,可见切缘皮下组织也有坏死,在联合治疗的高剂量激光组(360 J/cm2)更加明显。但后期愈合良好,边缘切除术联合光动力治疗无伤口延迟愈合或皮肤缺损等副作用。联合治疗4周后,手术联合PDT治疗的低剂量激光组(240 J/cm2)10只小鼠中4只小鼠出现肿瘤局部复发,而在高剂量激光组(360 J/cm2)小鼠中只有2只局部复发,其余未见复发(图5)。

表3 手术联合光动力治疗4周后,各组的肿瘤复发情况
注:#P<0.05(与对照组相比)

图4 对照组病灶切缘出现隆起肿块,表明局部复发

图5 治疗组小鼠病灶切缘未见复发
3 讨论
本实验初步了解了小鼠骨肉瘤细胞LM-8对光动力疗法的反应方式,BCPD-17光动力疗法可以抑制小鼠骨肉瘤细胞LM-8的生长,抑制率与光敏剂浓度及激光剂量成正相关。同时光敏剂药物本身不具备暗毒性,单纯的光照对细胞也没有明显的抑制作用。在动物实验中,手术边缘切除肿瘤后,联合应用BCPD-17介导的光动力辅助治疗,能够降低肿瘤的局部复发率,高剂量激光组(360 J/cm2)与对照组比较差异有统计学意义(P<0.05)。
我们应用光敏剂BCPD-17进行骨肉瘤的光动力研究,在对小鼠骨肉瘤细胞LM-8体外光动力实验显示,BCPD-17有明显的细胞毒作用。光动力的细胞毒作用依赖BCPD-17浓度和激光照射剂量。激光照射剂量相同时,BCPD-17浓度越高,细胞内积聚的光敏剂就越多,在受到激光照射时,其光敏化效率就越高,抗肿瘤作用越强。同理,相同BCPD-17浓度下,随着激光照射的剂量越高,光敏化产生的单线态氧等光毒性产物亦随之增加,所产生的光动力学杀伤效应也越强。单独用激光照射以及单独用BCPD-17无激光照射时均未看到抗肿瘤作用,这也反映出光动力治疗的靶向性特点。
光动力作用引起的细胞死亡,有凋亡与坏死两种方式,光敏剂的性质对于细胞的死亡机制有重要影响。有研究表明PDT对膜结构最具破坏性,特别是线粒体膜和溶酶体[7-8]。线粒体光损伤后,细胞色素C释放,由此开始的凋亡级联反应最终导致细胞凋亡[9]。光动力疗法诱使细胞结构解体及遗传信息改变,进而可直接诱发肿瘤细胞死亡[10-11]。本实验观察到在BCPD-17浓度为4 μg/mL光照能量为3 J/cm2时对LM-8细胞开始有显著的杀伤效果,形态学观察可见大多数细胞胀大,细胞器破坏辨认不清,胞膜破裂,细胞内容物释放,进而细胞死亡,但对其机制仍需做进一步的深入研究。
光动力疗法(PDT)是一种应用于局部肿瘤病变的治疗方法,它的优势是可以保护周围正常组织的解剖和功能,使晚期肿瘤的微创手术切除和辅助治疗[12-13]成为可能。使用PDT的主要目的是避免手术、减少手术的范围或者是避免高剂量放射治疗产生的并发症,因此,PDT已经可以应用于不同分期的肿瘤患者的治疗,既可以用作缓解症状,辅助手术治疗,也可以作为一个原发肿瘤的治疗方法并可预防上皮不典型增生发展成癌症。
PDT目前尚有许多课题有待研究和探索,如(1)PDT与手术、放疗、化疗等如何更合理地结合,探索PDT使用的最佳时机,以最大限度地灭活残余病灶,提高恶性肿瘤的治愈率;(2)研制更加有效的光敏剂,解决PDT杀伤深度问题,从而治疗大体积肿瘤;(3)对激光光源的深入研究,解决光敏剂和与之匹配并有足够输出功率的稳定单色光源问题,做到最大限度地作用于肿瘤组织,而对正常组织损伤减至最低,真正体现PDT选择性治疗的特性等等。PDT治疗在我国开展的时间不长,临床经验较少,随访时间不足,尤其是在骨肿瘤治疗方面才刚刚起步,对于体积较大的骨与软组织恶性肿瘤,治疗的报道更少,有待进一步的临床和实验研究。
[1] Marec-Bérard P, Chotel F, Claude L. PNET/Ewing tumours: current treatments and future perspectives[J]. Bull Cancer, 2010, 97(6):707-713.
[2] Sheplan LJ, Juliano JJ. Use of radiation therapy for patients with soft-tissue and bone sarcomas[J]. Cleve Clin J Med, 2010, 77(Suppl 1):S27-29.
[3] Oudard S, Marie JP, Pujade Lauraine E. MDR (Multiple Drug Resistant) type of resistance to chemotherapy in clinical practice[J]. Bull Cancer, 1996, 83(8):609-618.
[4] Mang TS, Dougherty TJ, Potter WR, et al. Photobleaching of porphyrins used in photodynamic therapy and implications for therapy[J]. Photochem Photobiol, 1987, 45(4):501-506.
[5] Henderson BW, Dougherty TJ. How does photodynamic therapy work?[J]. Photochem Photobiol, 1992, 55(1):145-157.
[6] Brown SB, Brown EA, Walker I. The present and future role of photodynamic therapy in cancer treatment[J]. Lancet Oncol, 2004, 5(9): 497-508.
[7] Lavi A, Weitman H, Holmes RT, et al. The depth of porphyrin in a membrane and the membrane’s physical properties affect the photosensitizing efficiency[J]. Biophys J, 2002, 82(4):2101-2110.
[8] Mak NK, Li KM, Leung WN, et al. Involvement of both endoplasmic reticulum and mitochondria in photokilling of nasopharyngeal carcinoma cells by the photosensitizer Zn-BC-AM[J]. Biochem Pharmacol, 2004, 68(12): 2387-2396.
[9] Granville DJ, Cassidy BA, Ruehlmann DO, et al. Mitochondrial release of apoptosis-inducing factor and cytochrome c during smooth muscle cell apoptosis[J]. Am J Pathol, 2001,159(1):305-311.
[10] Pogue BW, Ortel B, Chen N, et al. A photobiological and photophysical-based study of phototoxicity of two chlorines[J]. Cancer Res, 2001, 61(2):717-724.
[11] Rancan F, Wiehe A, Nöbel M, et al. Influence of substitutions on asymmetric dihydroxychlorins with regard to intracellular uptake, subcellular localization and photosensitization of Jurkat cells[J]. J Photochem Photobiol B, 2005, 78(1): 17-28.
[12] Lou PJ, Jager HR, Jones L, et al. Interstitial photodynamic therapy as salvage treatment for recurrent head and neck cancer[J]. Br J Cancer, 2004, 91(3):441-446.
[13] Yamamoto J, Hirano T, Li S, et al. Selective accumulation and strong photodynamic effects of a new photosensitizer, ATX-S10.Na(II), in experimental malignant glioma[J]. Int J Oncol, 2005, 27(5):1207-1213.

