鹦鹉热嗜性衣原体特异性TaqMan-M GB探针荧光定量PCR检测方法的建立与应用*
冯 悦,张忠华,龚福明,柳陈坚
鹦鹉热嗜性衣原体特异性TaqMan-M GB探针荧光定量PCR检测方法的建立与应用*
冯 悦,张忠华,龚福明,柳陈坚
目的 建立一种特异、灵敏、重复性好的鹦鹉热嗜性衣原体的 TaqMan-M GB荧光定量PCR检测方法。方法利用鹦鹉热嗜性衣原体MOM P基因的特异保守序列设计引物和M GB探针,通过优化,获得最佳反应体系与反应条件,同时进行特异性、重复性、灵敏性评价与Spike-test实验进行临床应用性评价,利用该检测方法对禽鸟类粪便样品进行检测,并与常规PCR检测方法进行比较。结果该方法在0.01pg~100pg范围内线性相关系数为0.999,扩增效率为97.7%;对鹦鹉热嗜性衣原体菌株检测结果均呈现阳性,而非鹦鹉热嗜性衣原体菌株及其它衣原体菌株为阴性;重复性试验中,变异系数为0.317%~0.563%;检测灵敏性为0.01pg;Spike-test试验中最低检出量为25个 EB;该方法对禽鸟类粪便样品的检出率为14.3%(40/282),高于常规PCR检测法的7.4%(21/282)。结论本文所建立的Taqman-M GB荧光定量PCR检测法是一种灵敏、高效、稳定,可在嗜性衣原体属中准确检测鹦鹉热嗜性衣原体的方法,该方法的建立更有意于今后对禽鸟类实施鹦鹉热的临床诊断与分子流行病学研究。
鹦鹉热嗜性衣原体;荧光定量PCR;M GB探针;MOM P基因
鹦鹉热嗜性衣原体(Chlam ydophila psittaci,C.psittaci)是一类专性细胞内寄生的人兽共患病病原体,对鸟类、家禽和家畜有很强的感染性,可以通过接触或吸入具有感染性禽类分泌物与排泄物而感染人类,从而引起非典型性肺炎与败血症以及结膜炎、心肌炎、脑膜炎等疾病〔1〕,被国际兽疫局列为二类传染病〔2〕。近年来,随着 PCR技术的迅速发展,荧光定量PCR技术有着灵敏性高、特异性强、重复性好等特点已经被广泛应用于衣原体和嗜性衣原体的检测中〔3〕。常用的荧光定量 PCR技术主要有染料法与探针法两种,SYBR Green I和TaqMan探针法最为普遍,两者相比,TaqMan探针法特异性和灵敏性俱佳,其中 TaqM an-M GB探针是一类新型3′端经特殊处理的高特异性探针,能检测模板结合区甚至1个碱基的突变基因,且本底荧光信号低,准确率高〔4〕。本研究兼顾 TaqMan-M GB探针的特点,在鹦鹉热嗜性衣原体主要外膜蛋白 (majo r outer memberane protein,MOM P)区建立了特异性TaqM an-M GB探针荧光定量 PCR检测体系,并对昆明市282例禽鸟类粪便样本进行鹦鹉热嗜性衣原体检测。
1 材料与方法
1.1 材料
1.1.1 实验菌株 鹦鹉热嗜性衣原体菌株6株分别为:C.psittaci Bud-1,C.psittaci WC,C.psittaci NJ-1,C.psittaci Helijica,C.psittaci 6BC,C.psittaci Cal-10。非鹦鹉热嗜性衣原体菌株6株:C.pneum oniae AR-39、C.pecorum IPA、C.pecorum M aeda、C.abortus B577、C.felis Fe/C-56、C.caviae OKM-2。衣原体菌株3株:C.trachom atis A/G、C.m uridarum Mo Pn、C.suis CS 0301。
上述菌株均由日本国立感染症研究所Dr.kishimo to教授提供。
鹦鹉热嗜性衣原体与衣原体菌株的培养:应用Hela229细胞繁殖(人宫颈癌上皮细胞系,A YCC CCL-2.1)购自中科院上海细胞生物学研究所。
1.1.2 禽鸟类样本 本研究用282例禽鸟类粪便样本,采自云南省昆明市内两家动物园和5家花鸟宠物市场。
1.1.3 引物与探针设计 针对鹦鹉热嗜性衣原体的外膜主蛋白(MOM P)的可变3区(VD3)的基因保守序列,设计引物及探针序列为 MOM PF:5-TGTGA TTCACAAACCAA GAGGCTA TA-3;
MOM PR:5-CGAGGCCTACTTGCCA TTCA-3;MOM P:(FAM)5-TA TGTTTAGGCA TCTAAAAC-3(M GB)。探针和引物均由美国 App lied Biosystem s(AB I)公司合成。
1.1.4 主要试剂和仪器 衣原体DNA提取试剂盒(美国 Gentra System s公司);禽类粪便DNA抽提试剂盒(美国 Q IAGEN公司);嗜性衣原体免疫荧光标识单克隆检测试剂盒(日本Denka生研株式会社);AB I 7500 real-time PCR仪(美国 App lied Biosystem s公司)。
1.2 主要方法
1.2.1 鹦鹉热嗜性衣原体滴度测定 24孔板中制备单层 He1a 229细胞,以等量连续5~8个梯度10倍稀释的鹦鹉热嗜衣原体悬液感染细胞,每个稀释度设置3个复孔,置37 ℃、5%CO2培养箱中培养2h后换新鲜培养液,培养48h。按照嗜性衣原体的免疫荧光标识单克隆抗体检测试剂盒所规定的步骤进行滴度测定。
1.2.2 DNA提取及荧光定量PCR反应体系和反应条件确立 鹦鹉热嗜性衣原体菌株和粪便样品的DNA提取严格按照试剂盒操作进行。选择56℃、58℃、60℃、62℃确定最适退火温度,以矩阵法对引物浓度和探针浓度进行优化,以期达到最佳扩增效率。
1.2.3 荧光定量PCR标准曲线的构建 将已知浓度的C.psittaci Bud-1菌株的DNA进行10倍梯度稀释成100 pg~0.01 pg五个浓度,根据反应结果中样品的分子数的对数值及其Ct值的对应关系绘制出定量标准曲线。
1.2.4 Taqman-M GB荧光定量PCR检测体系的评价
1.2.4.1 检测方法特异性 利用该检测方法对鹦鹉热嗜衣原体6株和非鹦鹉热嗜衣原体及衣原体菌株的9株由来的DNA进行荧光定量 PCR反应,根据PCR反应曲线和 Ct值确定该检测方法的特异性。
1.2.4.2 检测方法重复性 以 C.psittaci Bud-1菌株由来浓度分别为100 pg~1 pg的DNA作为模板进行荧光定量 PCR反应,计算每个稀释度Ct值和拷贝数的标准偏差(S)与变异系数(CV)。
1.2.4.3 检测方法灵敏性 据分光光度计检测得到的标准菌株 C.psittaci Bud-1的DNA浓度,将DNA进行10倍梯度稀释成0.001 pg~100 pg六个浓度进行 PCR反应。以Ct值<37为下限判定该方法的灵敏性。
1.2.4.4 spike-test试验 将标准菌株 C.psittaci Bud-1用 Hela 229进行扩增培养,利用荧光标识单克隆抗体检测并确定其EB浓度,随后调制成107~100个 EB,添加 200 m g鸟类的阴性粪便,提取DNA并进行定量PCR测定。
1.2.5 检测体系阳性结果的判定方法 荧光定量的结果以Ct值<37并且扩增曲线呈S型为阳性判定原则,其中Ct值<35且扩增曲线良好可直接判定为阳性;Ct值在35~37之间需要重复3次实验,两次实验均能得到良好扩增曲线方可判断为阳性。
2 结 果
2.1 荧光定量PCR反应体系和反应条件的确立普通PCR在退火温度60℃条件下扩增条带位置准确,条带清晰无非特异性扩增,因此60℃为该检测体系的最适退火温度。总反应体系25μL,2×Taqman universal 12.5μL,MOM P基因上下游引物浓度分别为 10μmol/L(各 2.25μL),探针浓度为5μmol/L(1.25μL),模板 DNA 5μL,用 ddH2O 补足至25μL。反应条件为50℃2 m in 1个循环;95℃10min 1个循环;95℃15s,60℃1min,40个循环,荧光采集信号设于60℃30s处。在上述条件下获得的值Ct较小,而△R最大。
2.2 检测体系标准曲线的确立 将已知拷贝数的标准菌株C.psittaci Bud-1的DNA进行十倍梯度稀释成五个浓度,每个浓度设定3个平行试验,进行相应的荧光定量PCR反应。以荧光强度的对数值为横坐标,循环数为纵坐标作图,得到标准曲线,如图1所示:Y=-3.377×log(X)+26.397,扩增效率为97.7%,相关系数R2=0.999。由此可见本检测体系的标准曲线扩增效率高,荧光曲线与所检测的靶基因浓度之间相关性好,准确性强。

图1 鹦鹉热嗜性衣原体Real time PCR标准曲线Fig.1 Standard curve of real-time PCR for C.psittaci detecting
2.3 检测体系特异性评价 利用该检测方法对15株鹦鹉热嗜性衣原体与非鹦鹉热嗜性衣原体及衣原体进行检测,图2结果显示,所有鹦鹉热嗜性衣原体(每株样品设定3个平行试验)的MOM P基因检测均呈现阳性,其它嗜性衣原体及衣原体的该基因检测均为阴性。由此可见,该检测方法对鹦鹉热嗜性衣原体具有极佳的特异性。
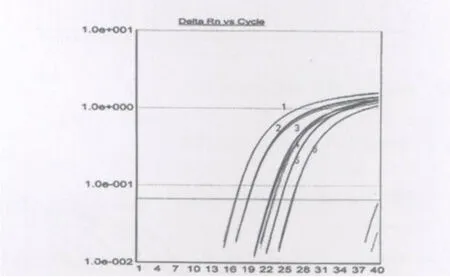
图2 鹦鹉热嗜性衣原体Real time PCR检测特异性Fig.2 Specificity test of C.psittaci real-time PCR 1.C. psittaci WC;2.C. psittaci Bud-1;3.C.psittaci Cal-10;4.C.psittaci 6BC;5.C.psittaci Helijica;6.C.psittaci NJ1
2.4 检测体系的重复性评价 以鹦鹉热嗜性衣原体10倍梯度稀释的三个不同浓度的DNA为模板,对该检测体系的重复性进行评价,每个浓度采用5个平行试验。通过对各浓度所对应的Ct值的计算结果显示,各浓度的平行试验所获得的Ct值之间的变异系数均小于1%(如表1所示)。由此可见,该检测方法具有较好的重复性。
2.5 检测体系的灵敏性评价 将DNA进行10倍梯度稀释成6个浓度,随后进行荧光定量PCR反应,结果如图3所示,该检测体系的最低检出量为0.01pg,与常规 PCR方法的1pg相比〔5〕,其灵敏度高出100倍。由此可见,该检测方法的检测灵敏度较佳。
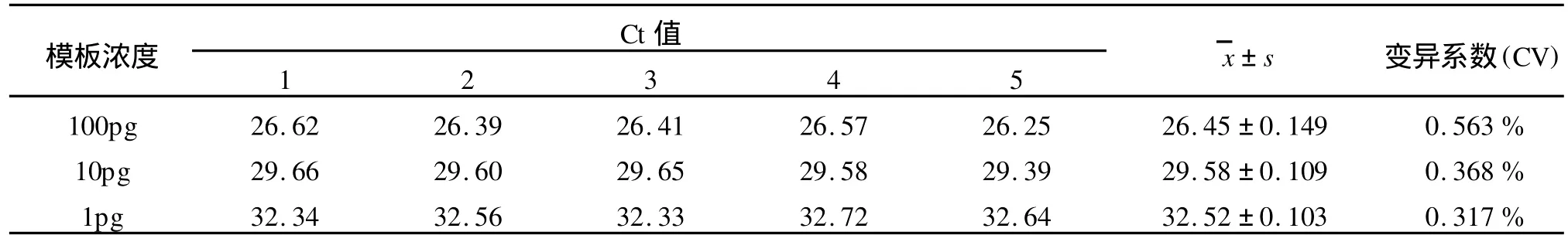
表1 荧光定量PCR检测鹦鹉热嗜性衣原体的MOMP基因重复性试验结果Table 1 Resultsof reproducibility for detecting MOMP gene of C.psittaci
2.6 Spike-test试验分析 为了进一步探讨该检测方法的临床应用性,由此实施了Spike-test试验,具体结果如图4所示,当阴性粪便中加入250个 EB,随后进行DNA抽提,并将所抽提的DNA的十分之一供于该检测体系进行检测,3次重复试验结果均呈现阳性,其Ct平均值为36.8。由此可以判定,该检测体系能够应用于临床对鹦鹉热嗜性衣原体进行检测,其最低检测灵敏度为25个EB。

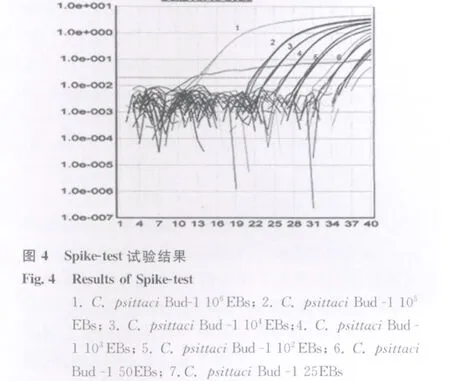
2.7 粪便样品的检测结果 应用该检测体系对采自云南省昆明市两家动物园与5家花鸟宠物市场的282份禽鸟类粪便进行了检测,并与之前所报道的常规PCR检测嗜性衣原体的方法进行比较,结果显示,荧光定量PCR的检出率为14.3%(40/282);而常规PCR的检出率则为7.4%(21/282),由此可见,荧光定量PCR检测明显优于常规PCR检测法〔5〕。
3 讨 论
嗜性衣原体属包括鹦鹉热嗜性衣原体(C.psittaci)、肺炎嗜性衣原体(C.pneumniae)、反刍动物嗜性衣原体(C.pecorum)、流产嗜性衣原体(C.abortus)、猫嗜性衣原体(C.felis)和豚鼠嗜性衣原体(C.caviae)〔6〕,其中肺炎嗜性衣原体属于人源嗜性衣原体,其它五种均属于动物源嗜性衣原体〔7〕。动物源嗜性衣原体广泛分布于世界各地,引起动物和人的多种疾病,特别是鹦鹉热嗜性衣原体和流产嗜性衣原体,可由动物传染给人,导致严重的人兽共患性疫病(zoonotic infections)〔8〕。
随着分子生物学技术的迅速发展,近年来聚合酶链反应(PCR)技术的成熟,诸如 RT-PCR、巢式 PCR(nest-PCR)、双重常规PCR等多种PCR检测方法被广泛应用于衣原体的检测,常规PCR检测易出现交叉污染、假阳性率高、不能进行准确定量等缺陷,而荧光定量PCR技术则具有实时监测、精确定量、灵敏度高、特异性强、重复性好等优点,因此,近年来已被广泛应用于病原体的定性与定量检测中。对于鹦鹉热嗜性衣原体的检测,大部分研究主要基于16S rRNA设计引物和探针〔9〕,由于该基因保守性极佳,因此是PCR反应的理想目的基因,由此造成该基因很难区分嗜性衣原体,尤其是鹦鹉热嗜性衣原体和流产嗜性衣原体。除此之外,Menard研究组〔10〕与 Alexandra Pantchev研究组〔11〕分别针对incA和om pA基因建立了鹦鹉热嗜性衣原体TaqMan探针的荧光定量PCR检测方法,但均不能很好区分 C.psittaci和 C.abortus。MOMP是衣原体表面的重要膜蛋白,可诱导机体产生抗衣原体中和抗体。利用MOMP基因设计引物和探针具有很高特异性,从而能更好地区分 C.psittaci与 C.abortus,吴东海等〔12〕和王争强等〔13〕均针对MOMP基因建立了鹦鹉热嗜性衣原体SYBR I的荧光定量PCR的检测方法,该方法有灵敏性好、操作简单、成本低等特点,但与 TaqMan探针法相比特异性差,假阳性率高。本研究利用的 TaqMan-MGB探针是近几年研发的新型探针,与一般 Real-time PCR及 TaqMan探针相比,具备荧光本底低,分辨率更高,杂交稳定性及特异性更强,敏感度更高,结果更精确,可将探针的 Tm值提高10℃左右等优点。该方法高特异性检测鹦鹉热嗜性衣原体能很好地区分C.psittaci和 C.abortus。至今国内还未报道鹦鹉热嗜性衣原体的 TaqMan探针荧光定量PCR检测方法,该方法的建立,填补了我国在该病原体临床检测技术上的空白。
为了进一步评价该检测体系在临床上的应用性,本研究设计了Spike-test试验,对其临床应用性进行了相应的评价,其结果显示,该方法对粪便样本的最低检出值为25个EB。本spike试验设计为该检测方法进一步应用于鹦鹉热嗜性衣原体的临床诊断与分子流行病学研究,以及在非典型性肺炎爆发时的临床鉴别诊断提供了更为坚实可靠的科学保障。
〔1〕Sachse K,Grossmann E.Chlamydial diseases of domestic animalszoonotic potential of the agents and diagnostic issues〔J〕.Dtsch Tierarztl Wochenschr,2002,109(4):142-148.
〔2〕Beeckman DS,Vanrompay DC.Zoonotic Chlam ydophila psittaci infections from a clinical perspective〔J〕.Clin Microbiol Infect,2009,15(1):11-17.
〔3〕Laroucau K,Trichereau A,Vorimore F,et al.A pmp genesbased PCR as a valuable tool for the diagnosis of avian chlamydiosis〔J〕.Vet Microbiol,2007,121(1-2):150-157.
〔4〕V ralstad T,Knutsen AK,Tengs T,et al.A quantitative Taq-Man M GB real-time polymerase chain reaction based assay for detection of the causative agent of crayfish plague A phanom yces astaci〔J〕.Vet Microbiol,2009,137(1-2):146-155.
〔5〕柳陈坚,龚福明,蔡燕,等.鹦鹉热嗜衣原体PCR检测体系的建立〔J〕.上海交通学学报(农业科学版),2009,6(28):554-560.
〔6〕Everett KD,Bush RM,Andersen AA.Emended description of the order Chlamydiales,proposal of Parachlamydiaceae fam.nov.and Simkaniaceae fam.nov.,each containing onemonotypic genus,revised taxonomy of the family Chlamydiaceae,including a new genus and five new species,and standards for the identification of organisms〔J〕.Int J Syst Bacteriol,1999,49(2):415-440.
〔7〕朱其太.衣原体分类新进展〔J〕.中国兽医杂志,2001,37(4):30-31.
〔8〕Co rsaro D,Valassina M,Venditti D.Increasing diversity within Chlamydiae〔J〕.Crit Rev Microbiol,2003,29(1):37-78.
〔9〕Robertson T,Bibby S,O’Rourke D,et al.Characterization of Chlamy diaceae species using PCR and high resolution melt curve analysis of the 16S rRNA gene〔J〕.J App l Microbiol,2009,107(6):2017-2028.
〔10〕Menard A,Clerc M,Subtil A,et al.Development of a realtime PCR for the detection of Chlam ydia psittaci〔J〕.J Med Microbiol,2006,55(Pt 4):471-473.
〔11〕Pantchev A,Sting R,Bauerfeind R,et al.New real-time PCR tests for species-specific detection of Chlam ydophila psittaci and Chlam ydophila abortus from tissue samples〔J〕.Vet J,2009,181(2):145-150.
〔12〕吴东海,李应国,杨迎伍,等.鹦鹉热衣原体real-time quantitative PCR检测方法的研究〔J〕.安徽农业科学,2008,36(23):9905-9907.
〔13〕王争强,朱虹,苏裕心,等.鹦鹉热嗜衣原体实时定量 PCR检测方法的建立〔J〕.中国人兽共患病学报,2006,22(8):701-703.
Developmen t and application of specific TaqMan-M GB probe quan titative fluorescence PCR assay for detection on Chlam ydophila psittaci
FENG Yue,ZHANG Zhong-hua,GONG Fu-ming,L IU Chen-jian
(Laboratory of A pp lied Microbiology,Faculty of L ife Sciences and Technology,Kunm ing University of Science and Technology,Kunm ing 650224,China)
In order to develop a specific,sensitive and repeatable quantitative fluo rescence PCR technology to detect Chlam y dophila psittaci,(C.psittaci)primers and specific TaqManminor-groove-binding(M GB)hybridization p robewere designed for identifying MOM P gene of C.psittaci.Then conditionsof PCR reaction were optimized,and the specificity,sensitivity,rep roducibility and Spike-test of the assay were evaluated.Besides,the examination results of clinic specimens from birds with bo th real-time PCR and conventional PCR methodswere compared.Themethod showed a strong linear relationship(R2=0.999)at a range of 0.01 pg-100pg and 97.7%PCR efficiencies;C.psittaci was detected by the assay specifically;the coefficients of variation(CV)value was 0.317%-0.563%and the sensitivity was 0.01pg;the detection limit of the assay in Spike-test was 25 EBs.Otherw ise,the positive coincidence rate(14.3%)from thismethod was higher than that(7.4%)from conventional PCR assay.It is evident that the quantitative fluo rescence PCR is a sensitive,efficient,and stablemethod for the detection of C.psittaci.
Chlam ydophila psittaci;quantitative fluorescence PCR;M GB p robe;MOM P gene
R379
A
1002-2694(2010)11-1041-04
*云南省科技厅面上项目(KKSA 200926038)资助
柳陈坚,Email:new staar8@hotmail.com
昆明理工大学生命科学与技术学院,昆明 650224
2010-05-28;
2010-08-31

