小鼠动物毒性试验、神奈川溶血试验以及tdh试验对副溶血性弧菌致病性检测有效性的研究*
陈明环,刘俊平,王庆忠,王宏萍,刘国刚,张继伦
小鼠动物毒性试验、神奈川溶血试验以及tdh试验对副溶血性弧菌致病性检测有效性的研究*
陈明环1,刘俊平2,王庆忠3,王宏萍4,刘国刚5,张继伦2
目的 比较小鼠动物腹腔注射、灌胃、神奈川溶血实验以及荧光tdh基因PCR反应对副溶血性弧菌致病性检测的有效性。方法采用四种方法,对分离自腹泻者、水产品及自然水体中的菌株测定阳性率,以精确卡方统计比较结果。结果tdh反应可区分腹泻者来源菌株阳性率为90.0%,水产品来源阳性率为9.62%,自然水体来源阳性率为7.32%,P<0.001。结论荧光tdh基因PCR反应可有效应用于致病性菌株检测。
致病性副溶血性弧菌;荧光 tdh基因 PCR反应;腹泻;水产品;水体
副溶血性弧菌(V ibrio parahaem oly ticus)广泛分布于近海岸与入海口水中,常为海洋鱼贝类所携带。我国华东沿海海洋水生动物携带该菌率可高达60.4%〔1〕。食用致病性副溶血性弧菌,可使食用者出现腹泻、肠痉挛、恶心、呕吐、发烧等胃肠炎反应〔1-2〕,是全球沿海地区夏秋季腹泻高发的主要原因〔2〕。但是,副溶血性弧菌中具有致病性菌仅占其中小部分,食用非致病性副溶血性弧菌对人体无大碍。若要求食品中不得检出副溶血性弧菌,或采用食用水产品的限量值〔3〕,都会妨碍水产品生产、加工、销售,实际操作中不可行。为了精准的测定副溶血性弧菌菌群中的致病性株系,从而提高水产品检验检疫的控制效率,需要建立特异性的检验方法。目前已有的方法有:小鼠毒性试验(GB/T4789.7-2003)、神奈川溶血试验(GB/T4789.7-2008)、耐热性溶血毒素基因检测(thermostable direct hemolysin,tdh),我们在现场中应用需要评估这些方法的使用价值〔4-5〕。为此,我们收集了从上海和浙江舟山的分别由腹泻者肛拭、水产品和水体中分离到的三类副溶血性弧菌标本,评价上述方法对致病性副溶血性弧菌的检测效率。
1 材料和方法
1.1 副溶血性弧菌 标本采集于2008年5月-10月,以 TCBS和 CHROMagar弧菌平板分离培养,按照副溶血性弧菌检验标准 GB/T4789.7-2003,进行生化鉴定。
合计分离收集到273株副溶血性弧菌,其中从腹泻者肛拭中分离菌株180株;从来自上海和舟山农贸市场的水产品中分离52株;从水体(出口中转养殖水、近海河水、海水)中分离41株。副溶血性弧菌标准菌株A TCC17802来自上海交通大学农业与生物学院,VPJ33来自上海海洋大学。
1.2 小鼠毒性试验 依据 GB/T4789.7-2003,菌液经37℃16h-18h培养后,腹腔注射0.3m L,或用灌胃针灌注小鼠0.4m L,以小鼠在3d内死亡为毒性判断依据。试验小鼠为昆明株 F1,体重为18-22g,购自上海第二军医大学。
1.3 神奈川溶血试验 神奈川实验用血平板使用新鲜兔血浆配制。用接种环将测试菌株点种表面干燥的我妻氏血琼脂平板,35℃培养不超过24h,并立即观察。阳性结果为菌落周围呈半透明环的β溶血。
1.4 荧光定量 tdh基因检测〔6〕采用自制tdh荧光PCR试剂检测,TaqMan探针为5’-FAM 2 TGACA TCCT A CA TGA CTGTGAAC2 ECL IPSE2-3’,使用荧光 PCR仪为 App lied Biosystem L td AB I7500,荧光采集通道为 FAM 490nm。tdh引物正向序列为5’-CGAAGA TGTT TA TGG TCAA T C-3’,反向序列为 5’-ACCGC TGCCA TTGTA TA GTC T-3’,目的片段长度为105bp。
1.5 统计分析 两组数据比较采用Fisher’s exact 2-tailed test,在网站 http://www.langsrud.com/fisher.htm提供的计算页面上进行计算。
2 结 果
副溶血性弧菌标准菌株A TCC17802及VPJ33为生化阳性对照,与无菌含3.5%氯化钠的蛋白胨水做为阴性对照,对照标本均无溶血现象,小鼠腹腔注射或灌胃都未死亡,未检出tdh基因。
多数小鼠在灌胃或腹腔注射后,出现不同程度的中毒症状,随着时间的延长,存活小鼠表现出的中毒症状逐渐缓解。主要中毒症状有竖毛、嗜睡、少动、厌食呼吸困难。
由于试验容量的限制,随机选取一定数量的菌株分别做小鼠腹腔注射、灌胃试验、神奈川溶血试验、以及tdh基因检测,阳性结果比率以及检测的菌种数量汇总于表1。
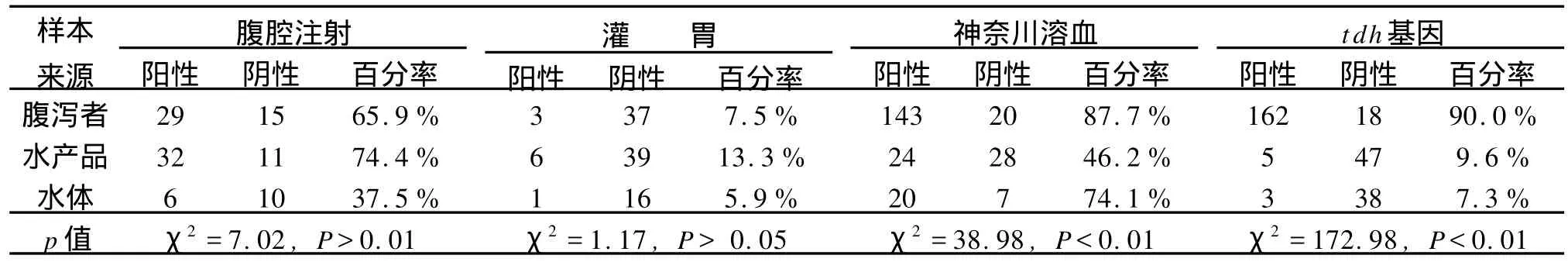
表1 三类来源副溶血性弧菌的毒性试验结果Table1 Tests on vibrio parahaemolyticus isolates from patients,sea-fishery products or fresh water samples
3 讨 论
理论上,从腹泻者中分离获得的副溶血性弧菌应主要为致病性菌群。从水体中分离的弧菌应根据环境分布,具有相应的致病性菌群的检出率。动物毒性试验曾作为副溶血性弧菌是否具有致病性判断的金标准。但是,由于高剂量的非致病性弧菌也能引起小鼠的毒性反应,而且,这种反应没有特异性的表型分布特征可与致病性副溶弧菌的反应相区分,因此,在本研究中,水产品来源的副溶血性弧菌腹腔注射致鼠死率(32/43)甚至高于腹泻者来源株(29/44),P=0.74(Fisher’s exact 2-tailed test)。该结果与一般常识相悖。推测为水产品来源的副溶血性弧菌有其它对小鼠有致死性的有害成分的存在。还可能是小鼠毒性致死试验不能分辨副溶血性弧菌对人致泻的毒性差异,而是反映菌体本身在小鼠腹腔内的对小鼠的有害特性。副溶血性弧菌通过小鼠毒性试验的腹腔注射法,对小鼠的致死率较高,在两组之间没有显著检出差异。通过灌胃法,则对小鼠的致死率较低,但是在水产品来源(6/45)以及腹泻者来源(3/40)各组间仍是不存在统计学差异,P=0.50(Fisher’s exact 2-tailed test)。因此,两种类型的小鼠毒性试验均不能反映致病性副溶血性弧菌。
神奈川反应以副溶血性弧菌的溶血性来反映其致病能力。根据上世纪八十年代日本学者研究报道,来自腹泻者和水产品分离株的溶血率存在显著性差异,分别为96.5%与1.1%,据此把溶血率作为致病性判断依据〔4〕。但是实际操作中,溶血实验受采用兔血浆新鲜程度、批次、血浆比例波动性以及p H值、盐浓度的影响,重现性较低。本研究,水产品来源的菌株的46.2%的溶血率(24/52),自然水体来源菌株的74.1%溶血率(20/27),或腹泻者来源菌株的87.7%溶血率(143/163)与文献报道值差异大〔4〕,来自腹泻者和其他分离株间不存在统计学差异 ,P=0.64(Fisher’s exact 2-tailed test)。其原因有时间和区域差别,近年上海市水体中致病性副溶血性弧菌的比率大幅度飙升,另一解释为神奈川反应由于溶血实验的不稳定性,该指标已无法判断菌株的致病性。
学者研究副溶血性弧菌主要毒力因子为TDH〔5〕。可采用 tdh基因检测的方法来反映该菌株中的致病性菌群。我们采用已建立的荧光PCR方法〔6〕对现有菌株进行了测定。以 tdh基因反映的致病菌株,在腹泻者来源中占90%(162/180),与水产品中分离的9.62%(5/52)显示出显著差异,P<0.001(Fisher’sexact 2-tailed test)。水产品中分离的比率与自然水体中分离的7.32%(3/41)的比率没有显著差异,P=1(Fisher’s exact 2-tailed test)。腹泻者来源菌株有10%未检出 tdh,其致泻性可能来自 trh、脲素酶〔5〕。
结合本研究各项数据说明,在实际操作中,曾被作为金标准的小鼠毒性试验以及神奈川溶血实验由于方法检测的局限性与波动性的原因,并不适合应用于致病性副溶血性弧菌的实验室测定,而荧光tdh基因 PCR反应〔6〕可应用于现场实验室检疫使用。
〔1〕刘秀梅,陈艳,王晓英,等.1992-2001年食源性疾病爆发资料分析-国家食源性疾病监测网〔J〕.卫生研究,2004,33(6):725-727.
〔2〕何浙生,王满琴,潘幸福,等.浙江沿海鱼贝类及外环境中副溶血性弧菌检出频度及菌群分布〔J〕.中国公共卫生杂志,1989,1(10):6-7.
〔3〕广东出入境检验检疫局编译.国内外技术法规及标准中食品微生物限量〔J〕.北京:中国标准出版社,2002年,47-54.
〔4〕孟昭赫,刘宏道,何晓青,等.食品卫生检验方法注解微生物学部分〔J〕.1版.北京:人民卫生出版社.179.
〔5〕宁喜斌,刘代新,张继伦.副溶血性弧菌的致病性及其快速检测〔J〕.微生物与感染,2008,35(3):53-55.
〔6〕王宏萍,周晓明,张继伦,等.副溶血性弧菌致病性标志基因 tdh的实时荧光定量聚合酶链式反应的建立〔J〕.第四军医大学学报,2008,29(24):2232-2235.
Validity comparison on pathogen ic Vibrio parahaemolyticus identification methods of m icemodels,Kanagawa hemolytic test,and tdh gene test
CHEN M ing-huan,L IU Jun-ping,WANG Qing-zhong,WANG Hong-ping,L IU Guo-gang,ZHANG Ji-lun
(Zhoushan Entry-Exit Inspection and Quarantine Bureau,Zhoushan 316000,China)
The aim of this study was to evaluate the applicability of four lab methodson the identification of pathogenic Vibrio parahaemolyticus.Four methods under evaluation includeof intraperitoneally injected micemodel,mice fed model,Kanagawa hemolytic test and fluorescence tdh quantitative PCR.Three populationsof V ibrio parahaemoly ticus isolateswere isolated from three independent sources including diarrhea patients,sea-fishery products and fresh water pool.Both mice models and Kanagawa hemolytic test had reached consensus positive results on identifying pathogenic V ibrio parahaemolyticus strains from sources of patients or sea-fishery products.For florescence tdh quantitative polymerase chain reaction,90.0%isolates from patients but 9.62%isolates from sea-fishery products were positive(P<0.001).The 7.32%isolates from fresh-water were also tdh positive.Thus,florescence tdh quantitative PCR was app rop riate for identifying pathogenic V ibrio parahaemolyticus isolates in routine app lication instead of mice models and Kanagawa test.
Vibrio parahaemolyticus;pathogenicity;tdh;diarrhea;sea-fishery
R378.3
A
1002-2694(2010)11-1025-03
*国家传染病重大专项2009ZX10004-104,科技部国家支撑计划科技专项(2009BAK43B31)和上海市科委标准化基金(09DZ0503200)联合资助
张继伦,Email:zhangjl@shciq.gov.cn
1.浙江舟山出入境检验检疫局,舟山 316000;2.上海出入境检验检疫局;3.上海市临床检验中心;4.上海市临床公共卫生中心;5.上海金山技术监督局
2010-04-20;
2010-09-16

