乳酸菌启动子探针载体的构建及其功能验证
张维,姚璐,张世湘,罗云波,郝彦玲
(中国农业大学 食品科学与营养工程学院,北京 100083)
乳酸菌启动子探针载体的构建及其功能验证
张维,姚璐,张世湘,罗云波,郝彦玲
(中国农业大学 食品科学与营养工程学院,北京 100083)
以β-葡萄糖醛酸酶基因gusA作为报告基因,在乳酸菌表达载体pMG36e基础上,利用平滑化技术删除表达载体自带启动子P32,构建了乳酸菌启动子探针载体pMGPP。将已知的嗜酸乳杆菌S-layer蛋白基因启动子slpA插入到pMGPP无启动子的gusA基因上游验证其功能,GUS染色结果表明:pMGPP在大肠杆菌KW1和植物乳杆菌WQ0815中皆具有启动子探针载体的功能。因此,具有自主知识产权的启动子探针载体pMGPP的构建不仅为筛选乳酸菌启动子提供了有效的工具,同时为高效乳酸菌表达载体的构建奠定基础。
乳酸菌,启动子探针载体,报告基因gusA,功能验证
0 引 言
乳酸菌是一类广泛应用于食品、医药和饲料领域的重要工业微生物[1],随着基因工程技术发展,改良乳酸菌发酵性能和益生性能工程菌株构建已取得了可喜进展[2]。高效稳定的表达载体是乳酸菌工程菌株获得的基础,而启动子是决定外源基因表达效率的关键遗传元件。
目前报道的乳酸菌启动子筛选方法主要为通过已知基因推测其启动子、构建基因组文库和人工启动子文库,但无论哪种方法皆依赖于启动子探针载体来验证启动子的功能[3-5]。所谓启动子探针载体是指携带报告基因、抗性标记和转录终止子,但无启动子的克隆载体。因此,将一段已知的核苷酸序列插入报告基因上游时,可通过检测报告基因的表达情况判断插入序列是否具有启动子活性及启动子强度。因此,启动子探针载体的构建为筛选高效启动子奠定了基础。
1 实 验
1.1 材料
(1)菌株和质粒:gusA缺陷型大肠杆菌菌株KW1,大肠杆菌 (Escherichia coli)DH5α感受态,植物乳杆菌(Lactobacillus plantarum)WQ0815和嗜酸乳杆菌(Lactobacillus acidophillus)05-17为本室保存。携带gus基因的植物表达载体pBI121和乳酸菌表达载体pMG36e均为本室保存。
(2)试剂:限制性内切酶,T4 DNA连接酶,高保真ExTaq DNA聚合酶,Klenow Fragment; 溶菌酶,5-溴-4-氯-3-吲哚葡萄糖苷(X-Gluc),红霉素,常规试剂为国产分析纯。
(3)引物合成:引物由上海生工生物工程有限公司合成,引物序列及用途如表1所示。
1.2 方法
1.2.1 pMGPP的构建
(1)携带报告基因gusA的乳酸菌表达载体的构建。以植物表达载体pBI121为模板,利用引物gus-F和gus-R扩增gusA基因,采用XbaⅠ和HindⅢ双酶切回收的gusA基因和乳酸菌表达载体pMG36e,将酶切后gusA基因和载体在T4 DNA连接酶作用下进行连接,将得到的携带报告基因gus的重组质粒命名为pMG36eGUS。
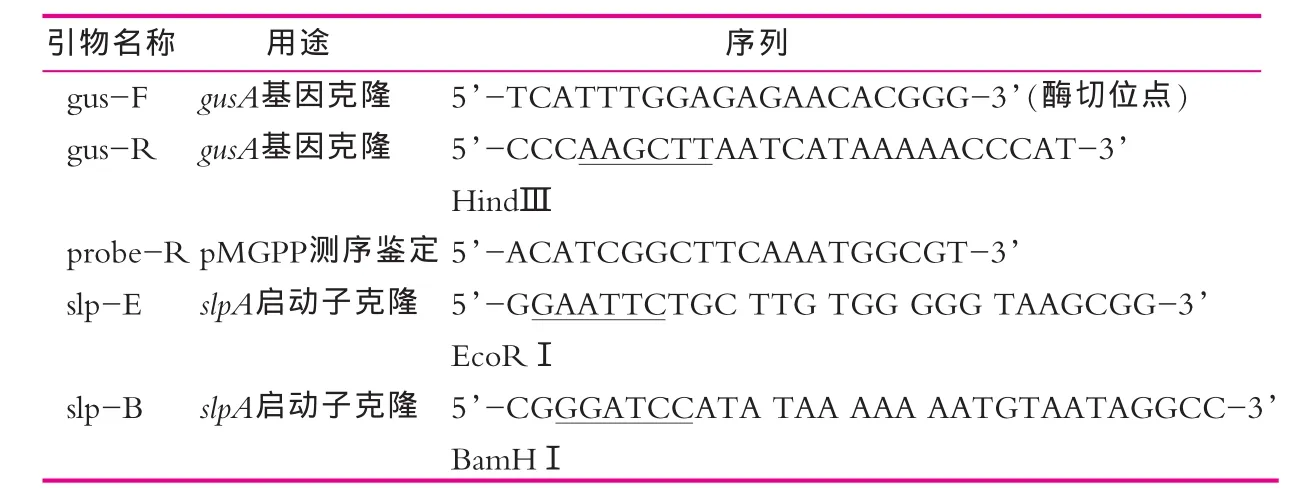
表1 引物序列及用途
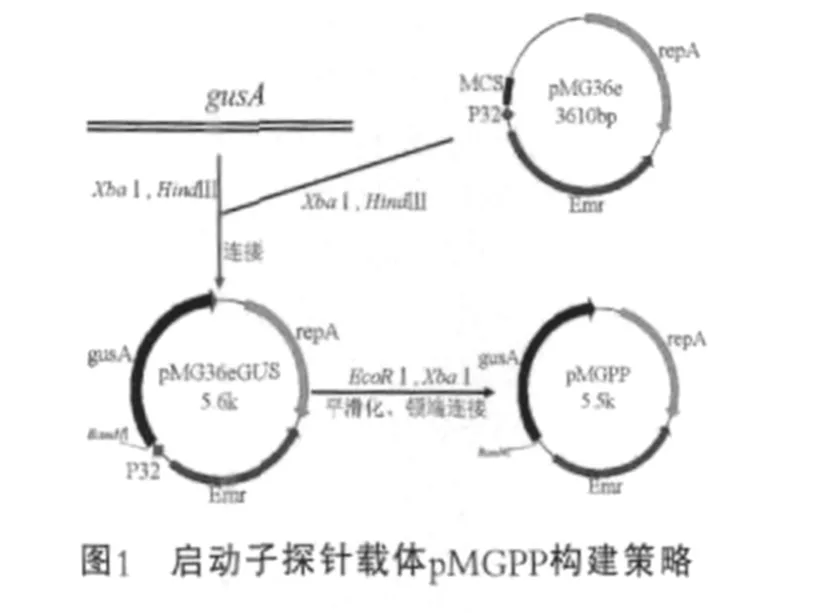
(2)利用平滑化技术制备乳酸菌探针载体。利用EcoRⅠ和BamHⅠ双酶切质粒pMG36eGUS,目的是删除表达载体自带的启动子P32,回收的大片段用Klenow Fragment进行平滑化形成钝端,进一步用T4 DNA连接酶连接,筛选得到的重组质粒即为启动子探针载体,命名为pMGPP。乳酸菌启动子探针载体构建策略如图1所示。
1.2.2 在大肠杆菌中的功能验证
以嗜酸乳杆菌05-17基因组为模板,利用引物slp-E和slp-B扩增嗜酸乳杆菌S-layer蛋白基因slpA启动子,采用EcoRⅠ和BamHⅠ分别酶切slpA和pMGPP,将回收后的载体和slpA进行连接,获得重组质粒pMGGS。采用热激转化的方法将pMGPP(阴性对照)和pMGGS转入大肠杆菌KW1。利用X-Gluc检测液对阳性克隆gusA基因表达的情况进行鉴定,验证启动子探针载体在大肠杆菌中的功能。
1.2.3 在植物乳杆菌中的功能验证
植物乳杆菌感受态细胞的制备按Aukrust的方法稍作修改。过夜培养的菌体接种到浓度为0.3 mol/L蔗糖和质量分数为1.0%甘氨酸的MRS培养基中,培养至OD值达0.40~0.60;离心收集的菌体用预冷的漂洗液(浓度为0.3 mol/L蔗糖,0.1 mol/L的MgCl2)洗涤两次,并用200 μL预冷的电击缓冲液(30%PEG-1500)重悬;将40 μL感受态细胞和0.5 μg纯化的质粒混合并转移到预冷的2 mm电转杯中,电转参数为1.5 kV,400 Ω,25 μF;电击后立即加入1 mL复苏液(含有浓度为0.3 mol/L蔗糖和0.1 mol/L的MgCl2的MRS培养基),于37°C培养2 h。复苏后的转化子在质量浓度为5 mg/L红霉素的MRS固体培养基上进行筛选。利用GUS染色阳性克隆考察启动子探针载体在植物乳杆菌中的功能。
2 结果和分析
2.1 表达载体pMG36eGUS的构建
以质粒pBI121为模板进行PCR扩增,经质量分数为1%琼脂糖凝胶电泳检测可见一条约2.0 kb的扩增条带,与预期大小相符,经序列分析结果表明其与大肠杆菌gusA的同源性达100%。将XbaⅠ和HindⅢ双酶切回收的gusA基因和pMG36e载体进行连接,重组质粒pMG36eGUS经酶切鉴定获得预期大小2 kb的目的片段,证明该携带报告基因的乳酸菌表达载体构建成功(图2)。
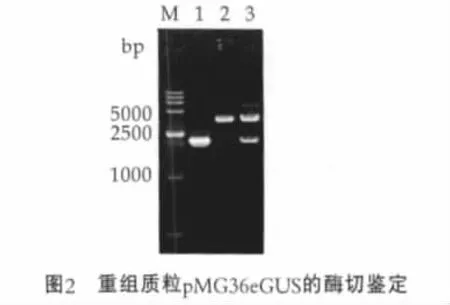
图2中,M为DNA分子量标准DL15000;1为基因gusA的PCR产物;2为载体pMG36e双酶切/XbaⅠ和HindⅢ;3为重组质粒pMG36eGUS双酶切/XbaⅠ和HindⅢ。
2.2 制备乳酸菌启动子探针载体pMGPP
利用EcoRⅠ和BamHⅠ双酶切质粒pMG36eGUS,回收的大片段用Klenow Fragment进行平滑化形成钝端,进一步用T4 DNA连接酶连接,筛选得到的重组质粒即为启动子探针载体pMGPP。以probe-R为引物对pMGPP进行测序鉴定,序列比对结果如图3所示,由图3可以看出:pMGPP经测序后和pMG36eGUS比对证明质粒上原有的启动子P32被删除,启动子探针载体pMGPP构建成功。图3中,黑色标注为相同序列,灰色为P32启动子序列。

2.3 携带嗜酸乳杆菌启动子slpA重组质粒pMGGS的构建
利用PCR技术从嗜酸乳杆菌05-17基因组中扩增S-layer蛋白基因slpA启动子,琼脂糖凝胶电泳检测可见约300 bp片段,与预期大小相符,测序结果与Gen-Bank发表序列的同源性为97%。分析结果表明该序列具有启动子保守的-10区(TAAAAT)和-35区(TTGCTA)以及核糖体结合位点SD序列。进一步将slpA启动子序列插入启动子探针载体pMGPP的EcoRⅠ和BamHⅠ位点,采用PCR方法鉴定重组子,由图4中可见,携带嗜酸乳杆菌启动子slpA重组质粒pMGGS的构建正确。
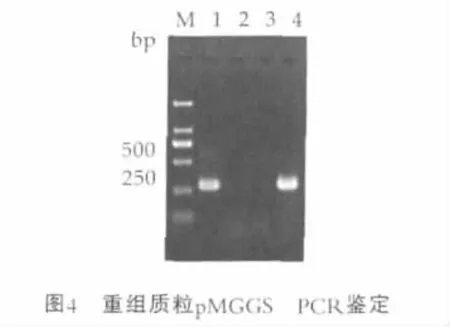
图4中,M为DNA分子量标准DL2000;1为slpA启动子扩增产物;2为阴性对照 (水为模板);3为以pMG36eGUS为模板slpA扩增产物;4为以pMGGS为模板slpA扩增产物。
2.4 载体pMGPP的功能验证
启动子探针载体分别转化大肠杆菌和植物乳杆菌,将携带pMGGS和pMGPP的大肠杆菌KW1和植物乳杆菌WQ0815离心后,菌体进行GUS染色,实验结果如图5和图6所示,由图中可以看出,仅携带pMGGS载体的大肠杆菌和植物乳杆菌染色后呈蓝色。染色的结果表明载体pMGPP在大肠杆菌和植物乳杆菌中具有启动子探针载体的功能。
3 讨 论

目前基因工程领域应用的报告基因主要有cat(氯霉素乙酰转移酶基因)、lacZ(β-半乳糖苷酶基因)、lux(荧光素酶基因)和gusA(β-葡萄糖醛酸酶基因)等。其中cat基因和lux的表达产物分析成本较高,而在乳酸菌中lacZ的背景表达量比较高,对启动子活性分析造成一定的干扰。gusA基因编码的β-葡萄糖醛酸酶是一种酸水解酶,能水解多种β-葡萄糖醛酸衍生物,多数β-葡萄糖醛酸酶的底物是可溶性的,而且目前都已经实现了商业化,不同的底物可以用于分光光度法、荧光光度法、组织化学法等不同的方法分析gusA的表达情况,而且乳酸菌在可检测的范围之内都没有检测到β-葡萄糖醛酸酶活性[6,7]。 因此,本研究中选gusA基因作为筛选乳酸菌启动子的报告基因。
本文构建的启动子探针载体pMGPP中无启动子报告基因gusA上游有一个BamHⅠ(G↓GATCC)的单酶切位点,由于限制性内切酶BamHⅠ和Sau3AⅠ是同尾酶,而Sau3AⅠ是识别4个碱基(↓GATC)的内切酶。因此,可以利用Sau3AⅠ酶切基因组,将酶切产物连接到pMGPP的BamHⅠ酶切位点,将连接产物转化gusA缺陷的大肠杆菌KW1的突变体,通过GUS染色筛选携带乳酸菌启动子的阳性克隆,从而为利用基因组文库法筛选高效乳酸菌启动子提供强有力的工具。此外,由于乳酸菌电转化效率低于大肠杆菌,因此在大肠杆菌中构建乳酸菌基因组文库将能够提高文库的容量,更有利于筛选乳酸菌的启动子,然后将定位的启动子序列再转化到乳酸菌中进行活性的分析。
此外,携带强启动子的pMGGS表达载体转化植物乳杆菌WQ0815后染色较浅,染色结果与gus操纵子上gusB基因突变的大肠杆菌菌株K-12的染色现象一致[8]。因此,推测可能由于植物乳杆菌WQ0815缺失gusB基因而不能将细胞外的底物x-gluc转运富集到细胞内,从而影响了诱导gusA基因的表达和水解反应的发生,导致了染色速度慢而且颜色较浅[9]。因此,为了提高启动子探针载体在乳酸菌中的有效性,可进一步尝试将gusB基因构建到该启动子探针载体。
[1]LING D W,DONG X Z.Lactic Acid Bacteria Identification and Experiment Methods[M].Beijing:China Light Industry Press,1999.
[2]AN H,ZHOU H,HUANG Y,et al.High-Level Expression of Heme-Dependent Catalase Gene katA from Lactobacillus Sakei Protects Lactobacillus rhamnosus from Oxidative Stress[J].Molecular Biotechnology,2010,45(2):155-60.
[3]BRON P A,HOFFER S M,VAN SWAM I I,et al.Selection and Characterization of Conditionally Active Promoters in Lactobacillus plantarum,Using Alanine Racemase as a Promoter Probe[J].Applied and Environmental Microbiology,2004,70(1):310-317.
[4]RUD I,JENSEN P R,NATERSTAD K,AXELSSON L.A Synthetic Promoter Library for Constitutive Gene Expres-sion in Lactobacillus plantarum[J].Microbiology,2006,152(4):1011-1019.
[5]MCCRACKEN A,TURNER M S,GIFFARD P,et al.Analysis of Promoter Sequences from Lactobacillus and Lactococcus and Their Activity in Several Lactobacillus species[J].Archives of Microbiology,2000,173(5):383-389.
[6]JEFFERSON R A,BURGESS S M,HIRSH D.beta-Glucuronidase from Escherichia Coli as a Gene-Fusion Marker,Proceedings of the National Academy of Sciences of the United States of America,1986,83(22):8447-8451.
[7]PLATTEEUW C,SIMONS G,DE VOS W M.Use of the Escherichia coli beta-Glucuronidase(GusA)Gene as a Reporter Gene for Analyzing Promoters in Lactic Acid Bacteria[J].Applied and Environmental Microbiology,1994,60(2):587-593.
[8]WELSON K J,HUGHES S G,JEFFERSON R A.The Escherichia coli Gus Operon:Induction and Expression of the Gus Operon in E.coli and the Occurrence and Use of GUS in Other Bacteria[M].GUS Protocols.Using the GUS Gene as Reporter of Gene Expression,Acad.Press Inc.,San Diego,U.S.A.,1992:7-22.
[9]LIANG W,WILSON K J,XIE H,et al.The gusBC Genes of Escherichia coli Encode a Glucuronide Transport System[J].The Journal of Bacteriology,2005,187(7):2377-2385.
Construction and identification of promoter-probe vector for Lactic acid bacteria
ZHANG Wei,YAO Lu,ZHANG Shi-xiang,LUO Yun-bo,HAO Yan-ling
(College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China)
β-glycuronidase gusA was used as the reporter gene,and based on lactic bacterial expression vector pMG36e,promoter-probe vector pMGPP was constructed by deleting its promoter P32 through smoothing technique.Then the reported strong promoter,Lactobacillus acidophilus S-layer protein promoter slpA,was inserted upstream of the promoterless gusA gene to verify the function of pMGPP,and the results of GUS dyeing indicated that the eligibility of pMGPP in both E.coli KW1 and Lactobacillus plantarum WQ0815.The construction of pMGPP with the independent intellectual property rights lays a foundation for screening promoter and constructing expression vector for Lactic acid bacteria.
Lactic acid bacteria;promoter-probe vector;reporter gene gusA;verification of function
Q939.11+7
A
1001-2230(2010)11-0004-03
2010-07-15
本研究由国家高技术研究与发展计划(863)(2006AA10Z317和2007AA10Z354)资助。
张维(1987-),男,本科,研究方向为乳酸菌遗传与代谢工程。
郝彦玲

