乳源糖巨肽对小鼠IFN-γ和IL-4的调节作用
贾玉臣,陈庆森
(天津商业大学 生物技术与食品科学学院,天津 300134)
乳源糖巨肽对小鼠IFN-γ和IL-4的调节作用
贾玉臣,陈庆森
(天津商业大学 生物技术与食品科学学院,天津 300134)
研究了乳源糖巨肽(GMP)对健康Balb/c小鼠IFN-γ和IL-4的调节作用,从细胞因子的角度探讨了GMP维系机体健康的机制。对健康小鼠用GMP灌胃后,分别检测一次灌胃GMP后12 h内小鼠IFN-γ,IL-4每2 h的表达量的变化和连续5 d灌胃GMP对小鼠IFN-γ、IL-4的表达量,及IFN-γ/IL-4浓度比值的变化。结果表明,一次灌胃GMP短时间(12 h)内可促进小鼠IL-4的表达,以灌胃后第6h的增加最为显著,但对炎症细胞因子IFN-γ没有显著性影响;连续5 d灌胃GMP可促进小鼠IL-4的表达,其中第3天和第4天的变化呈显著性,对IFN-γ同样无显著性影响,因此第3天至第5天GMP组小鼠中的IFN-γ/IL-4的比其他两组显著降低。本研究提示了GMP具有调节Th1/Th2失衡的功能。
乳源糖巨肽;GMP;Th细胞;细胞因子
0 引 言
1986年,Mosmann等[1]首先将CD4+T细胞分为Th1和Th2两个亚群。Th1细胞主要分泌IL-2、IFN-γ,而Th2细胞主要分泌IL-4、IL-5、IL-6、IL-9、IL-10和IL-13等细胞因子[2]。Th1/Th2平衡因与机体的多种免疫性疾病密切相关而影响着机体健康。Delfour等[3]于1965年在乳κ-酪蛋白中发现了含有唾液酸的多肽。牛乳中的κ-酪蛋白在凝乳酶作用下分解为两部分:不溶性的副酪蛋白和可溶性的酪蛋白巨肽(Caseinomacropeptide,CMP)。GMP有诸多生物活性,比如抗微生物毒素[4]、促益生菌增殖[5]以及免疫调节[6]等活性,目前已有许多研究陆续地对GMP的免疫调节作用进行了初步探索[7]。本实验分别研究探讨了一次灌胃GMP后短时间(12 h)内小鼠IFN-γ、IL-4的质量分数变化和连续5 d灌胃GMP对小鼠IFN-γ、IL-4的含量及IFN-γ/IL-4比值的变化,从而探讨GMP维系Th1/Th2平衡的功能。
1 实 验
1.1 材料
1.1.1 实验动物
Balb/c小鼠 (SPF级,雄性,体质量(25±2)g)、小鼠常规饲料。
1.1.2 试剂及试剂盒
GMP(纯度为70%,其中唾液酸质量分数10%以上),IFN-γ ELISA试剂盒,IL-4 ELISA试剂盒,其他常规试剂均为国产分析纯。
1.1.3 仪器
酶标仪,恒温培养箱,高速冷冻离心机,超低温冰箱。
1.2 方法
1.2.1 GMP溶液的配制
准确称取0.500 g GMP溶于80 mL无菌水中,定容至100 mL,得到5 g/L的GMP溶液。每天于灌胃前新鲜配制。
1.2.2 GMP灌胃剂量的选择
根据本实验室的前期研究,最终选择给与小鼠的灌胃剂量为50 mg/kg。
1.2.3 一次灌胃后小鼠外周血清变化
(1)动物分组。Balb/c小鼠54只,适应性喂养1周后随机分为3组,每组18只,(空白对照组、生理盐水组和GMP组),空白对照组仅给与普通鼠食,生理盐水组灌胃0.2 mL,GMP组灌胃剂量为50 mg/(kg·d)的GMP溶液。
(2)获取血清样本。将新鲜配制的GMP溶液按照50 mg/kg的剂量灌胃小鼠,分别于灌胃后第2,4,6,8,10和12 h进行眼眶静脉丛取血1 mL,每次处理3只小鼠,所得血液4℃静置过夜后,1 000 g离心15 min,得到血清,待测。
(3)IL-4和IFN-γ质量浓度测定。利用用酶联免疫双抗体夹心法测定IL-4和IFN-γ的质量浓度,具体操作步骤按试剂盒说明书进行。
1.2.4 对小鼠连续5 d灌胃(GMP)变化情况
1.2.4.1 动物分组
Balb/c小鼠63只,适应性喂养1周后随机分为3组,每组21只 (空白对照组、生理盐水组和GMP组),空白对照组仅给与普通鼠食,生理盐水组灌胃0.2 mL,GMP组灌胃剂量为50 mg/(kg·d) 的GMP溶液。
1.2.4.2 样本获取
将新鲜配制的GMP溶液灌胃小鼠,记为第1 d,于灌胃后分别拉颈处死每组中的3只小鼠,将其四肢和尾部固定在解剖台上,打开腹腔沿胃部幽门向下找出全肠,将其置于事先消毒的洁净载玻片上,在距幽门4 cm处取小肠约3 cm纵向剖开后用无菌PBS缓冲液将残渣除去,准确称取0.2 g于组织匀浆器中,再加入PBS缓冲液,将组织破碎,得到20%的组织匀浆,立即在Sigma离心机中4℃,5 000 g离心10 min,取上清液于-70℃冰箱中冻存。
连续灌胃5 d,每天处理同上,得到肠段组织匀浆上清液,冻存待测。
完成5 d灌胃后,改为正常鼠食饲喂至第6和7天,每天分别处死各组3只小鼠,上述同样方法得到肠段组织匀浆上清液,冻存于-70℃超低温冰箱中,待测。1.2.4.3IL-4、IFN-γ质量浓度测定
利用用酶联免疫双抗体夹心法测定IL-4和IFN-γ的质量浓度,具体操作步骤按试剂盒说明书进行。
1.2.5 统计学处理
所有实验数据利用SPSS11.5统计软件,进行单因素方差分析,处理结果用均数±标准差(x±S)。
2 结果与分析
2.1 一次灌胃后血清中IFN-γ质量浓度变化
细胞因子的合成与分泌是一个短促的、自我限量的过程,本研究检测了GMP刺激后短时间(12 h)内小鼠外周血清中IFN-γ的质量浓度变化,结果如图1所示。
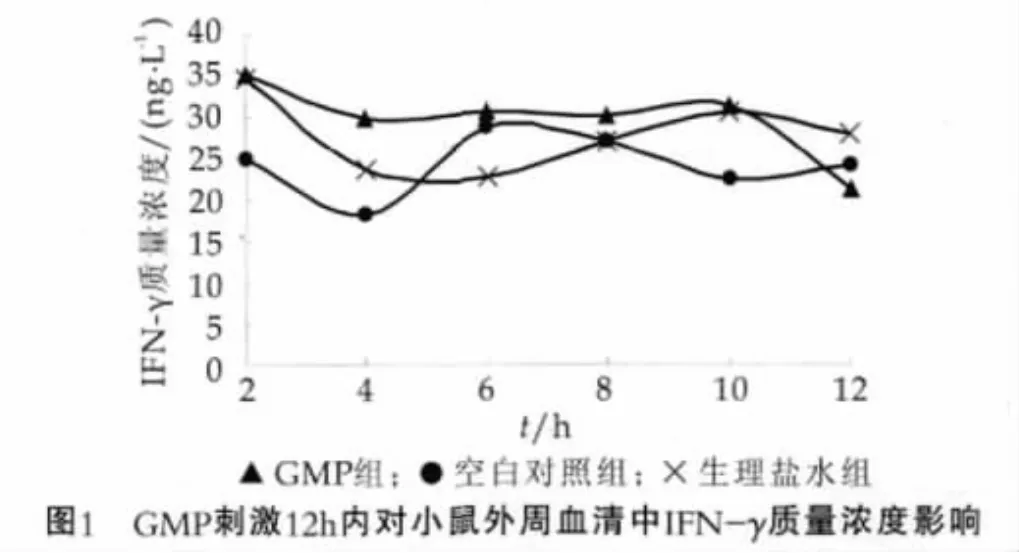
由图1可以看出,在一次灌胃GMP的12 h内,3组小鼠外周血中IFN-γ质量浓度没有明显的变化规律,基本处于 (18.40±4.82)ng/L至 (35.23±12.47)ng/L之间,并且在每个实验时间点上组与组之间的差异均不显著(P﹥0.05)。
2.2 一次灌胃GMP后血清中IL-4质量浓度变化
同样地,本研究对一次灌胃GMP后短时间(12 h)内小鼠外周血清中IL-4的质量浓度变化如图2所示。
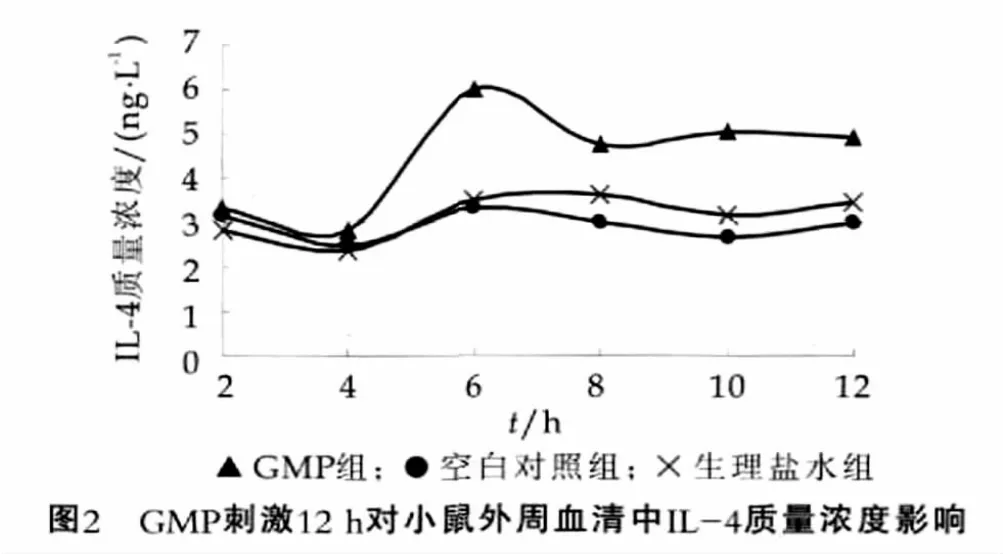
由图2可以看出,在一次灌胃GMP后的12 h里,GMP组外周血中IL-4的浓度与空白对照组和生理盐水组相比,呈整体增加的趋势。在灌胃后最初的4 h,GMP组与空白对照组以及生理盐水组IL-4质量浓度之间的差异不显著;在灌胃6 h后,IL-4的质量浓度增高至(6.01±0.73)ng/L,与空白对照组和生理盐水组均表现出显著性差异(P﹤0.05)。8 h后,GMP组与其他两组IL-4浓度均保持在一个相对稳定的水平上,接近3.0 ng/L,但GMP组均高于空白对照组和生理盐水组。
2.3 IFN-γ的质量浓度变化
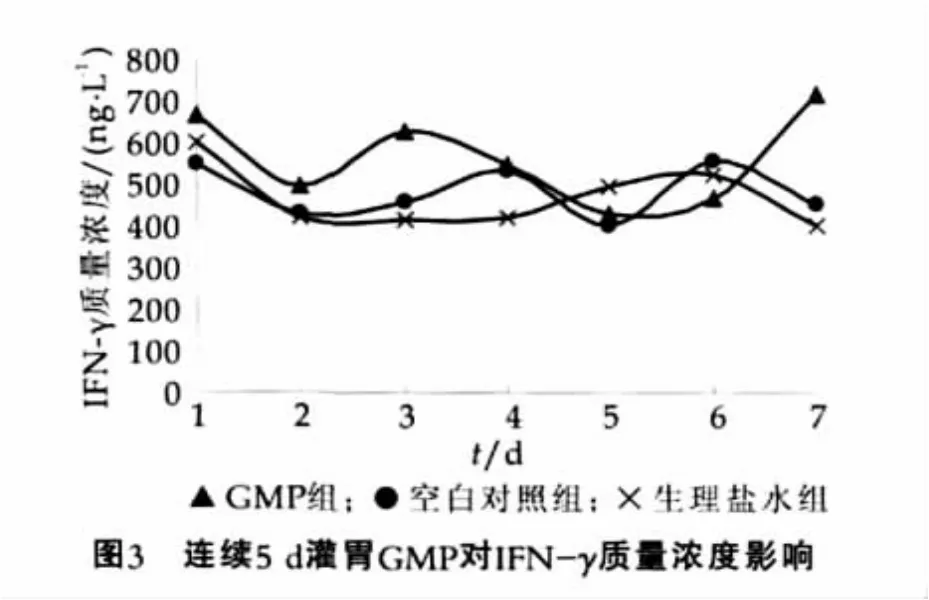
连续5 d灌胃GMP后,小鼠小肠组织中IFN-γ的质量浓度变化如图3所示。
由图3可以看出丑,实验7 d内空白对照组与生理盐水组小鼠肠黏膜中的IFN-γ质量浓度基本处于(404.7±72.4)ng/L至 (606.5±165.7)ng/L这一平稳的范围,连续灌胃GMP对GMP组小鼠肠黏膜中的IFN-γ无显著影响(P>0.05)。
2.4 IL-4的质量浓度变化
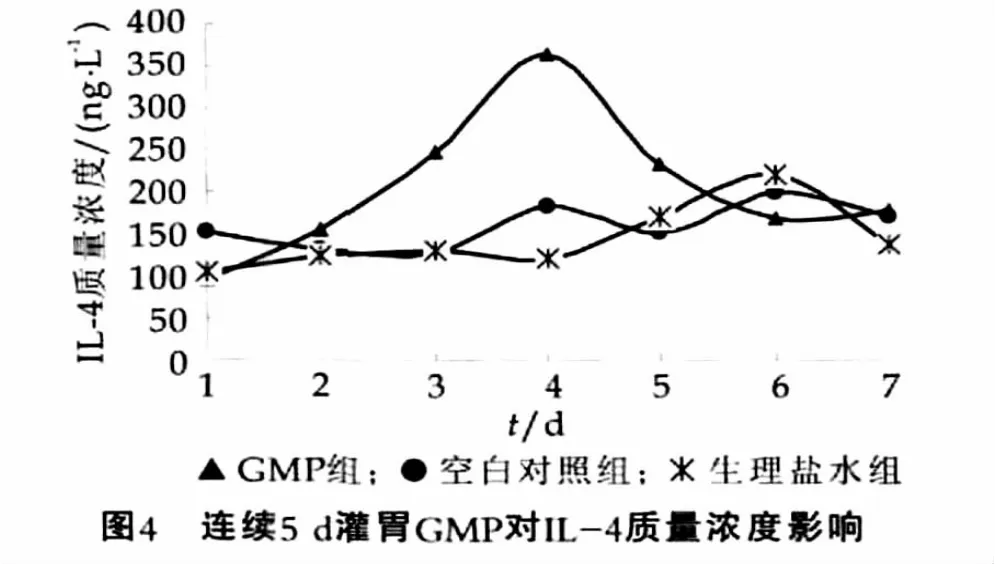
连续5 d灌胃GMP后,小鼠小肠组织中IL-4的质量浓度变化如图4所示。
由图4可以看出,7 d内空白对照组与生理盐水组小鼠肠黏膜中的IL-4质量浓度基本处于一个相对平稳的状态,连续5 d给小鼠灌胃GMP期间 ,GMP组小鼠肠黏膜中IL-4的质量浓度从灌胃第1天开始呈现增高趋势,在第4天出现最高峰,并在第3天和第4天时与其他两组呈显著性差异(P<0.05),分别高达(248.1±28.0)ng/L和(363.8±28.6)ng/L,第5天与其他两组无显著性差异(P>0.05)。同时,停止灌胃GMP后的第5天和第6天,GMP组小鼠肠黏膜中的IL-4的质量浓度与空白对照组与生理盐水组均无显著性差异(P>0.05)。
2.5 IFN-γ/IL-4比值的变化
IFN-γ/IL-4的比值可在一定程度上反应Th1/Th2平衡的变化,本研究在连续5 d灌胃GMP后,小鼠小肠组织中IFN-γ/IL-4比值的变化结果如图5所示。
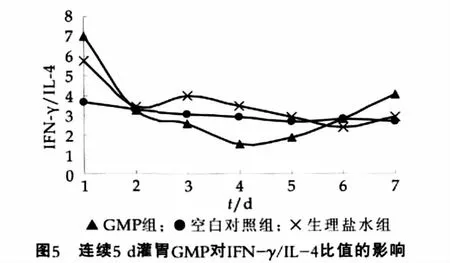
由图5可以看出,7 d内空白对照组与生理盐水组小鼠肠黏膜中的IFN-γ/IL-4的比值基本处于一个相对平稳的状态,连续5 d给小鼠灌胃GMP期间 ,第4天至第5天GMP组小鼠肠黏膜中的IFN-γ/IL-4比值分别为(1.52±0.39)和(1.86±0.69),比其他两组显著降低(P<0.05)。停止灌胃GMP后,GMP组小鼠结肠中IFN-γ/IL-4的比值其他两组无显著性差异(P>0.05)。
3 讨 论
乳源GMP是一种非常重要的乳源生物活性肽,本研究工作围绕GMP的分离纯化以及后续的生物学活性评价,已经取得了一些成果[8-10]。目前人们已经从不同的角度来探讨GMP对机体健康的促进作用[11,12],但极少有研究对作用机制进行有力的论证与探讨。食品不仅为生命活动提供营养和能量,更重要的是食品可能通过调节细胞因子网络来调节免疫网络、信息传递网络和代谢网络,从而控制着机体的健康和生命活动[13,14]。当体内处于静息状态时,大多数T细胞在机体中处于非激活状态,并不会产生一定量的细胞因子。但是它一旦受到外界刺激,初始T细胞就会按照不同的比例分化为Th1或Th2细胞,进而向两大趋向分泌不同类的细胞因子,从而对免疫系统进行调节。Th1细胞或Th2细胞在不同条件下可能只是随机表达几种特定类型细胞因子中的一部分,如Th1分泌IFN-γ,而Th2就会分泌IL-4。 本文已成功地利用流式细胞术研究了GMP刺激对小鼠肠黏膜CD4+和CD8+T淋巴细胞数量的影响,证实了GMP可促进小鼠肠黏膜CD4+T淋巴细胞的增殖[11]。大量的研究表明由于目前尚无很好的区分Th1和Th2细胞亚群的表面标志物,因此只能根据细胞亚群分泌特征性细胞因子的不同来间接检测Th1/Th2平衡[15],已经有研究利用IFN-γ/IL-4比值的变化来反应Th1/Th2平衡的变化[16,17]。本研究结果表明,灌胃小鼠GMP 12 h内IL-4会出现明显的增高趋势,并在灌胃后第6 h与对照组呈现显著性差异,而在实验期间IFN-γ并未呈现明显的变化趋势;在连续5 d灌胃GMP的实验期间,GMP组小鼠在灌胃后第2天至第5天肠黏膜的IL-4质量浓度明显高于对照组和空白对照组,而IFN-γ在实验期间也未表现出明显的变化趋势,从而使得在连续灌胃后的第2天至第5天GMP组的IFN-γ/IL-4比值较空白对照组与生理盐水组均低,提示GMP可能具有下调Th1/Th2的潜在功效。总之,GMP对IFN-γ的影响是不显著的,该结论与Requena等[18]近期的研究成果是一致的,更重要的是得到的GMP可促进抗炎细胞因子IL-4表达的结论为进一步研究GMP在肠道内的抗炎机制提供了佐证。细胞因子在外界刺激的作用下变化非常迅速,而Th细胞的分化则需要几天时间[19]。由此推断GMP可能对Th细胞的分化具有一定的调节作用。
在不同的免疫应答和免疫性疾病中Th1和Th2的比例是不同的,而且正是这种比例的变化本身会引起相应的疾病,因此Th1和Th2平衡概念的提出就可以为一些疾病的诊治提供一定的途径。近些年的报道已经表明,炎症细胞因子和抗炎细胞因子的研究将大大推动了炎症性肠病 (Inflammatory Bowel Disease,IBD),尤其是溃疡性结肠炎(Ulcerative Colitis,UC)发病机制的研究,有关IBD的发病机制现已从细胞因子、转录因子、肠道菌群等方面得以阐释。余万桂等[20]人已证实溃疡性结肠炎小鼠外周血中的IL-4较正常组显著降低,表明调控Th1和Th2平衡对解决相关炎症性疾病的作用。本实验结论对乳源生物活性肽与机体健康关系的研究与开发具有重要的价值,为GMP的通过调节细胞因子网络来调节免疫网络、信息传递的机制和代谢网络等的深入研究奠定了坚实的基础。
[1]MOSMANN T R,CHERWINSKI H,BOND M W,et al.Two Types of Murine Helper T Cell Clone.I.Definition According to Profiles of Lymphokine Activities and Secreted proteins[J].Journal of Immunology,1986,136:2348-2357.
[2]MOSMANN T R,SAD S.The Expanding Universe of T-Cell Subsets:Th1,Th2 and More[J].Immunology Today,1996,17(3):138-146.
[3]DELFOUR A,JOLLES J,ALAIS C,et al.Caseino-Glycopep-Tides:Characterization of a Methionin Residue and of the N-terminal Sequence[J].Biochemical and Biophysical Research Communications,1965(19):452-455.
[4]OH S,WOROBO R W,KIM B,et al.Detection of Cholera Toxin-Binding Activity of κ-Casein Macropeptide and Optimization of Its ProductionbytheResponseSurfaceMethodology[J].Bioscience,Biotechnology and Biochemistry,2000(64):516-522.
[5]曹晋宜,陈庆森.糖巨肽(GMP)对小鼠盲肠中微生物区系的影响.食品科学,2008,29(10):582-585
[6]OTAIN H,HATA I.Inhibition of Proliferative Responses of Mouse Spleen Lymphocytes and Rabbit Peyer’s Patch Ceils by Bovine Milk Caseins and Their Digests[J].Journal of Dairy Research,1995,62(2):339-348.
[7]REQUENA P,DADDAOUA A,GUADIX E,et al.Bovine Glycomacropeptide Induces Cytokine Production in Human Monocytes through the Stimulation of the MAPK and the NF-kappa B Signal Transduction Pathways[J].British Journal of Pharmacology,2009,157(7):1232-1240.
[8]李博智,陈庆森.利用TGase结合微滤技术从乳清粉中分离纯化GMP的研究[J].食品科学,2009,20:97-103.
[9]曹晋宜,陈庆森.瑞士乳杆菌对小鼠肠道粘膜和肠组织中细胞因子影响的研究[J].食品科学,2009.21:343-347.
[10]李伟,陈庆森.糖巨肽对小鼠肠道免疫系统的影响[J].食品科学,2010,31(15):240-243.
[11]KELLEHER S L,CHATTERTON D,NIELSEN K,et al.Glycomacropeptide and α-Lactalbumin Supplementation of Infant Formula Affects Growth and Nutritional Status in Infant Rhesus Monkeys[J].The American Journal Clinical Nutrition,2003,77(5):1261-1268.
[12]GYORGY P,NORRIS R F,ROSE C S.Bifidus Factor I.Avariant of Lactobacillus Bifidus Requiring a Special Growth Factor[J].Archives of Biochemistry and Biophysics,1954(48):193-201.
[13]庞广昌,陈庆森,胡志和.食品是如何通过细胞因子网络控制人类健康的(Ⅰ)[J].食品科学,2006,27(5):258-264.
[14]庞广昌,陈庆森,胡志和.食品是如何通过细胞因子网络控制人类健康的(Ⅱ)[J].食品科学,2006,27(6):260-270.
[15]陶国华,曹兴建.Th细胞检测研究的现状[J].临床检验杂志,2005,23(3):232-233.
[16]ZAMANI A,VAHIDINIA A,GHANNAD M S.The Effect of Garlic ConsumptiononTh1/Th2CytokinesinPhytohemagglutinin(PHA)Activated Rat Spleen Lymphocytes[J].Phytotherapy Research,2007,23(4):579-581
[17]NAN C L,LEI Z L,ZHAO Z J,et al.Increased Th1/Th2(IFN-γ/IL-4)Cytokine mRNA Ratio of Rat Embryos in the Pregnant Mouse Uterus[J].Journal of Reproduction and Development,2007,53(2):219-228.
[18]REQUENA P,GONZALEZ R,POSADAS R L,et al.The Intestinal Anti-Inflammatory Agent Glycomacropeptide Has Immunomodulatory Actions on Rat Splenocytes[J].Biochemical Pharmacology,2010(79):1797-1804.
[19]MOSMANN T R,KOBIE J J,QUATAERT S A,et al.Thelper Cytokine Patterns:Defined Subsets,Random Expression,and External Modulation[J].Immunol Res.,2009,6:1-12.
[20]余万桂,张恒文,晏年春.实验性结肠炎小鼠血清中IL-1和IL-4活性研究[J].长江大学学报:自然科学版,2005,2(6):122-124.
Regulation of bovine glycomacropeptide on IFN-γ and IL-4 cytokines of mice
JIA Yu-chen,CHEN Qing-sen
(College of Biotechnology and Food Science,Tianjin University of Commerce,Tianjin 300134,China)
To explore the regulation of glycomacropeptide(GMP)on Th cytokines of mice and the mechanism of health maintenance by GMP.Methods:IFN-γ and IL-4 are important cytokines respectively secreted by Th1 and Th2 cells.Mice
GMP by oral gavage at the dose of 50 mg/kg(bw)d,then IFN-γ and IL-4 content in peripheral serum were assayed every 2 hours after the administration for 12 hours.In the following experiment,IFN-γ,IL-4 content and IFN-γ/IL-4 in gut mucosa were assayed every 1 d after continuous administration for 5 d.Results:IL-4 content in peripheral serum was up-regulated by GMP administration in 12 hours,and IL-4 content varied significantly at 6th hour,whereas IFN-γ content didn’t.Similarly,continuous administration of GMP for 5 d could up-regulate IL-4 content in gut mucosa with significant variation at 3th and 4th day,compared with IFN-γ which was not affected,therefore the ratio of IFN-γ/IL-4 were lower significantly from 3th to 5th day.It was suggested that GMP could regulate Th1/Th2 imbalance.
bovine glycomacropeptide,GMP,Th,cytokine
Q93-33
A
1001-2230(2010)11-0011-04
2010-08-30
国家自然科学基金资助项目(30771524)。
贾玉臣(1985-),男,硕士研究生,研究方向为发酵生物技术、乳品质量与安全。
陈庆森

