超声辅助复合酶法提取叶黄素及其抗氧化活性研究





摘要:文章旨在采用超声辅助复合酶法优化叶黄素提取工艺并考察其抗氧化活性。优选黄玉米为原材料,主要选取酶添加量、酶解时间、酶解温度、液料比、超声时间进行单因素实验,考察其对黄玉米中叶黄素提取量的影响,并结合响应面法分析优化黄玉米中叶黄素的提取量,得出最佳工艺:酶添加量3.2%、酶解时间146 min、酶解温度50 ℃、液料比50∶1 (mL/g)、超声时间63 min,该条件下所得叶黄素提取量为(7 639.49±3.73) μg/g,与预测值7 641.64 μg/g接近。体外抗氧化实验表明,黄玉米叶黄素对DPPH·、ABTS+·、O2-·、·OH均具有较好的清除能力,IC50值分别为0.022,0.124,1.447,1.374 mg/mL;同时具有较好的Fe3+还原能力,浓度为1.4 mg/mL时,铁离子还原能力为1.806 mmol/L,为食品工业中叶黄素的生产加工及其功能性产品的开发提供了参考。
关键词:叶黄素;超声波;复合酶法;响应面优化;抗氧化活性
中图分类号:TS201.1""""" 文献标志码:A"""" 文章编号:1000-9973(2024)11-0187-08
Study on Extraction of Lutein by Ultrasonic-Assisted Compound Enzymatic
Method and Its Antioxidant Activity
MA Yong-qiang, NIU Ji-chao, YOU Ting-ting, YU Shi-you, LI Chen-chen,
WANG Xin-man, YA Han-qin, ZHAO Ruo-bing
(College of Food Engineering, Harbin University of Commerce, Harbin 150028, China)
Abstract: The aim of this paper is to optimize the extraction process of lutein by ultrasonic-assisted compound enzymatic method and investigate its antioxidant activity. Yellow corn is selected as the raw material. Single factor experiment is conducted on enzyme addition amount, enzymatic hydrolysis time, enzymatic hydrolysis temperature, liquid-solid ratio and ultrasonic time to explore their effects on the extraction amount of lutein from yellow corn.Response surface methodology is used to analyze and optimize the extraction amount of lutein from yellow corn. It is determined that the optimal process is the enzyme addition amount of 3.2%, enzymatic hydrolysis time of 146 min, enzymatic hydrolysis temperature of 50 ℃, liquid-solid ratio of 50∶1 (mL/g), and ultrasonic time of 63 min. Under these conditions, the extraction amount of the obtained lutein is (7 639.49±3.73) μg/g, which is close to the predicted value of 7 641.64 μg/g. The results of in vitro antioxidant experiment show that lutein from yellow corn has good scavenging capacity on DPPH·, ABTS+·, O2-·," ·OH. The IC50 values are 0.022, 0.124, 1.447, 1.374 mg/mL respectively. At the same time, it has good Fe3+ reducing power, with the iron ion reducing power of 1.806 mmol/L at the concentration of 1.4 mg/mL. This study has provided references for the production and processing of lutein, as well as the development of functional products of lutein in the food industry.
Key words: lutein; ultrasound; compound enzymatic method; response surface optimization; antioxidant activity
收稿日期:2024-05-21
基金项目:黑龙江省应用技术研究与开发项目(GA20B301)
作者简介:马永强(1963—),男,教授,硕士,研究方向:食品化学。
*通信作者:尤婷婷(1989—),女,工程师,硕士,研究方向:食品生物化学。
玉米主要分为甜玉米、糯玉米、黄玉米,是种植最广泛的禾本科玉蜀黍属植物之一。
黄玉米味道略甘,除了含有淀粉和脂肪外,还含有多种氨基酸、微量元素和类胡萝卜素(主要包括叶黄素、玉米黄质等),具有多重营养保健功效[1]。叶黄素是一种由9个共轭双键构成的长链萜类化合物,早在1995年被美国FDA批准作为食品补充剂用于食品和饮料。作为一种对人体健康有益的天然脂溶性色素,其在抗氧化[2]、保护视力[3-4]、改善认知能力[5-6]、抗癌[7-8]等方面得到广泛应用。然而,叶黄素不能由人体直接合成,需要从外界食物中摄取。研究者们开发了许多方法提取叶黄素,如有机溶剂[9]、酶制剂[10],也常利用食品加工高新技术辅助提取,如微波[11]、超声波[12]、超临界萃取[13]等。研究发现,酶法提取可促进细胞壁和细胞内的有效活性物质快速释放[14],而超声辅助提取所需时间较少且效率高,其超声波高空化效应和机械效应能对原料进行破碎,加速物质溶出[15]。目前,尚没有关于超声辅助复合酶法提取叶黄素的相关研究,超声辅助复合酶法同时具备两种技术的优势,既快速、高效、环保,又能提高提取量。
本文采用超声波辅助复合酶法,固定复合酶(木瓜蛋白酶、纤维素酶、果胶酶)比例为1∶1∶1提取黄玉米中的叶黄素,通过响应面法设计优化,并评估其对DPPH自由基、ABTS+自由基、超氧阴离子自由基、羟基自由基、铁离子还原能力的抗氧化活性,为叶黄素提取加工及其功能活性的深入研究提供了理论依据和技术支撑。
1 材料与方法
1.1 材料
黄玉米:由安徽涡阳县惠乡源特产门市部提供;叶黄素标准品(纯度≥96%):上海麦克林生化科技有限公司;果胶酶(食品级):山东隆科特酶制剂有限公司;纤维素酶、木瓜蛋白酶(均为食品级):南宁庞博生物工程有限公司。
1.2 试剂
1,1-二苯基-2-三硝基苯肼(DPPH)、2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、2,4,6-三(2-吡啶基)-1,3,5-三嗪(TPTZ)(均为国产分析纯):上海麦克林生化科技有限公司;Tris-HCl缓冲液(pH 8.0):上海源叶生物科技有限公司;无水乙醇、抗坏血酸、邻苯三酚、过硫酸钾、硫酸亚铁、过氧化氢、水杨酸、醋酸钠、三氯化铁、盐酸、乙酸乙酯(均为国产分析纯):天津市天力化学试剂有限公司;实验用水为蒸馏水。
1.3 主要仪器与设备
西厨750T型高速多功能粉碎机 永康市铂欧五金制品有限公司;UV-5200紫外可见分光光度计 上海元析仪器有限公司;KQ-250DE数控超声波清洗器 昆山市超声仪器有限公司;HWS-26电热恒温水浴锅 上海一恒科学仪器有限公司;FA224精密天平 上海舜宇恒平科学仪器有限公司;YP100电子天平 上海光正医疗仪器有限公司;PHS-3E酸度计 上海仪电科学仪器股份有限公司。
1.4 方法
1.4.1 黄玉米中叶黄素的提取工艺
取干黄玉米粒经粉碎机打磨成黄玉米粉,过120目筛,备用。固定复合酶比例(木瓜蛋白酶∶纤维素酶∶果胶酶为1∶1∶1),溶解,控制温度,酶解数分钟,灭酶(沸水浴加热反应)10 min,冷却至室温,加入助提取剂乙酸乙酯,固定超声波功率(250 W)辅助提取后过滤,得到叶黄素粗提取液,将其稀释并定容至一定体积,即为叶黄素提取液。
1.4.2 单因素实验
以酶添加量2%、酶解时间120 min、酶解温度50 ℃、液料比20∶1 (mL/g)、超声时间30 min和超声功率250 W为固定参数,调整酶添加量(1%、2%、3%、4%、5%)、酶解时间(60,90,120,150,180 min)、酶解温度(35,40,45,50,55 ℃)、液料比(20∶1、30∶1、40∶1、50∶1、60∶1, mL/g)、超声时间(30,40,50,60,70 min),探究其对叶黄素提取量的影响。
1.4.3 响应面优化提取工艺
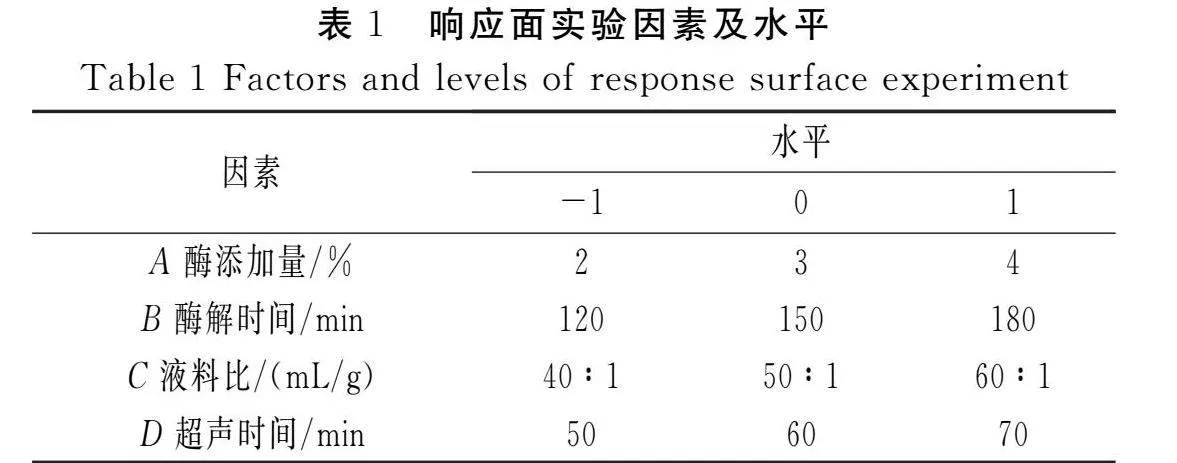
选取酶添加量(A)、酶解时间(B)、液料比(C)和超声时间(D)为4个自变量因素,以叶黄素提取量(μg/g)为响应值,利用Box-Behnken优化工艺条件。响应面实验因素及水平见表1。
1.4.4 绘制标准曲线
准确配制50 μg/mL叶黄素标准溶液,分别吸取0,0.5,1.0,2.0,3.0,4.0,5.0 mL叶黄素标准溶液,用90%乙醇定容至25 mL棕色容量瓶中,于447 nm处测其吸光值。以叶黄素质量浓度(μg/mL)为横坐标(X),447 nm处测定的吸光值为纵坐标(Y),绘制叶黄素标准曲线:Y=0.015 3X-0.008 4,R2=0.999 7。
1.4.5 叶黄素提取量测定
取1 mL提取液定容至10 mL容量瓶中,按照1.4.4中方法测定并根据式(1)计算叶黄素提取量。
Y=C×V×NM。(1)
式中:Y为叶黄素提取量(μg/g);C为标准曲线计算得到的叶黄素质量浓度(μg/mL);V为叶黄素提取液体积(mL);N为稀释倍数10;M为黄玉米粉质量(g)。
1.4.6 黄玉米中叶黄素的抗氧化活性测定
1.4.6.1 DPPH自由基清除能力测定
参考郭磊等[16]的方法并略作修改。精密称取DPPH粉末4 mg溶于100 mL容量瓶中,用90%乙醇定容。将10 mg/mL样品溶液分别稀释至0.1,0.2,0.3,0.4,0.5 mg/mL,各取3 mL于比色管中,加入3 mL DPPH溶液混匀,暗处放置30 min,以90%乙醇为参比,于517 nm处测其吸光值A1;样品溶液与90%乙醇混合,测其吸光值A2;空白实验吸光值为A0;以相同浓度的VC溶液作为对照组,清除率按式(2)计算。
DPPH自由基清除率(%)=(1-A1-A2A0)×100%。(2)
1.4.6.2 ABTS+自由基清除能力测定
参考胡晓波[17]的方法并略作修改。将预先制备的ABTS母液用90%乙醇稀释,调节734 nm处的吸光值至0.7±0.02,即为ABTS测定液,该测定液现配现用。将10 mg/mL样品溶液分别稀释至0.1,0.2,0.3,0.4,0.5,0.6,0.7 mg/mL,分别移取1.0 mL样品稀释液并加入4.0 mL ABTS测定液于比色管中混匀,暗处反应10 min,以90%乙醇为参比,于734 nm处测定吸光值A1;用90%乙醇代替ABTS测定液,于734 nm处测定吸光值A2;用90%乙醇代替样品液作为空白组,于734 nm处测定吸光值A0。以相同浓度的VC溶液作为对照组,ABTS+自由基清除率按式(3)计算。
ABTS+自由基清除率(%)=(1-A1-A2A0)×100%。(3)
1.4.6.3 超氧阴离子自由基清除能力测定
参考王静杰等[18]的方法并略作修改。需先配制邻苯三酚溶液(3 mmol/L)备用,将10 mg/mL样品溶液分别稀释至0.2,0.4,0.6,0.8,1.0 mg/mL,取1 mL样品稀释液分别加入4.5 mL 50 mmol/L Tris-HCl缓冲液(pH 8.0)混匀,在25 ℃下反应20 min,随后加入0.1 mL邻苯三酚溶液混匀,反应5 min,立即加入HCl溶液(8 mmol/L)终止反应,于320 nm处测定吸光值A1;用蒸馏水代替邻苯三酚溶液,于320 nm处测定吸光值A2;用蒸馏水代替样品液,于320 nm处测定吸光值A0。以相同浓度的VC溶液作为对照组,超氧阴离子自由基清除率按式(4)计算。
超氧阴离子自由基清除率(%)=(1-A1-A2A0)×100%。(4)
1.4.6.4 羟基自由基清除能力测定
参考孟繁玲等[19]的方法并略作修改。将10 mg/mL样品溶液分别稀释至0.2,0.4,0.6,0.8,1.0,1.2,1.4 mg/mL,取3 mL样品稀释液,依次加入10 mmol/L硫酸亚铁溶液、10 mmol/L水杨酸溶液、100 mmol/L H2O2溶液各0.5 mL混匀,在37 ℃恒温水浴锅中反应20 min,于510 nm处测定吸光值A1;用蒸馏水代替水杨酸溶液,于510 nm处测定吸光值A2;用蒸馏水代替样品液,于510 nm处测定吸光值A0。以相同浓度的VC溶液作为对照组,羟基自由基清除率按式(5)计算。
羟基自由基清除率(%)=(1-A1-A2A0)×100%。(5)
1.4.6.5 铁离子还原能力测定
参考Wang等[20]的方法并略作修改。将FRAP工作液于37 ℃恒温水浴预热,由0.3 mol/L pH 3.6的醋酸缓冲液、10 mmol/L TPTZ溶液、20 mmol/L FeCl3溶液(40 mmol/L HCl溶液定容)按10∶1∶1混合,现配现用。分别取不同浓度的FeSO4稀释液,加入FRAP工作液混合,于37 ℃恒温水浴暗处反应20 min。以浓度为横坐标(x),在波长593 nm处测定的吸光值为纵坐标(y),绘制标准曲线:y=0.978 6x+0.128 3,R2=0.997 8,线性范围为0~1 mmol/L。分别加入1.0 mL不同浓度的样品溶液与4.0 mL FRAP工作液混合,于37 ℃水浴暗处反应20 min,于593 nm处测定吸光值A1;用无水乙醇代替样品作为空白,于593 nm处测定吸光值A0;用醋酸缓冲液代替FRAP工作液,于593 nm处测定吸光值A2,将样品的实际吸光值(即A1-A2-A0)换算为FeSO4的浓度值 (FRAP,mmol/L),以相同浓度的VC标准溶液作为阳性对照,同法测定其抗氧化活性。
1.4.7 数据处理
单因素实验均重复3次,结果以平均值±标准差表示,使用Design-Expert V8.0.6.1软件进行响应面实验设计;使用IBM SPSS Statistics 27.0软件对数据进行显著性分析并计算IC50值;使用Origin 2022软件对数据进行绘图。
2 结果与分析
2.1 单因素实验结果
2.1.1 酶添加量对叶黄素提取量的影响
木瓜蛋白酶、果胶酶活力的测定参考万正洋等[21]、张飞等[22]的方法并稍作修改,所得结果分别为4×104 U/g和717 U/g,纤维素酶活力采用DNS方法[23]测定,结果为159 U/g。
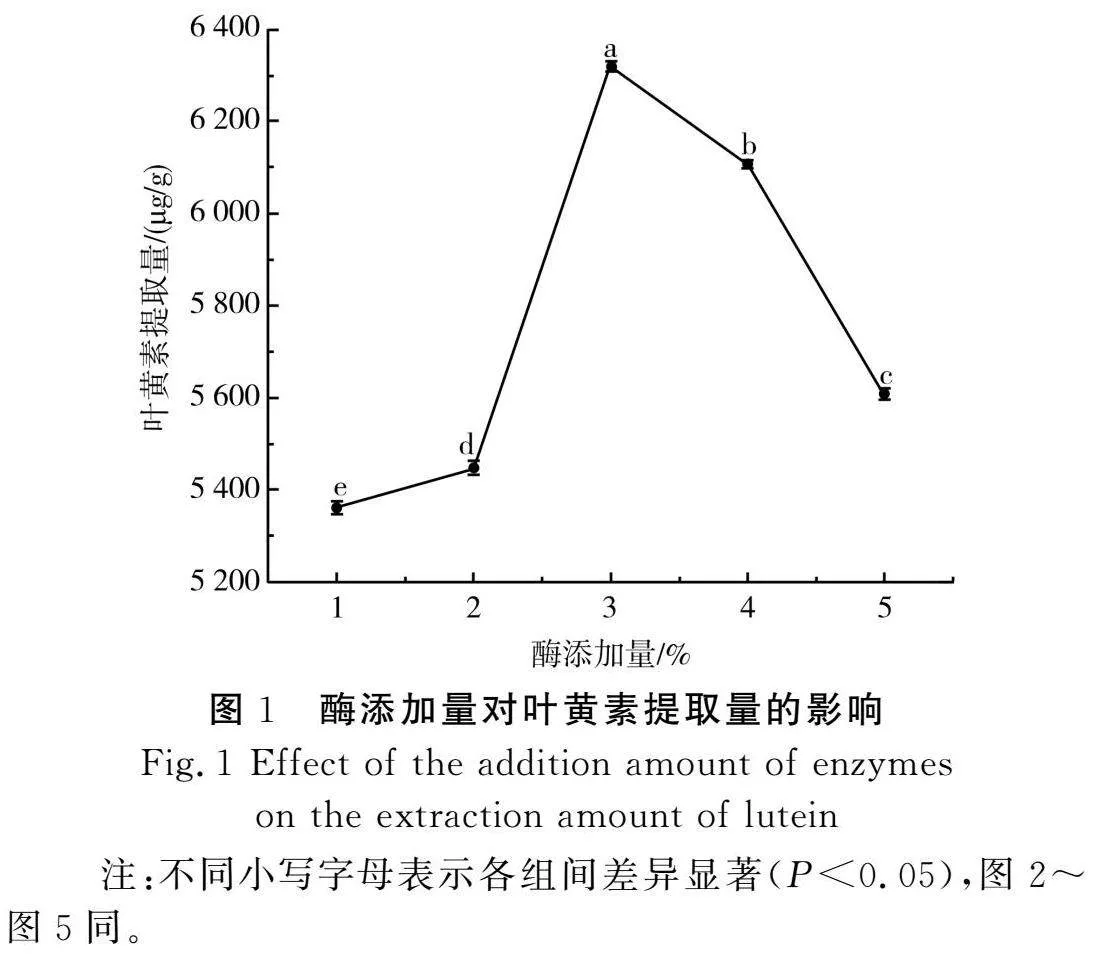
由图1可知,随着酶添加量的增加,叶黄素提取量整体呈先上升后下降的趋势(P<0.05),酶添加量为3%时,叶黄素提取量为6 318 μg/g,达到最高值,而后随着酶添加量增加至5%,叶黄素提取量显著下降至5 606 μg/g,原因可能是酶添加量过多,促使水解产物破坏细胞壁,使其破裂,导致叶黄素扩散受到一定限制,堵塞其主体通道,溶出受阻,从而使提取量下降[24]。因此,选择2%、3%、4% 3个水平的酶添加量进行后续的响应面实验。
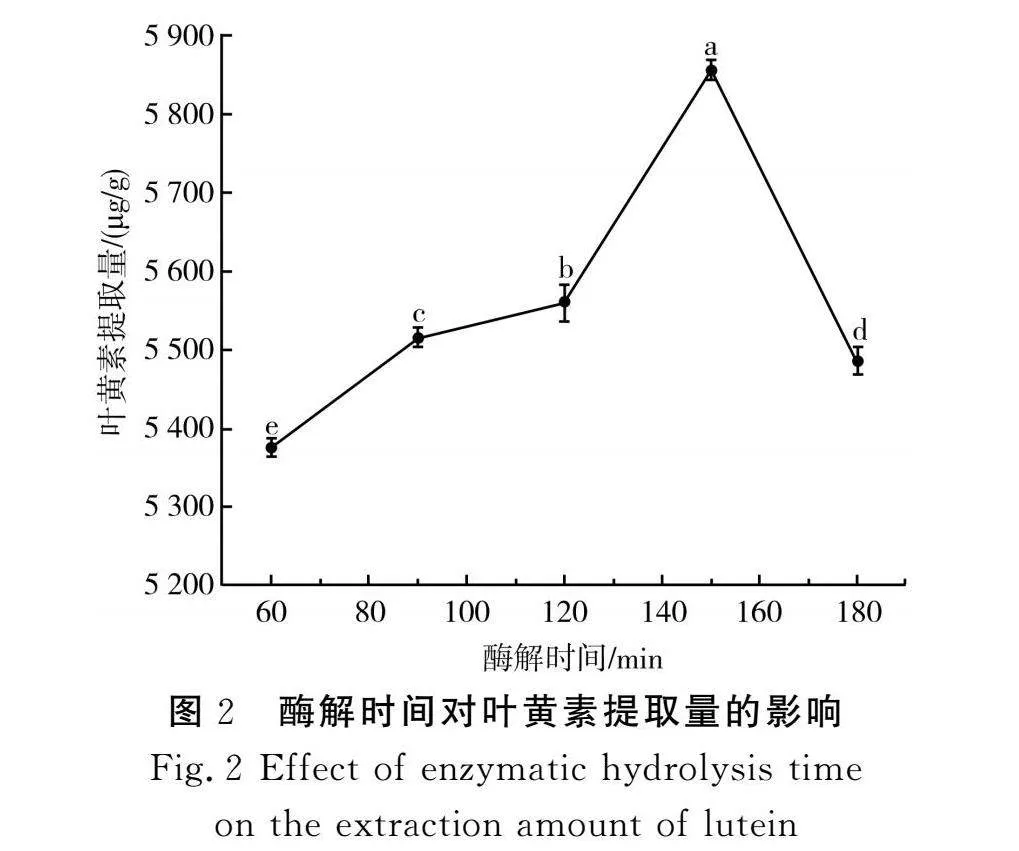
2.1.2 酶解时间对叶黄素提取量的影响
由图2可知,在60~150 min范围内,叶黄素提取量随着酶解时间的延长呈逐渐升高的趋势,在150 min时达到最大值,为5 855 μg/g;当酶解时间达到180 min时,叶黄素提取量下降至5 486 μg/g,原因可能是在过短的酶解时间内,复合酶并没有完全破坏细胞壁,导致叶黄素未能被有效提取;随着酶解时间的增加,复合酶能充分破坏细胞壁,叶黄素随之大量释放,提取量上升;当酶解时间过长时,底物浓度逐渐降低,产物积累逐渐升高,从而对酶活性产生反馈抑制作用,抑制酶促反应,导致叶黄素提取量逐渐减少[25]。因此,选择酶解时间120,150,180 min 3个水平进行后续的响应面实验。
2.1.3 酶解温度对叶黄素提取量的影响
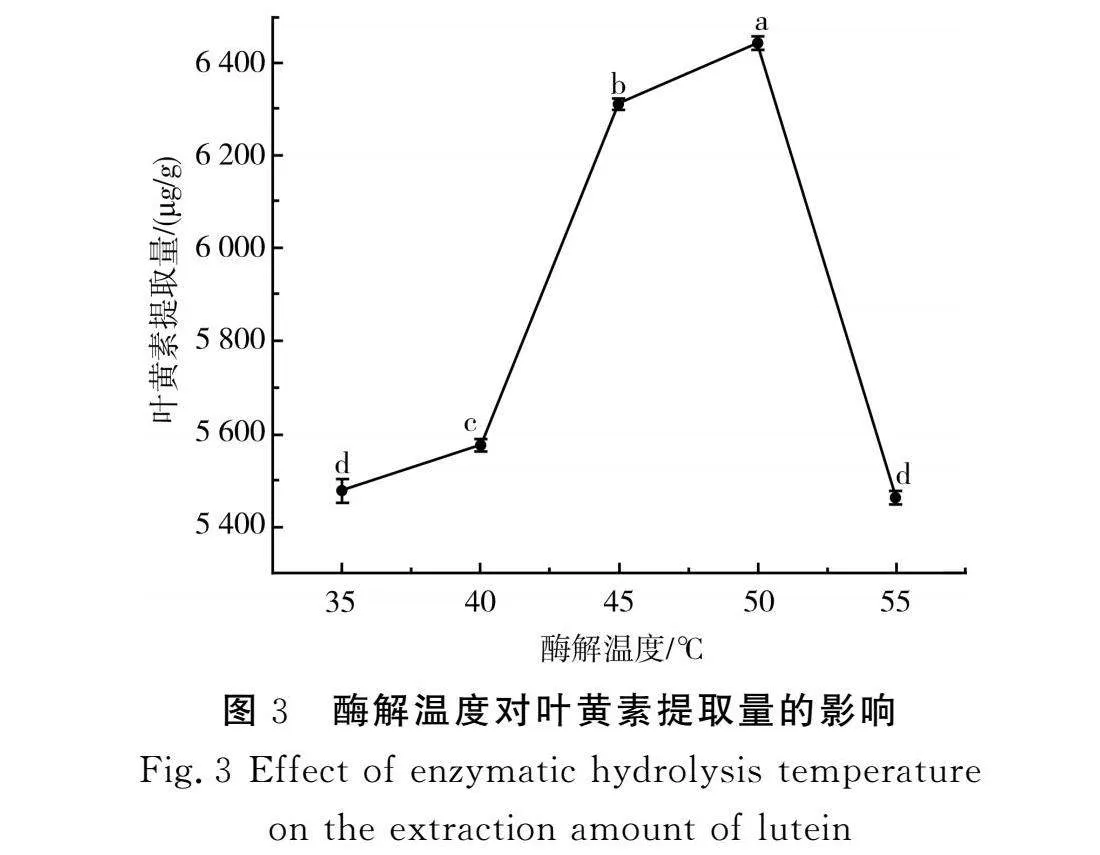
由图3可知,当酶解温度为35~50 ℃时,叶黄素提取量随着酶解温度的升高呈显著增加的趋势(P<0.05),且在50 ℃时达到最高值,为6 440 μg/g;当酶解温度为55 ℃时,叶黄素提取量降至5 464 μg/g,原因可能是当温度升高至最适温度时,有助于提高酶解速率和叶黄素的扩散能力,当酶解温度过高时,复合酶发生不可逆的变性,甚至失活,从而影响细胞破壁[26]。因此,选择50 ℃作为最佳温度。
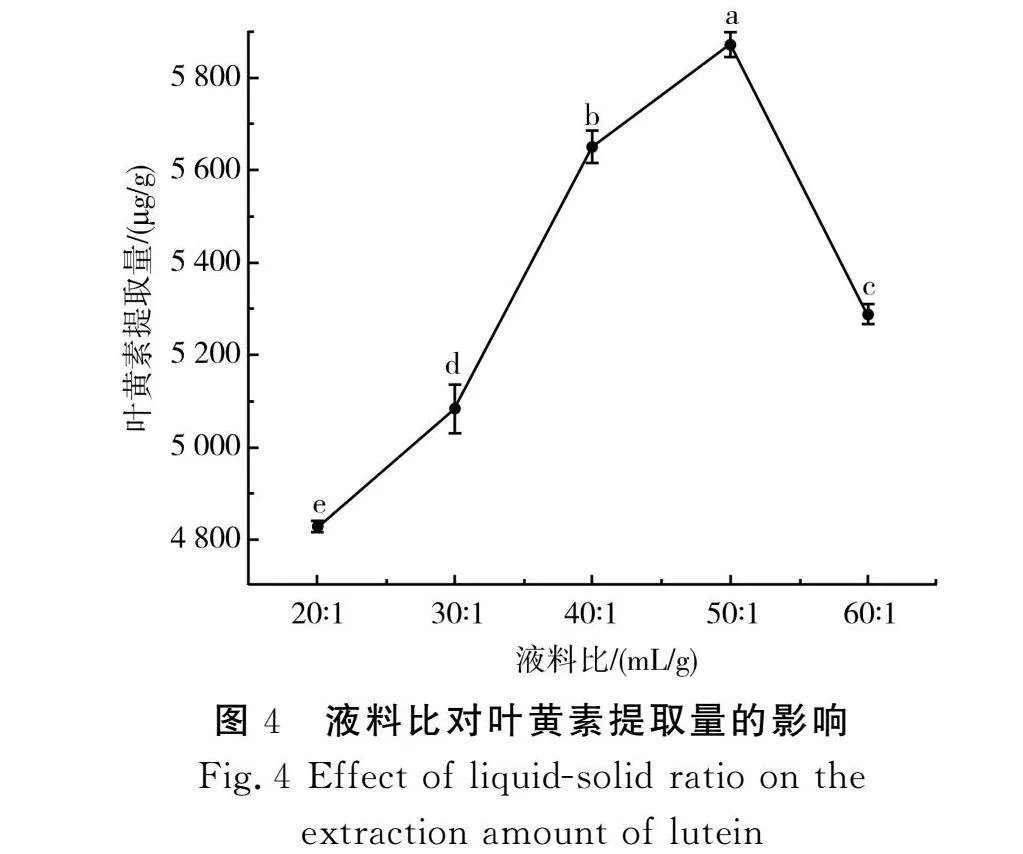
2.1.4 液料比对叶黄素提取量的影响
由图4可知,在液料比20∶1~50∶1范围内,叶黄素提取量随着液料比的增大呈显著上升的趋势,当液料比为50∶1时,叶黄素提取量为5 873 μg/g,原因可能是叶黄素在超声波辅助作用下充分溶出;继续增大液料比至60∶1,叶黄素提取量降低至5 288 μg/g,原因可能是原料与乙酸乙酯提取剂接触过多,不能提高溶出速度,反而起到稀释作用,使其提取量降低;还有可能是超声波的能量随着液料比的增加消耗过大,导致原料吸收的速率减小,提取量下降[27]。因此,选择液料比40∶1、50∶1、60∶1 3个水平进行后续的响应面实验。
2.1.5 超声时间对叶黄素提取量的影响
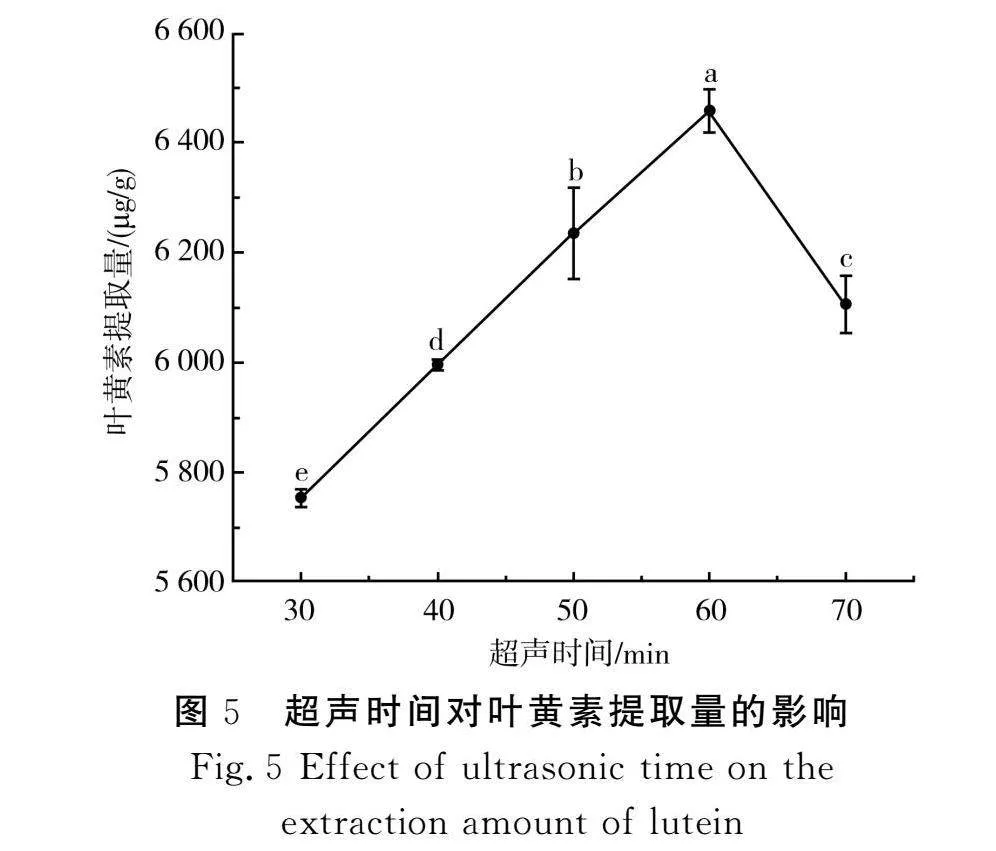
由图5可知,当超声时间为30~60 min时,叶黄素提取量显著增加(P<0.05),并在60 min时达到最高值6 458 μg/g;当超声时间延长至70 min时,叶黄素提取量下降至6 105 μg/g,原因可能是随着超声时间的增加,细胞壁被较完全地破坏,促使提取量上升;超声时间过长,所引起的空化效应和机械振动使溶出叶黄素的空间结构遭到破坏,发生部分降解反应,从而使叶黄素提取量降低[28]。因此,选择超声时间50,60,70 min 3个水平进行后续的响应面实验。
2.2 响应面优化结果与分析
2.2.1 响应面优化设计结果
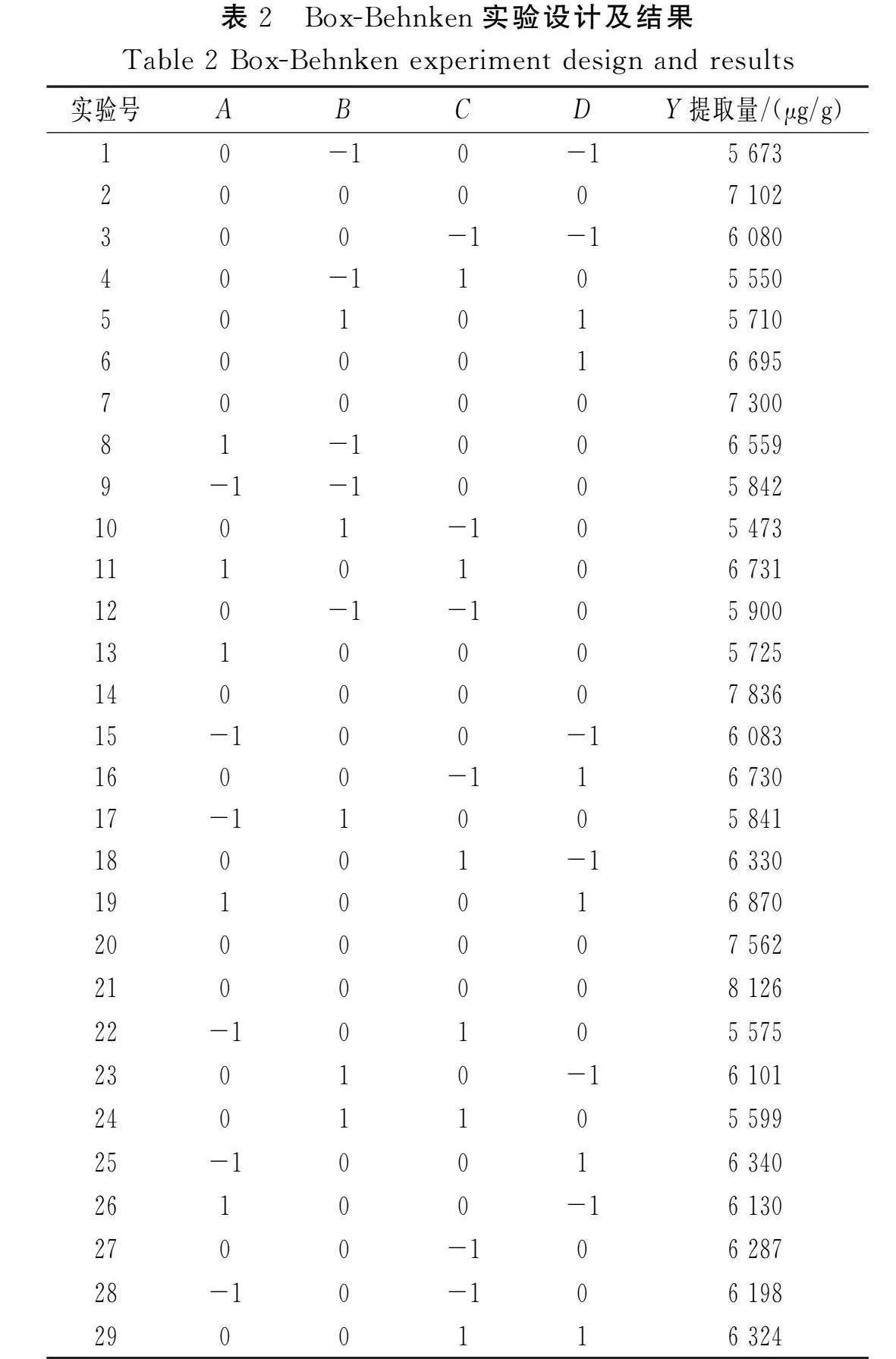
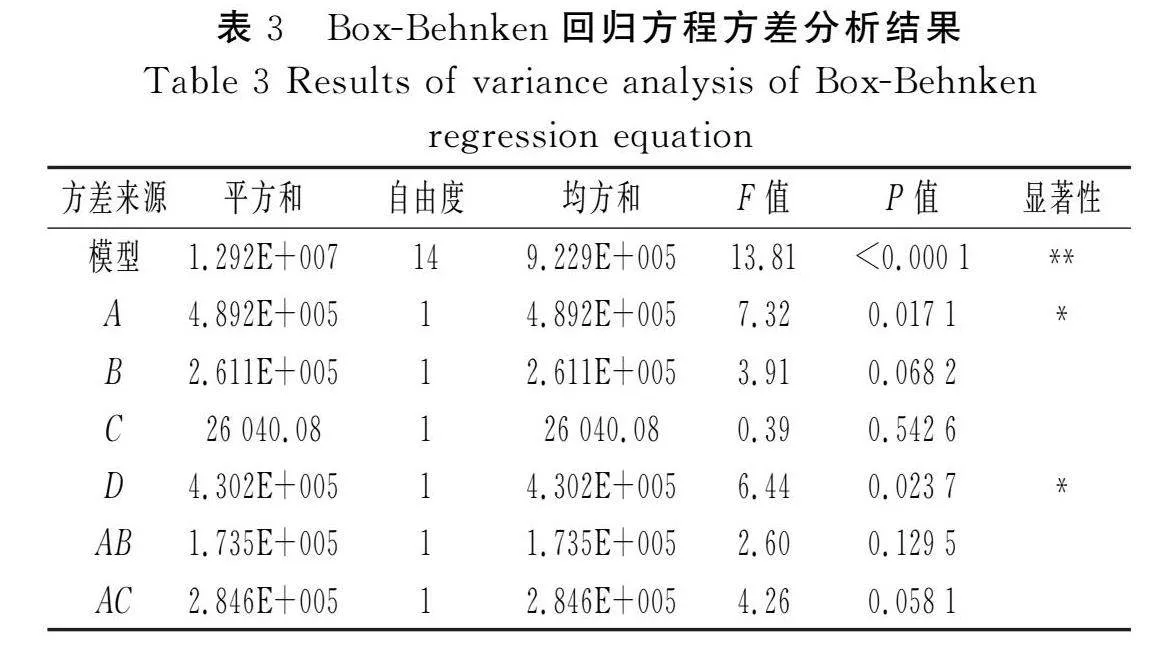
基于单因素实验结果,以酶添加量(A)、酶解时间(B)、液料比(C)、超声时间(D)作为考察因素,以叶黄素提取量(Y)作为响应值,通过Design-Expert V8.0.6.1软件,采用Box-Behnken方法对黄玉米中叶黄素的提取工艺进行优化,实验设计及结果见表2,方差分析结果见表3。
2.2.2 响应面方差分析
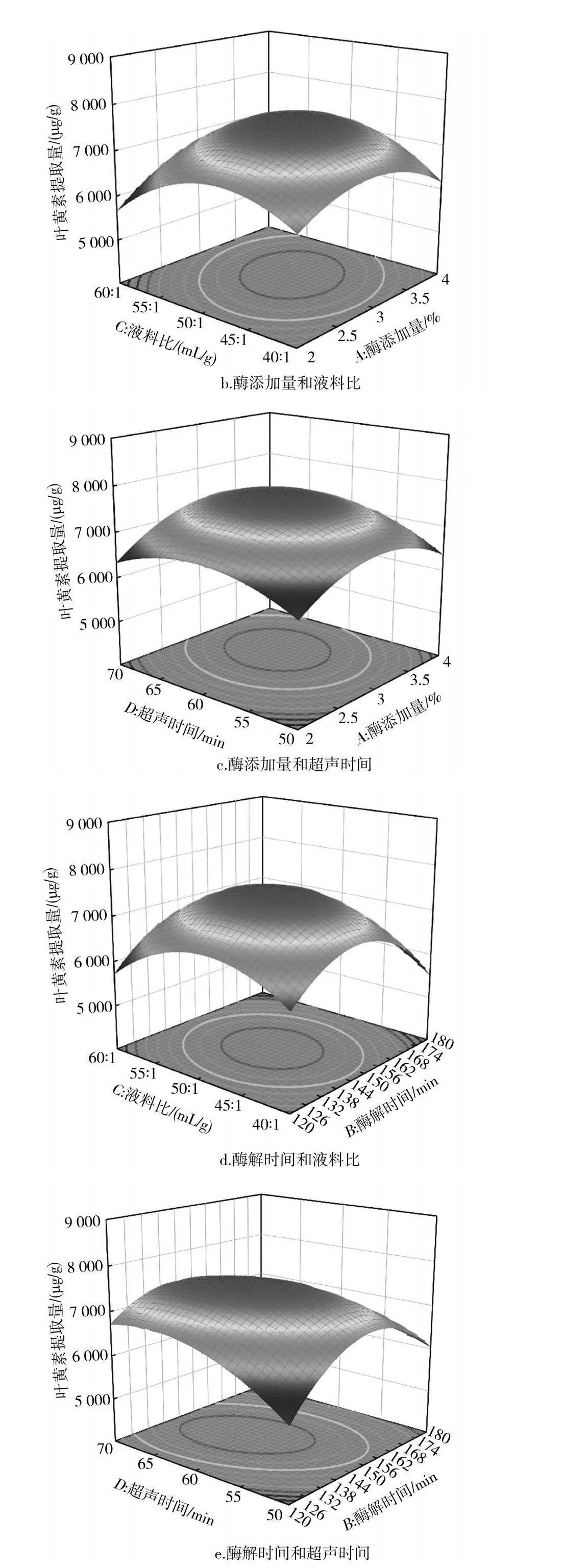
通过对表2中数据进行回归拟合,得到的二次多项式模型回归方程为Y=7 585.2+201.92A-147.50B-46.58C+189.33D-208.25AB+266.75AC+120.75AD+119BC-353.25BD-164CD-617.73A2-1 056.85B2-793.23C2-507.1D2。由表3可知,模型的F值为13.81,P<0.000 1,达到极显著水平(P<0.01),失拟项的P值为0.991 6>0.05,不显著,表明实验结果受所选因素的影响较大,受其他因素的影响较小,可信度高,实验设计可靠。R2为0.932 5(接近1),表明实测值与模型预测值的拟合程度较好;RAdj2为0.864 9,表明该模型能解释86.49%的响应值变化和结果;变异系数(C.V.)为4.07%<10%,精密度为11.132>4,表明该模型实验结果真实可靠。各影响因素中,二次项A2、B2、C2、D2的影响均极显著(Plt;0.01),一次项A、D以及交互项BD的影响显著(Plt;0.05),而其他一次项、交互项的影响不显著(P>0.05)。根据F值和P值可判断各因素对响应值(Y)的影响,F值越大、P值越小,影响越显著;各单因素对叶黄素提取量的影响程度从大到小为酶添加量(A)>超声时间(D)>酶解时间(B)>液料比(C),各因素交互作用对叶黄素提取量的影响程度从大到小为BD>AC>AB>CD>AD>BC。
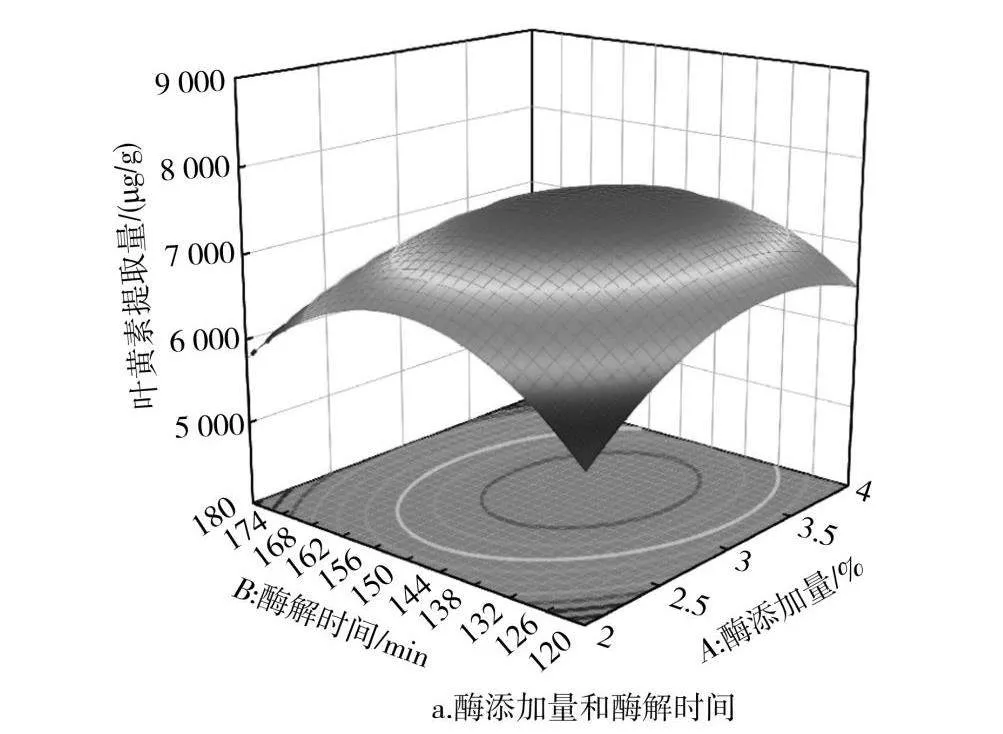
2.2.3 响应面交互作用
响应面能直观反映出各因素交互作用的显著性结果,3D响应曲面坡度越陡峭、等高线越密集、椭圆程度越高,表明两因素之间交互作用越显著,反之则越不显著。由图6可知各因素之间的交互作用,图6中e的等高线椭圆程度较高,表明酶解时间和超声时间的交互作用对叶黄素提取量的影响显著,与方差分析结果一致;而其他等高线偏圆,表明交互作用不显著。
2.2.4 最佳工艺验证
根据Box-Behnken模型优化得到的最佳工艺条件为酶添加量3.21%、酶解时间145.91 min、液料比49.68∶1 (mL/g)、超声时间62.63 min,在该条件下,黄玉米中叶黄素提取量的理论值达到7 641.64 μg/g。为验证回归模型的有效性,根据实际将工艺参数调整为酶添加量3.20%、酶解时间146 min、液料比50∶1 (mL/g)、超声时间63 min,进行3次平行验证,所得的叶黄素提取量达到(7 639.49±3.73) μg/g,与预测值接近,表明模型可靠,为叶黄素提取工艺提供了参考。
3 黄玉米中叶黄素体外抗氧化活性分析
3.1 DPPH自由基清除能力
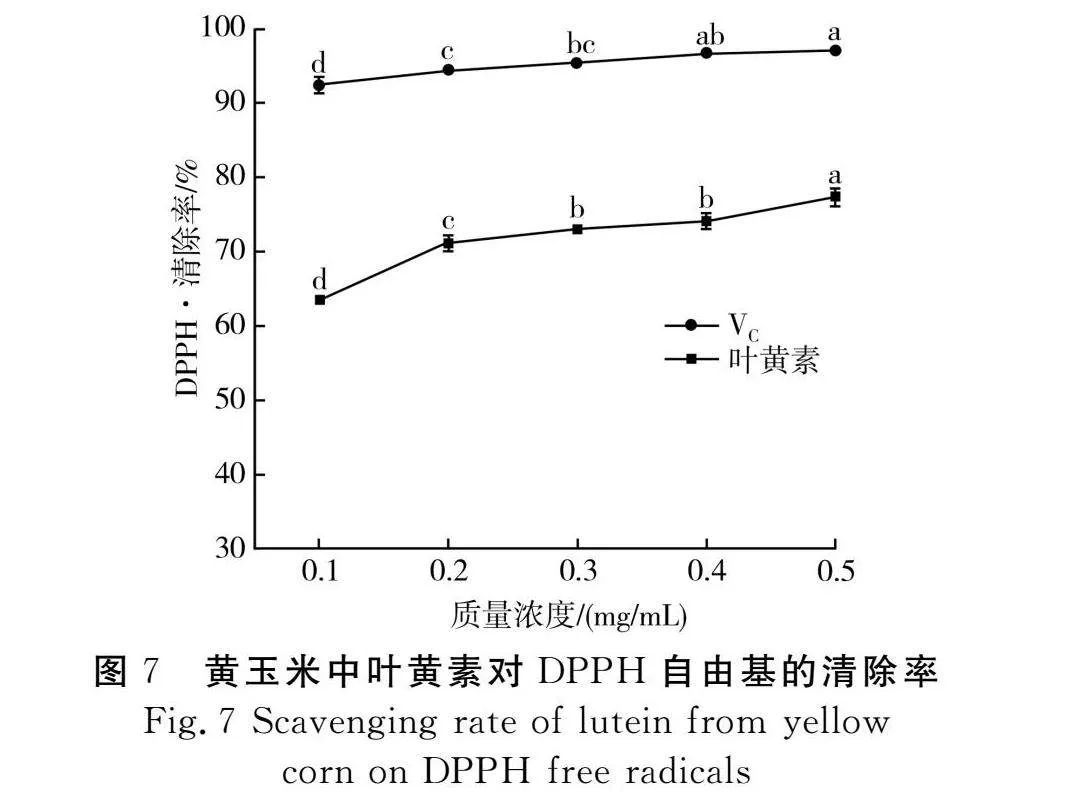
由图7可知,当质量浓度为0.1~0.4 mg/mL时,VC溶液的DPPH·清除率逐渐增加(92.42%~96.59%)且具有显著性差异(Plt;0.05),当质量浓度为0.5 mg/mL时DPPH·清除率达到97.06%;而黄玉米中叶黄素的DPPH·清除率在质量浓度为0.1~0.4 mg/mL时呈上升趋势(63.53%~74.04%),在0.5 mg/mL时DPPH·清除率达到77.3%;证明在一定范围内,DPPH·清除率与其浓度呈剂量效应关系,由于DPPH自由基中存在单电子,与黄玉米中叶黄素发生电子配对,其紫色颜色的变化与黄玉米中叶黄素浓度呈正相关性[29]。根据数据分析,VC溶液的IC50值为0.002 mg/mL,黄玉米中叶黄素的IC50值为0.022 mg/mL,IC50值越小,表明自由基清除能力越强,抗氧化作用越强[30],由此表明黄玉米中叶黄素的DPPH·清除能力虽弱于VC溶液,但也具有一定的抗氧化能力。
3.2 ABTS+自由基清除能力
由图8可知,VC溶液和黄玉米中叶黄素均具有一定的清除ABTS+自由基的能力。当质量浓度为0.1~0.4 mg/mL时,VC溶液和黄玉米中叶黄素对ABTS+自由基的清除率均呈显著上升趋势(P<0.05),分别为61.83%~84.48%和46.13%~73.44%;当质量浓度为0.5~0.7 mg/mL时,VC溶液对ABTS+自由基的清除率继续上升,在0.7 mg/mL时达到最大值96.03%,而黄玉米中叶黄素对ABTS+自由基的清除率呈平缓上升趋势(74.67%~77.49%),ABTS溶液中具有稳定的含氮自由基,其羟基结构会干扰自由基链式反应,从而产生抗氧化作用[31-32],虽然黄玉米中叶黄素的清除能力低于VC溶液,但其较强的供氢能力也能在清除反应中发挥作用;数据分析得出,VC溶液的IC50值为0.067 mg/mL,黄玉米中叶黄素的IC50值为0.124 mg/mL,表明黄玉米中叶黄素对ABTS+自由基具有一定的清除能力,但其效果没有VC溶液明显。
3.3 超氧阴离子自由基清除能力
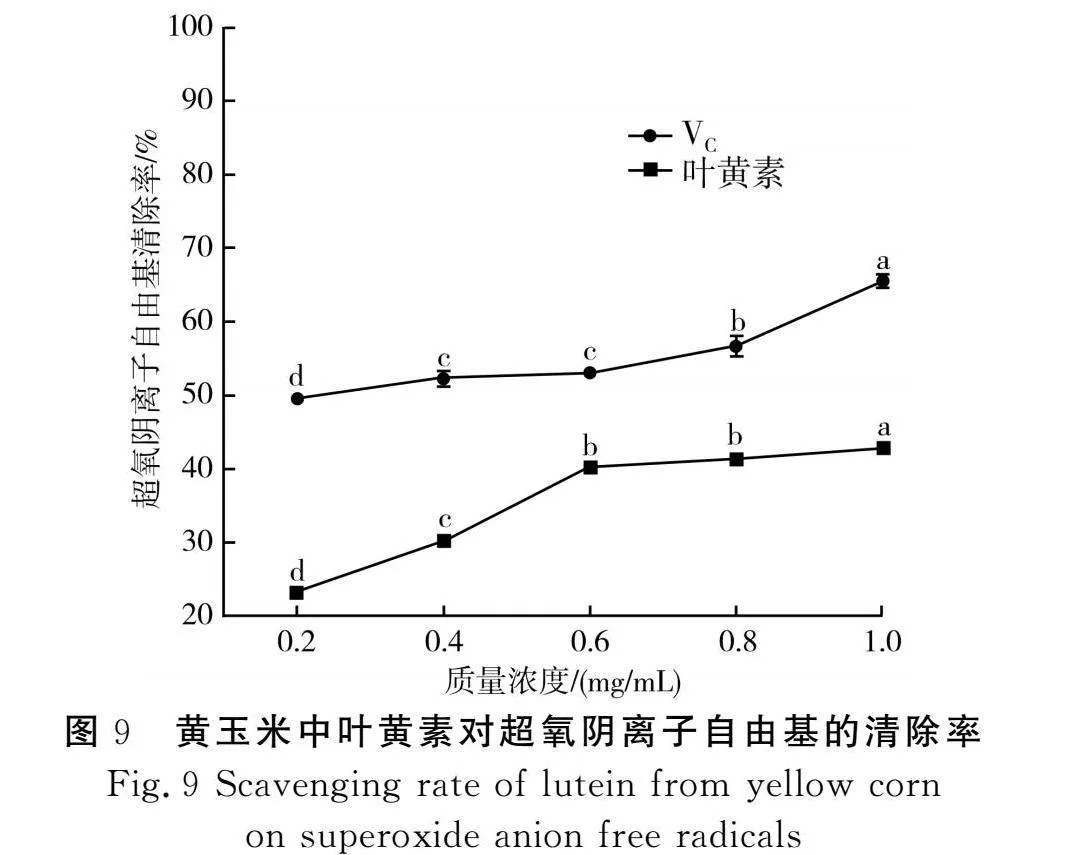
在机体内,超氧阴离子自由基的寿命最长,一定条件下可生成羟基自由基、过氧化氢、脂质过氧化物及单线态氧等其他活性氧,从而造成机体的氧化损伤[33]。由图9可知,随着质量浓度从0.2 mg/mL增加至1.0 mg/mL,黄玉米中叶黄素的超氧阴离子自由基清除率从23.30%增加到42.95%;而VC溶液的超氧阴离子自由基清除率从49.58%增加到65.52%,优于黄玉米中叶黄素的清除效果;数据分析得出,VC溶液的IC50值为0.267 mg/mL,黄玉米中叶黄素的IC50值为1.447 mg/mL,表明黄玉米中叶黄素对超氧阴离子自由基具有一定的清除能力,但其效果弱于VC溶液。
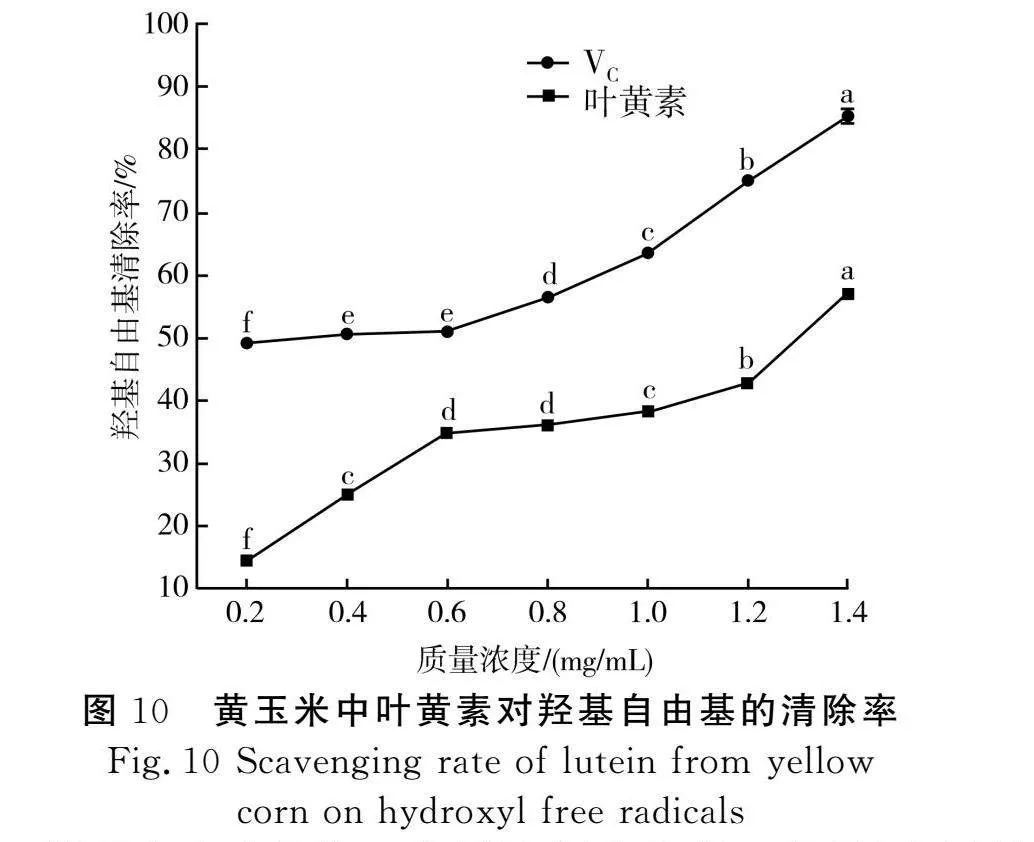
3.4 羟基自由基清除能力
羟基自由基作为一种活性氧自由基,可通过电子转移、脱氢或加成等使核酸、蛋白质和脂质等生物大分子发生氧化损伤,从而导致细胞坏死或突变[34]。由图10可知,质量浓度在0.2~1.4 mg/mL范围内,随着质量浓度的增加,黄玉米中叶黄素的羟基自由基清除率从14.41%增加到57.28%;而VC溶液的羟基自由基清除率从49.06%增加到85.23%,优于黄玉米中叶黄素的清除效果;数据分析得出,VC溶液的IC50值为0.339 mg/mL,黄玉米中叶黄素的IC50值为1.374 mg/mL,表明黄玉米中叶黄素对羟基自由基也具有一定的清除能力。
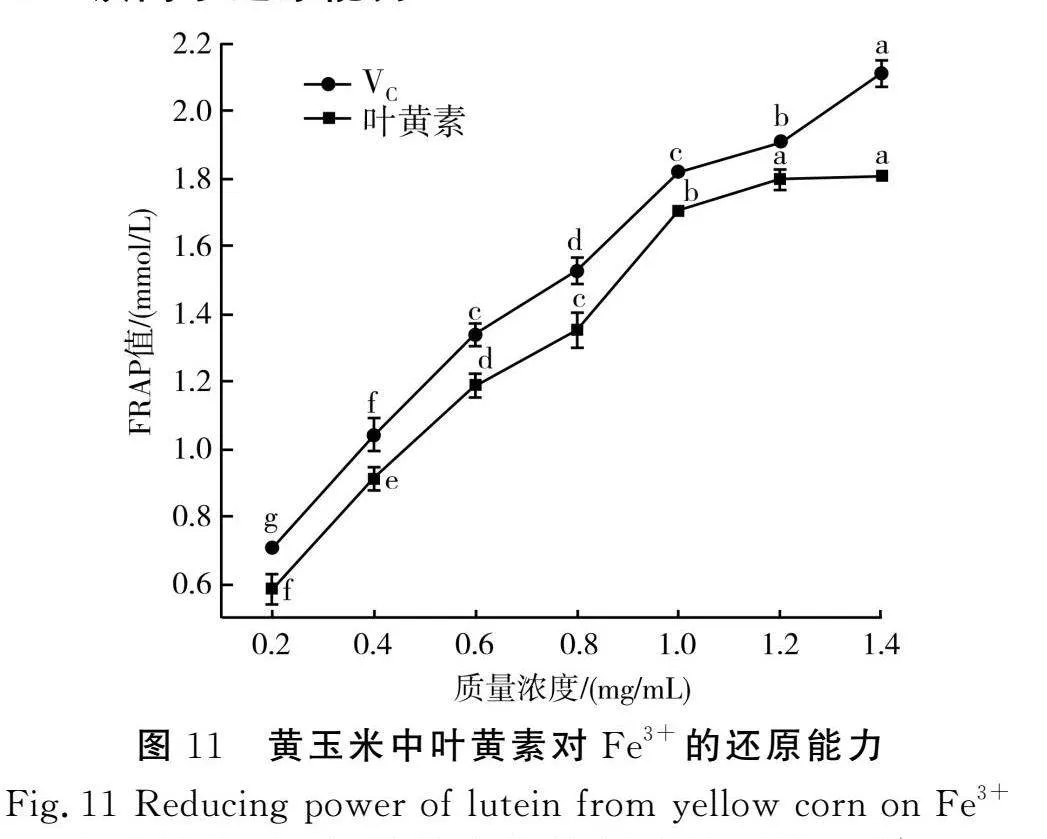
3.5 铁离子还原能力
在酸性条件下,样品中的抗氧化物可将Fe3+-TPTZ还原成Fe2+-TPTZ,使颜色呈现蓝色,在593 nm处表现出强吸收作用。当体系中存在大量Fe3+-TPTZ时,Fe2+-TPTZ的生成量可作为检测样品还原能力的评价指标,即铁离子还原能力(总抗氧化能力),Fe3+还原能力用FRAP值衡量,FRAP值越大,还原能力越强[35]。由图11可知,黄玉米中叶黄素在0.2~1.4 mg/mL范围内呈现不同程度的还原能力,且与浓度呈剂量效应关系。随着质量浓度的增加,还原能力显著上升,当质量浓度增加至1.2 mg/mL时,黄玉米中叶黄素还原能力趋于平缓状态,最大值为1.806 mmol/L;而在相同质量浓度下,VC溶液在1.2 mg/mL后,还原能力呈继续上升趋势(P<0.05),最大值为2.108 mmol/L,总体来看,黄玉米中叶黄素的铁离子还原能力虽低于VC溶液,但同样也具有良好的抗氧化效果。
4 结论
本文通过超声波辅助复合酶法提取黄玉米中的叶黄素,固定木瓜蛋白酶∶纤维素酶∶果胶酶的比例为1∶1∶1,经酶添加量、酶解时间、酶解温度、液料比、超声时间的单因素实验,结合响应面设计,优化黄玉米中叶黄素的提取工艺并探讨其体外抗氧化活性。结果表明,最佳工艺参数为酶添加量3.2%、酶解时间146 min、酶解温度50 ℃、液料比50∶1 (mL/g)、超声时间63 min,该条件下所得叶黄素提取量为(7 639.49±3.73) μg/g,与预测值7 641.64 μg/g接近,表明通过响应面实验优化黄玉米中叶黄素提取工艺准确可行;黄玉米中的叶黄素对DPPH·、ABTS+·、O2-·、·OH均表现出较强的清除能力,IC50值分别为0.022,0.124,1.447,1.374 mg/mL,对铁离子的还原能力较强,浓度为1.4 mg/mL时,FRAP值为1.806 mmol/L,与VC接近。
综上所述,超声波辅助复合酶法能够实现提高叶黄素提取量的目的,同时,叶黄素优良的抗氧化能力为后续的功能性研究提供了数据支撑。下一步将在叶黄素的分离纯化、异构化及构象分析、抗氧化产品开发等方面予以探究。
参考文献:
[1]PRASANNA B M, PALACIOS-ROJAS N, HOSSAIN F, et al.Molecular breeding for nutritionally enriched maize: status and prospects[J].Frontiers in Genetics,2020,10:1392.
[2]HAYASHI R, HAYASHI S, MACHIDA S. Changes in aqueous humor lutein levels of patients with cataracts after a 6-week course of lutein-containing antioxidant supplementation[J].Current Eye Research,2022,47(7):1016-1023.
[3]ZHANG H J, LIU X B, CHEN X M, et al. Lutein delays photoreceptor degeneration in a mouse model of retinitis pigmentosa[J].Neural Regeneration Research,2022,17(7):1596-1603.
[4]WILSON L M, THARMARAJAH S, JIA Y, et al. The effect of lutein/zeaxanthin intake on human macular pigment optical density: a systematic review and meta-analysis[J].Advances in Nutrition,2021,12(6):2244-2254.
[5]LI J, ABDEL-AAL E S M. Dietary lutein and cognitive function in adults: a meta-analysis of randomized controlled trials[J].Molecules,2021,26(19):5794.
[6]NAZARI L, KOMAKI S, SALEHI I, et al. Investigation of the protective effects of lutein on memory and learning using behavioral methods in a male rat model of Alzheimer's disease[J].Journal of Functional Foods,2022,99(3):105319.
[7]GANSUKH E, MYA K K, JUNG M, et al. Lutein derived from marigold (Tagetes erecta) petals triggers ROS generation and activates Bax and caspase-3 mediated apoptosis of human cervical carcinoma (HeLa) cells[J].Food and Chemical Toxicology,2019,127:11-18.
[8]EOM J W, LIM J W, KIM H. Lutein induces reactive oxygen species-mediated apoptosis in gastric cancer AGS cells via NADPH oxidase activation[J].Molecules,2023,28(3):1178.
[9]D'ESTE M, FRANCISCI D D, ANGELIDAKI I. Novel protocol for lutein extraction from microalga Chlorella vulgaris [J].Biochemical Engineering Journal,2017,127:175-179.
[10]JALALI-JIVAN M, ABBASI S, FATHI-ACHACHLOUEI B. Lutein extraction by microemulsion technique:evaluation of stability versus thermal processing and environmental stresses[J].LWT-Food Science and Technology,2021,149(16):111839.
[11]MARY LEEMA J T, PERSIA JOTHY T, DHARANI G. Rapid green microwave assisted extraction of lutein from Chlorella sorokiniana (NIOT-2)-process optimization[J].Food Chemistry,2022,372:131151.
[12]SAINI A, PANESAR P S, BERA M B. Valuation of Citrus reticulata (kinnow) peel for the extraction of lutein using ultrasonication technique[J].Biomass Conversion and Biorefinery,2021,11(5):2157-2165.
[13]ANTONIO M, SANJEET M, ANGELA I, et al. Extraction of astaxanthin and lutein from microalga Haematococcus pluvialis in the red phase using CO2 supercritical fluid extraction technology with ethanol as co-solvent[J].Marine Drugs,2018,16(11):432.
[14]WEN Y, NIU M, ZHANG B J, et al. Structural characteristics and functional properties of rice bran dietary fiber modified by enzymatic and enzyme-micronization treatments[J].LWT-Food Science and Technology,2017,75:344-351.
[15]陈燊,曾红亮,陈万明,等.超声微波协同提取橄榄多糖及其脱蛋白工艺的研究[J].热带作物学报,2015,36(8):1484-1490.
[16]郭磊,高然,田野,等.桦褶孔菌不同溶剂萃取物抗氧化活性研究[J].西部林业科学,2020,49(2):17-23.
[17]胡晓波.鱼腥草多糖的结构表征和抗炎活性研究[D].合肥:合肥工业大学,2021.
[18]王静杰,杜鑫,钟强,等.超声辅助酶法制备海参性腺多糖的结构特性及抗氧化活性[J].食品科学,2021,42(21):97-104.
[19]孟繁玲,张宇,徐少博,等.南瓜中游离叶黄素的制备及抗氧化活性[J].食品与生物技术学报,2020,39(8):81-88.
[20]WANG X Y, LIU X Y, SHI N W, et al. Response surface methodology optimization and HPLC-ESI QTOF-MS/MS analysis on ultrasonic-assisted extraction of phenolic compounds from okra (Abelmoschus esculentus) and their antioxidant activity[J].Food Chemistry,2023,405(4):134966.
[21]万正洋,黄业传,彭春雷,等.分子动力学模拟抗坏血酸对木瓜蛋白酶活性的影响[J].肉类研究,2023,37(1):1-6.
[22]张飞,岳田利,费坚,等.果胶酶活力的测定方法研究[J].西北农业学报,2004(4):134-137.
[23]孙盈,田永强,赵丽坤.纤维素酶的CMC酶活测定条件的研究[J].食品工业科技,2013,34(2):68-71,74.
[24]龙海涛,薛利新,张志霞,等.固定化混合酶提取番茄红素的工艺研究[J].食品工业科技,2014,35(4):189-193.
[25]李彩霞,宋海,焦杨,等.果胶酶提取黑果枸杞花青素的工艺优化[J].食品工业科技,2016,37(7):204-209.
[26]王莹,陈圆,聂倩倩,等.复合酶法辅助提取柚子皮多糖的工艺优化[J].湖南农业科学,2018,392(5):86-88,91.
[27]马萍,郭增旺,张丽媛,等.超声微波协同提取小米糠总黄酮工艺及其抗炎活性研究[J].天然产物研究与开发,2017,29(11):1966-1975,1876.
[28]YUE T, SHAO D, YUAN Y, et al. Ultrasound-assisted extraction, HPLC analysis, and antioxidant activity of polyphenols from unripe apple[J].Journal of Separation Science,2015,35(16):2138-2145.
[29]ZHANG X L, ZHANG X J, GU S S, et al. Structure analysis and antioxidant activity of polysaccharide-iron(Ⅲ) from Cordyceps militaris mycelia[J].International Journal of Biological Macromolecules,2021,179(1):170-179.
[30]朱和权,冯进,李春阳,等.响应面法优化白首乌多糖超声辅助提取工艺及其结构表征[J].食品工业科技,2021,42(10):153-159.
[31]董梦依.几种黄酮类化合物抗氧化、抗肿瘤活性研究及构效关系初探[D].南昌:南昌大学,2019.
[32]李亚军,易鹊,杨军衡,等.黑老虎花总黄酮超声辅助提取工艺优化及其抗氧化性研究[J].食品工业科技,2021,42(13):179-183.
[33]TAO H X, ZHOU J G, WU T, et al. High-throughput superoxide anion radical scavenging capacity assay[J].Journal of Agricultural and Food Chemistry,2014,62(38):9266-9272.
[34]张昊,任发政.羟基和超氧自由基的检测研究进展[J].光谱学与光谱分析,2009,29(4):1093-1099.
[35]李生茂,李倩茹,周春阳,等.益智总黄酮超声辅助提取工艺的响应面法优化及其抗氧化活性评价[J].保鲜与加工,2021,21(8):43-49.

