DTAB反胶束萃取花椒籽中蛋白质和油脂研究
摘要:利用十二烷基三甲基溴化铵(dodecyl trimethyl ammonium bromide,DTAB)-异辛烷-正己醇反胶束体系,对花椒籽中的蛋白质和油脂同步萃取进行了探究。结果表明,前萃过程油脂直接溶解于有机相中,蛋白质增溶于反胶束极性核中,蛋白质的前萃率受DTAB浓度、萃取时间、缓冲溶液pH值、氯化钠浓度、料液比的影响。随后,反胶束溶液通过加入等体积含有一定离子强度和pH值的水相构筑Winsor Ⅱ微乳体系来实现蛋白质转移。其蛋白质后萃率和油脂萃取率受后萃水相的酸度和离子强度等因素的影响。
关键词:反胶束;花椒籽;十二烷基三甲基溴化铵(DTAB);萃取;蛋白质和油脂
中图分类号:TS201.1""""" 文献标志码:A"""" 文章编号:1000-9973(2024)11-0071-04
Research on Extraction of Protein and Oil from Zanthoxylum bungeanum
Maxim. Seed by DTAB Reverse Micelle
ZHENG Yong-jun1,2, WANG Jian-guang1,2, ZHENG Yong1, LUO Feng1
(1.College of Chemical and Environmental Engineering, Anyang Institute of Technology,
Anyang 455000, China; 2.Henan Key Laboratory of Subcritical High-efficiency
Extraction, Anyang 455000, China)
Abstract: By using dodecyl trimethyl ammonium bromide (DTAB)-isooctane-n-hexanol reverse micelle system, the simultaneous extraction of protein and oil from Zanthoxylum bungeanum Maxim. seed is investigated. The results show that in the pre-extraction process, the oil is directly dissolved in the organic phase, while the protein is solubilized in the polar nucleus of the reverse micelle. The pre-extraction rate of protein is affected by the concentration of DTAB, extraction time, pH value of the buffer solution, the concentration of sodium chloride and solid-liquid ratio. Subsequently, the reverse micelle solution is used to construct Winsor Ⅱ microemulsion system by adding an equal volume of aqueous phase containing a certain ionic strength and pH value to achieve protein transfer. The post-extraction rate of protein and the extraction rate of oil are influenced by the acidity and ionic strength of the aqueous phase.
Key words: reverse micelle; Zanthoxylum bungeanum Maxim. seed; dodecyl trimethyl ammonium bromide (DTAB); extraction; protein and oil
收稿日期:2024-05-20
基金项目:安阳工学院科研项目培育基金(YPY2021012);河南省高等学校重点科研项目(22B530001);安阳市科技攻关项目(2022C01NY002)
作者简介:郑永军(1966—),男,教授,博士,研究方向:油料作物的提取。
花椒是太行山区的主要经济作物之一,是一种重要的原始调味品,而花椒籽是花椒调味品的主要副产物,常被当作废弃物来处理。然而,花椒籽中含有油脂25%~30%,其中不饱和脂肪酸含量占90%,人体必需但又不能自身合成的脂肪酸占45%以上,且粗蛋白含量在14%~31%之间[1]。因此,采用先进的萃取技术提取花椒籽中油脂和蛋白质对花椒籽的深加工具有一定指导意义。
反胶束微乳液是表面活性剂在油水界面上自发形成的非极性基团向外与连续的油相接触,极性基团排列在内与水构成“水池”热力学稳定的、均一透明的纳米聚集体(W/O微乳液)[2]。当反胶束微乳液与粉碎后的花椒籽接触时,花椒籽中所含油脂等疏水性物质直接溶解于连续的有机相中,其所含的蛋白质等亲水性物质则增溶于“水池”中(此过程称为前萃)[3],再将含有蛋白质和油脂的反胶束有机相与一定盐度缓冲液的水相混合,蛋白质通过超声或振荡从反胶束极性核中转移到一定盐度缓冲液的水相中,最终从含有一定盐度缓冲液的水相中得到蛋白质,从有机相中得到油脂(此过程称为后萃)[4]。该反胶束萃取技术因萃取的蛋白质可保持原有的生物活性且所用溶剂可以回收利用,可实现蛋白质与油脂的同时分离,日益受到业内学者的关注[5]。已有利用反胶束萃取技术以花生粕[6]、葵花粕[4]、大豆粕[7]、玉米胚芽[8]、小麦胚芽[9]、葡萄籽[10]为原料对其中的蛋白质和油脂进行提取的报道。但对于花椒籽进行植物蛋白和油脂的提取还未见报道,本文利用反胶束分散体系对花椒籽中的蛋白质和油脂进行萃取探究,讨论在超声辅助下表面活性剂、花椒籽与反胶束溶液的料液比、氯化钠浓度、缓冲溶液pH值、萃取时间等因素对萃取率的影响,实现对花椒籽中蛋白质和油脂的同步萃取,并优化萃取条件,从而为花椒籽的深加工提供试验支持。
1 材料与方法
1.1 主要材料
花椒籽:河南安阳本地市售;十二烷基三甲基溴化铵(DTAB):天津市光复精细化工研究所;异辛烷(AR):天津市富宇精细化工有限公司;正己醇(AR):天津市大茂化学试剂厂。
1.2 主要仪器
KQ3200DE型数控超声波清洗器 昆山市超声仪器有限公司;UV2600型紫外可见分光光度计 日本岛津公司;800B型低速台式离心机 上海安亭科学仪器厂;PHS-3型精密pH计 上海雷磁仪器厂;RV8型旋转蒸发仪 德国IKA公司;ME204E型电子天平 瑞士梅特勒-托利多公司。
1.3 试验方法
1.3.1 DTAB反胶束溶液的配制
称取一定量的DTAB,置于150 mL锥形瓶中,加入20 mL异辛烷-正己醇(体积比为4∶1),并加入一定浓度NaCl的缓冲液(Na2HPO4-KH2PO4,调节pH值)至饱和,超声振荡至DTAB完全溶解,溶液透明后,于室温下存放备用[4]。
1.3.2 前萃试验
称取一定量的花椒籽粉末,置于150 mL锥形瓶中,然后加入一定量的反胶束微乳液,在温度35 ℃、超声功率150 W的条件下超声50 min。将混合物放入离心机中,以2 300 r/min的转速离心20 min,取上清液,采用紫外可见分光光度计于280 nm和 260 nm波长处分别测定吸光度(以萃取前反胶束溶液做空白对照),平行测定3次后取平均值代入公式(1)中,根据公式(1)计算上清液中蛋白质浓度,由此根据公式(2)得出花椒籽蛋白质的前萃率。
蛋白质浓度(mg/mL)=1.45×A280 nm-0.74×A260 nm[11]。(1)
式中:A280 nm和A260 nm分别为蛋白质溶液在280 nm和260 nm处测得的吸光度。
蛋白质前萃率(S,%)=反胶束溶液中蛋白质质量(g)/试样质量(g)×试样中蛋白质含量(%)×100%。(2)
1.3.3 后萃试验
在前萃试验的上层有机相中加入等体积的一定浓度NaCl缓冲液(Na2HPO4-KH2PO4,调节pH值)。在温度35 ℃、超声功率150 W的条件下超声振荡,然后以2 300 r/min的转速离心20 min,经分液漏斗分液。然后取下层水相,在波长280 nm和260 nm处分别测定其吸光度(以所加缓冲液做空白对照),平行测定3次后取平均值代入公式(1)中,根据公式(1)计算出水相中蛋白质的浓度,求出花椒籽蛋白质的后萃率。
蛋白质后萃率(R,%)=水相中蛋白质质量(g)/反胶束溶液中蛋白质质量(g)×100%[4]。(3)
1.3.4 油脂含量的测定
将经分液漏斗分液的上层有机相先经过旋转蒸发仪减压蒸发回收溶剂异辛烷,再在余液中加入2倍体积的70%乙醇,在超声波辅助技术下萃取5 min,然后加入与乙醇等体积的2 mol/L氯化钠溶液,在超声波辅助技术下萃取5 min,静置分层后,取上清液在减压蒸发回收乙醇和正己醇后得花椒籽油。用分析天平称重后计算油脂萃取率。
油脂萃取率(%)=有机相中油脂的质量(g)/萃取所用材料中油脂的质量(g)×100%[12]。(4)
1.3.5 花椒籽成分测定方法
花椒籽中蛋白质含量按文献[13]前处理后利用紫外分光光度法测定,油脂按GB 5009.6—2016中索氏提取法测定,水分按GB 5009.3—2016中直接干燥法测定。
2 结果与讨论
2.1 花椒籽成分
去除花椒籽中的杂质,将花椒籽粉碎,过20目筛,测得花椒籽油脂含量为21.45%,粗蛋白含量为14.12%,水分含量为9.67%,其余为不溶性纤维。将粉碎过筛的花椒籽粉末在80 ℃的真空干燥箱中烘干6 h,保存备用,作为后续试验的原料。
2.2 前萃试验因素对蛋白质前萃率和油脂萃取率的影响
2.2.1 反胶束DTAB浓度
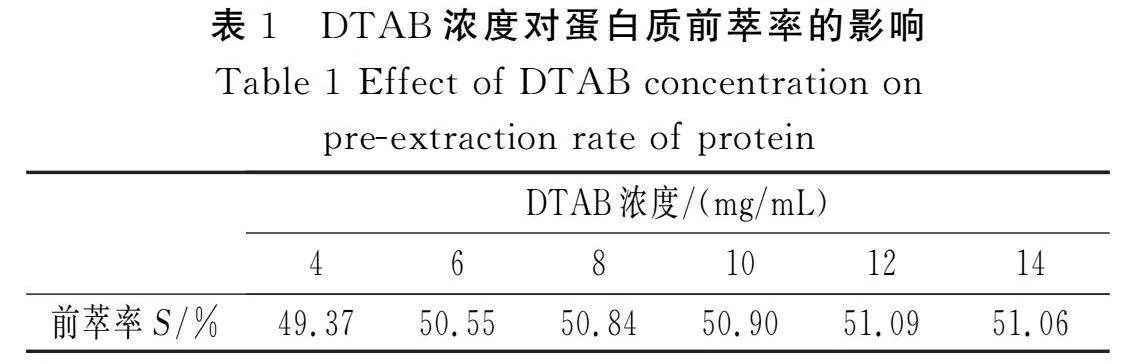
固定pH值为6,氯化钠缓冲液浓度为0.1 mol/L,花椒籽粉末与反胶束溶液的比例为1∶20 (g/mL),考察不同反胶束DTAB浓度对蛋白质前萃率的影响,结果见表1。
由表1可知,蛋白质的前萃率随着DTAB浓度的增加而逐渐增加。当DTAB浓度达到12 mg/mL时,前萃率达到最大值,这是由于在异辛烷非极性有机溶剂中,随着DTAB浓度的增加,单位体积内DTAB所形成的反胶束数量增多,萃取的蛋白质也会增加,而且DTAB浓度的增加会使体系的极性增加,反胶束与蛋白质分子间的作用力增强,有利于蛋白质的萃取。但DTAB浓度增加到一定程度会使体系的黏稠度增加,从而影响蛋白质的萃取[14]。由于DTAB在非极性的异辛烷中存在超低的界面张力而使油脂从花椒籽中释放出来,又因油脂与异辛烷的非极性相似,而全部溶解于足量的有机相中[7]。
2.2.2 超声振荡时间
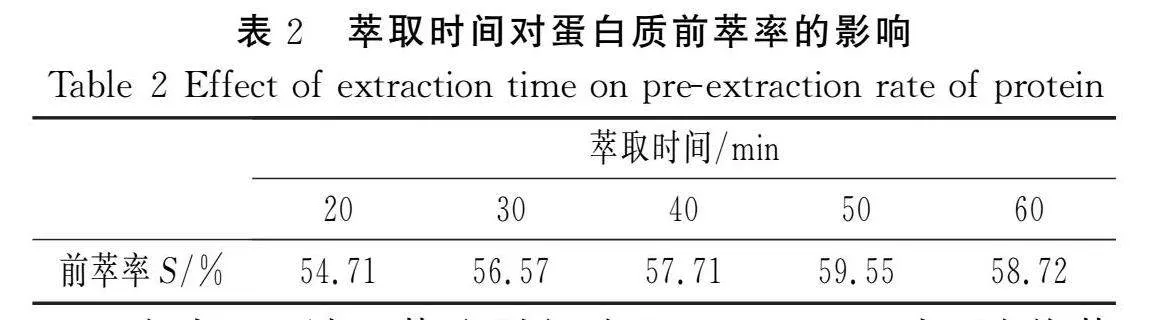
固定DTAB浓度为12 mg/mL,花椒籽粉末与反胶束溶液的比例为1∶20 (g/mL),pH值为6,氯化钠缓冲液浓度为0.1 mol/L,考察不同超声振荡时间对蛋白质前萃率的影响,结果见表2。
由表2可知,萃取时间在20~50 min内,随着萃取时间的增加,花椒籽蛋白质从原料表面迁移至反胶束“水池”中的量不断增多,因而萃取率不断增加,由于花椒籽中的油脂和其蛋白质一样,也是从花椒籽原料表面逐渐迁移到连续的有机相中,所以,随着萃取时间的增加,萃取出来的油脂也将不断增加。由于随着萃取时间的增加,原料中的蛋白质和油脂逐渐减少,蛋白质和油脂向原料表面迁移的速率也减少,而反胶束“水池”中蛋白质浓度增加和异辛烷中的油脂量增多,导致其传质推动力减小,当萃取时间达到50 min时,花椒籽与反胶束微乳液萃取基本达到平衡[7],萃取率最大。但在50 min以后,蛋白质的萃取率开始下降,这可能是因为随着萃取时间继续增加,反胶束由于离子强度等因素的影响而发生了渗滤现象,使反胶束结构被破坏,导致蛋白质提取率下降,故选取萃取时间为50 min进行后续试验。
2.2.3 pH值
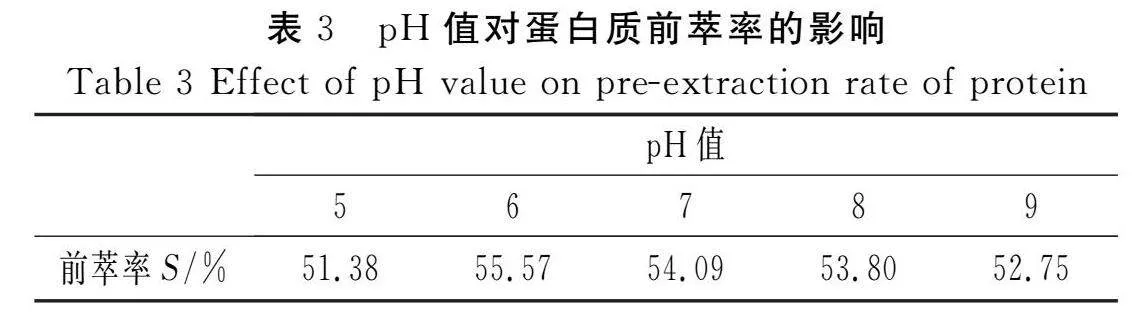
由于DTAB的浓度为6 mg/mL与12 mg/mL时对蛋白质前萃率的影响较小,且DTAB浓度较大时,分离的油脂会有附着一定量的表面活性剂,为了减少表面活性剂对油脂提纯纯度的影响,故固定DTAB浓度为6 mg/mL进行试验,花椒籽粉末与反胶束溶液的比例为1∶20 (g/mL),氯化钠溶液浓度为0.1 mol/L,放入超声清洗机中超声50 min后,将混合物放入离心机中以2 300 r/min离心20 min,取上清液,分别测定在波长为280 nm和260 nm处的吸光度值,考察不同pH值对蛋白质前萃率的影响,结果见表3。
由表3可知,蛋白质的前萃率随着缓冲液pH值的增加呈现先增大后减小的趋势,当pH值为6时,蛋白质的前萃率最大。由于DTAB是阳离子表面活性剂,在其构成反胶束时,表面活性剂极性端和蛋白质所带电荷间的静电作用是蛋白质进入反胶束极性核的主要推动力[9]。当“水池”中的pH值高于花椒籽蛋白质的等电点时,蛋白质所带电荷与阳离子表面活性剂的极性端所带电荷的静电引力使蛋白质进入反胶束的极性核中。当pH值为9时,在界面上出现絮状物,发生蛋白质变性,导致前萃率下降[15]。花椒籽中的油脂由于溶解于连续相的异辛烷中,故不会因极性核中pH值的改变而变化,所以,选定缓冲液的pH值为6进行后续试验。
2.2.4 氯化钠浓度
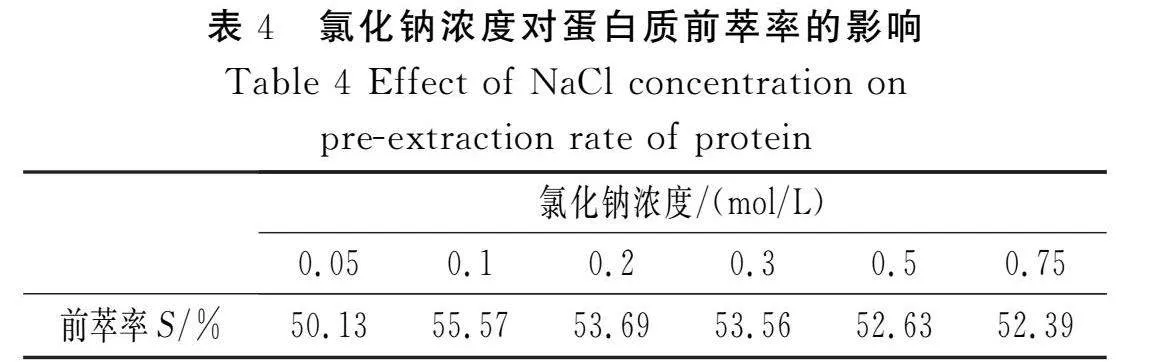
固定DTAB浓度为6 mg/mL,花椒籽粉末与反胶束溶液的比例为1∶20 (g/mL),缓冲液pH值为6,考察不同浓度的氯化钠对蛋白质前萃率的影响,结果见表4。
由表4可知,花椒籽蛋白质的前萃率受氯化钠浓度的影响显著,花椒籽蛋白质的前萃率大致随盐浓度的增大先增大后减小,这是因为在缓冲液中盐浓度影响反胶束“水池”的粒径大小,同时影响蛋白质和反胶束之间的静电作用[6]。较低浓度的氯化钠能增加反胶束“水池”的极性,促进蛋白质进入“水池”中,提高体系增溶蛋白质的量,进而提高蛋白质的萃取率。除此之外,水与盐离子的作用增强,减弱表面活性剂分子与水的相互作用力,促进表面活性剂与异辛烷的反胶束形成,有利于蛋白质的萃取[16]。因此,0.1 mol/L的氯化钠是蛋白质前萃率的最佳浓度。而当氯化钠浓度过高时,一是过量的离子在反胶束极性核周围形成静电层,从而减少带电蛋白质与反胶束极性核之间的静电吸引;二是由于较高浓度的氯化钠存在,使进入“水池”的蛋白质发生盐析,导致蛋白质萃取率下降。
2.2.5 料液比
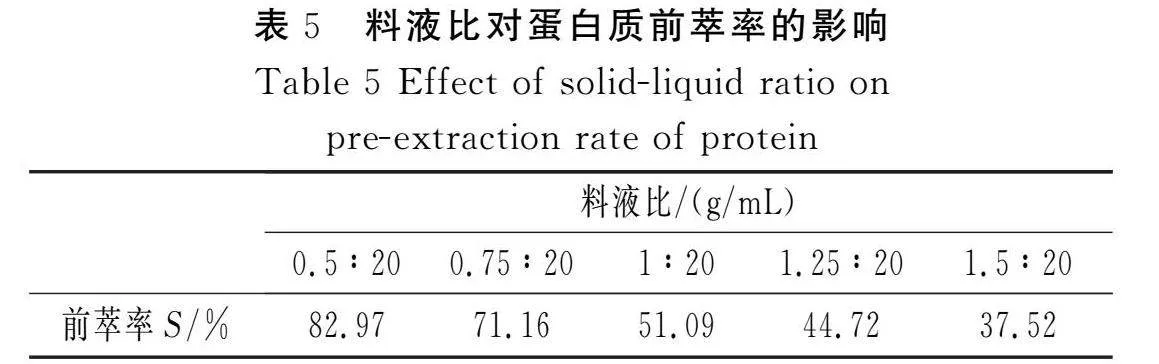
固定DTAB浓度为12 mg/mL、pH值为6、氯化钠浓度为0.1 mol/L,考察不同花椒籽粉末与反胶束体系的比例对蛋白质前萃率的影响,结果见表5。
由表5可知,蛋白质前萃率随着花椒籽粉末加入量的增加而降低,可能是由于对一定体积的反胶束体系来说,其“水池”的聚集数是一定的,增溶蛋白质的能力也是有限的,随着花椒籽粉末加入量的增加,相同体积、相同反胶束体系增溶蛋白质的能力反而减小,蛋白质进入反胶束“水池”内核产生了竞争机制,因而蛋白质的前萃率逐渐降低。综合考虑蛋白质前萃率和蛋白质产量,为了保证前萃率较高且有较大的产量,选取料液比1∶20较适宜,此时,对于油脂萃取,较低的料液比也可以使花椒籽与反胶束体系充分接触,将油脂充分萃取出来,完全溶解于连续相的异辛烷中[17]。
2.3 后萃试验因素对蛋白质后萃率和油脂萃取率的影响
2.3.1 氯化钠浓度
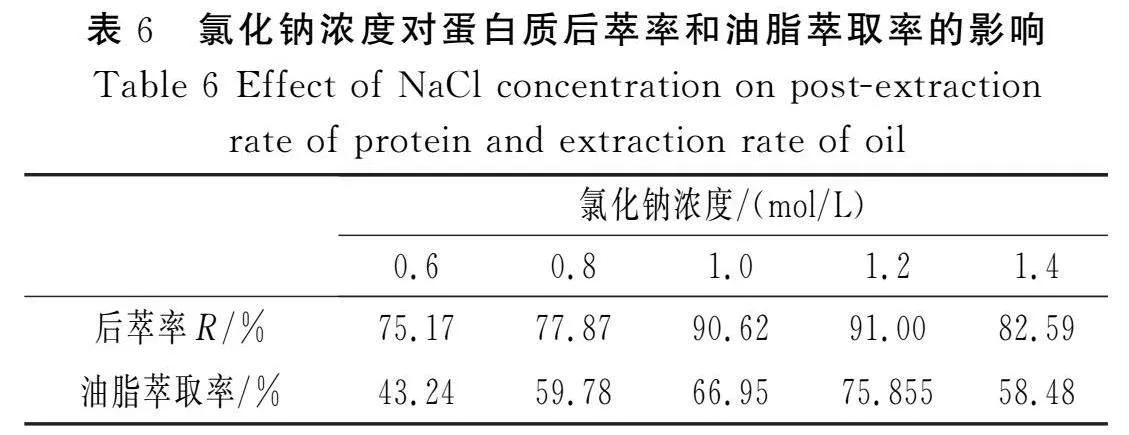
向pH值为6、氯化钠浓度为0.1 mol/L前萃试验的上清液中加入等体积、pH值为8、不同浓度的氯化钠缓冲液进行充分接触,超声振荡50 min,离心20 min。提取下层水相,对其后萃蛋白质进行测定,上层油相经处理后得萃取油脂,用分析天平称其质量,结果见表6。
由表6可知,蛋白质的后萃率随着氯化钠浓度的增加先升高后降低,当氯化钠浓度为1.2 mol/L时,蛋白质的后萃率达到最大值,这是由于氯化钠浓度的增大减少了表面活性剂极性端之间的斥力,使反胶束增溶量减少,蛋白质随着反胶束容量的减少而逐渐溶出,同时,由于蛋白质不断溶出到后萃水相体系中,致使反胶束“水池”中与水相中蛋白质形成浓度差,不断促进蛋白质后萃取到水相中,因此,在氯化钠浓度未达到1.2 mol/L时,蛋白质的后萃率逐渐增大。但当氯化钠浓度过高时,由于盐析作用使蛋白质后萃率减小。油脂的萃取率随着氯化钠浓度的增加先升高后降低,当氯化钠浓度为1.2 mol/L时,油脂萃取率达到最大值。后萃试验实际上是反胶束微乳液加入等体积的水相后构成的Winsor Ⅱ型微乳体系,少量的氯化钠电解质有利于含有油脂的有机相与水相的分层,此时获得的油脂最多,但过量的电解质使该体系转变成水包油胶束的水相与含油脂的有机相构成的Winsor Ⅰ型微乳体系,造成油脂不能充分分离,从而使油脂的萃取率下降[18]。由表6可知,氯化钠浓度为1.2 mol/L时可以同时获得较高的蛋白质后萃率和油脂萃取率。
2.3.2 缓冲液pH值对蛋白质后萃率和油脂萃取率的影响
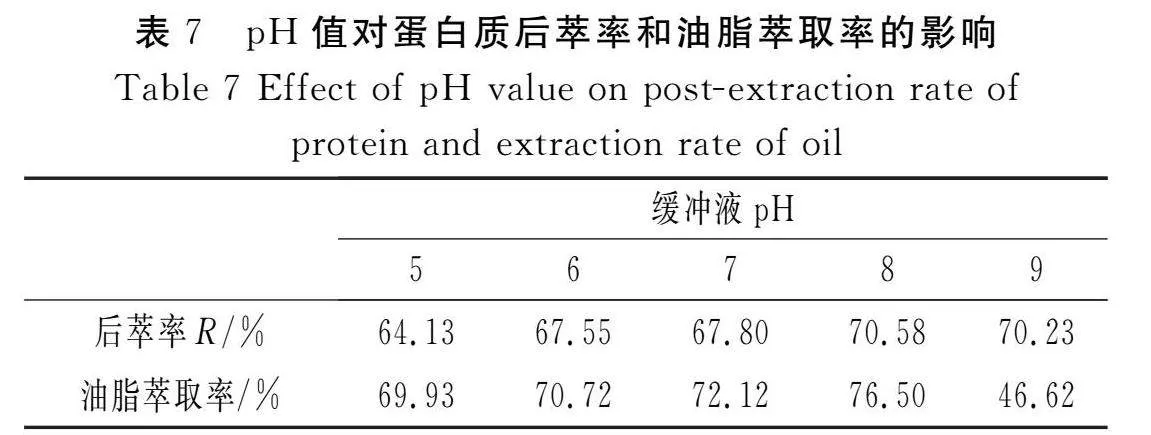
向DTAB为6 mg/mL、pH值为6、氯化钠浓度为0.1 mol/L的上清液中加入等体积、不同pH值的1.0 mol/L的氯化钠缓冲液,超声振荡50 min,离心20 min。提取下层水相,对其后萃蛋白质进行测定,上层油相经处理后得萃取油脂,用分析天平称其质量,结果见表7。
由表7可知,随着缓冲液pH值的增加,蛋白质的后萃率和油脂的萃取率也随之增加,当pH值为8时,蛋白质的后萃率和油脂的萃取率最大,这是因为pH值的增加使蛋白质表面所带负电荷量增加,蛋白质所带的负电荷与反胶束表面活性剂所带的负电荷静电斥力增加,蛋白质在反胶束“水池”的增溶性降低,从而使蛋白质增溶到水相中[19],蛋白质后萃率随之增加。但当pH值过高时,在两相界面形成絮状物,导致蛋白质降解,使其后萃率下降,同时,由于油脂部分皂化造成油脂在水相中乳化而分离困难,从而使油脂的萃取率下降[3]。
3 结论
利用DTAB(十二烷基三甲基溴化铵)-正己醇-异辛烷反胶束体系对花椒籽蛋白质和油脂进行萃取,发现反胶束溶液与一定浓度和酸度的水相构筑Winsor Ⅱ微乳体系来达到蛋白质转移,说明蛋白质与油脂的同步萃取是可行的。
通过试验可知前萃较优条件:DTAB浓度为6 mg/mL,花椒籽与反胶束溶液的料液比为1∶20(g/mL),氯化钠浓度为0.1 mol/L,缓冲溶液pH值为6,萃取时间为50 min,后萃试验条件为缓冲溶液pH值8、水相的氯化钠浓度1.2 mol/L,可以获得较高的蛋白质后萃率和油脂萃取率。然而,由于配制的饱和反胶束体系存在人为误差,萃取油脂中附着一定的表面活性剂,致使试验结果存在一定的偏差,所以,进一步配制准确的反胶束体系,去除萃取油脂附着的表面活性剂以及对前萃和后萃的最佳条件进一步优化,将是进一步研究的方向。
参考文献:
[1]于豪杰,吕斌杰,秦召,等.花椒籽仁油及其脱脂粕中氨基酸的分析[J].食品科技,2019,44(12):233-240.
[2]ABBASI S, SCANLON M G. Microemulsion: a novel alternative technique for edible oil extraction—a mechanistic viewpoint[J].Critical Reviews in Food Science and Nutrition,2022,63(30):10461-10482.
[3]SUN X H, BANDARA N.Applications of reverse micelles technique in food science: a comprehensive review[J].Trends in Food Science amp; Technology,2019,91:106-115.
[4]赵萍,佐玲,郭求实,等.SDS/正辛醇/异辛烷反胶束体系萃取葵花籽粕蛋白工艺研究[J].食品工业科技,2015,36(8):262-267.
[5]BU G H, YANG Y Y, CHEN F S, et al. Extraction and physicochemical properties of soyabean protein and oil by a new reverse micelle system compared with other extraction methods[J].International Journal of Food Science amp; Technology,2014,49(4):1079-1089.
[6]WANG L M, LIU K L, CHEN F S, et al.Size changes of reverse micelles after extraction of peanut protein and their forward extraction rates[J].Grain amp; Oil Science and Technology,2019,1(1):32-39.
[7]ZHANG L F, CHEN F S, ZHANG W, et al. Kinetics and characteristics of soybean oil and protein extracted by AOT reverse micelle technology[J].Journal of Chemistry,2018(2):1-11.
[8]李飞,朱科学,周惠明,等.反胶束法同时提取玉米胚芽中蛋白质和油脂的前萃工艺研究[J].中国油脂,2009,34(11):27-30.
[9]SUN X H, ZHU K X, ZHOU H M. Protein extraction from defatted wheat germ by reverse micelles:optimization of the forward extraction[J].Journal of Cereal Science,2008,48(3):829-835.
[10]ZHANG X F, HOU Y Y, ZHANG F Q, et al. Protein extraction from grape seeds by reverse micelles: optimization of the forward extraction[J].Open Access Library Journal,2017,4(6):1-12.
[11]童湘伟,易延逵,邓虹珠,等.UV法测定哈蟆油中蛋白质的含量[J].湖南中医杂志,2011,27(4):128-129.
[12]赵俊廷.反胶束溶液同时萃取油和蛋白质的工艺研究[J].郑州工业大学学报,2001,22(2):54-56.
[13]曹艳,黄必胜.半夏总蛋白含量的紫外吸收法测定[J].湖北中医杂志,2005,27(7):48.
[14]张倩,陈复生,孙倩.反胶束的微结构与前萃率相互关系的研究[J].食品研究与开发,2018,39(1):4-10.
[15]丁欣.季铵盐表面活性剂反胶束液液萃取蛋白质的效能研究[D].扬州:扬州大学,2021.
[16]郑永军,王振,郑勇,等.紫苏油微乳的制备与表征[J].河南工业大学学报(自然科学版),2019,40(4):41-45.
[17]NGUYEN T, DO L, SABATINI D A. Biodiesel production via peanut oil extraction using diesel-based reverse-micellar microemulsions[J].Fuel,2010,89(9):2285-2291.
[18]赵振国.胶束催化与微乳催化[M].北京:化学工业出版社,2006:234-239.
[19]WANG N N, WANG J R, LI Y, et al. Reverse microemulsion prepared by AOT/CTAB/SDS/Tween 80 for extraction of tea residues protein[J].Journal of Molecular Liquids,2020,320:114474.

