甘蔗多酚的提取条件优化及其抗氧化活性研究


摘要:以甘蔗糖蜜为原料通过大孔树脂吸附法提取甘蔗多酚。以多酚提取量为指标,在单因素试验的基础上,运用响应面法优化提取工艺,并研究提取得到的甘蔗多酚的抗氧化活性。响应面试验结果表明,最优提取工艺为pH值3.5、乙醇浓度50%、洗脱流速2.50 mL/min,在此条件下甘蔗多酚的提取量为(33.48±0.24) mg/g,与预测值的相对误差为2.04%。此外,ABTS和DPPH自由基清除率随着甘蔗多酚质量浓度的增加而上升,IC50值分别为824 μg/mL和2.51 mg/mL,1 mg/mL甘蔗多酚可还原2.88 μmol铁离子当量。试验结果表明甘蔗多酚具有较好的抗氧化活性,是一种天然抗氧化剂。该研究结果为甘蔗糖蜜的高值化利用和甘蔗多酚的开发利用提供了参考。
关键词:甘蔗多酚;提取;响应面分析法;抗氧化活性
中图分类号:TS201.2""""" 文献标志码:A"""" 文章编号:1000-9973(2024)11-0001-06
Optimization of Extraction Conditions and Antioxidant Activity
of Sugarcane Polyphenols
ZHAO Jian-wen, CUI Chun, XIONG Jian
(School of Food Science and Engineering, South China University of
Technology, Guangzhou 510640, China)
Abstract: Sugarcane polyphenols are extracted from sugarcane molasses by macroporous resin adsorption method. Using the extraction amount of polyphenols as the index, on the basis of single factor test, response surface method is used to optimize the extraction process, and the antioxidant activity of the extracted sugarcane polyphenols is studied.Response surface test results show that the optimal extraction process is pH value of 3.5, ethanol concentration of 50% and elution velocity of 2.50 mL/min. Under these conditions, the extraction amount of sugarcane polyphenols is (33.48±0.24) mg/g, and the relative error with the predicted value is 2.04%. In addition, the scavenging rates of ABTS and DPPH free radicals increase with the increase of the mass concentration of sugarcane polyphenols, and the IC50 values are 824 μg/mL and 2.51 mg/mL respectively.1 mg/mL sugarcane polyphenols could reduce 2.88 μmol iron ion equivalent. The test results show that sugarcane polyphenols have good antioxidant activity and they are a kind of natural antioxidant. The research results have provided references for the high-value utilization of sugarcane molasses and the development and utilization of sugarcane polyphenols.
Key words: sugarcane polyphenols; extraction; response surface analysis method; antioxidant activity
收稿日期:2024-04-08
基金项目:高等学校学科创新引智计划(B17018);水产品绿色加工与流通技术推广与示范(B4220530)
作者简介:赵键文(1999—),男,硕士,研究方向:食品生物技术。
*通信作者:崔春(1978—),男,教授,博士,研究方向:食品生物技术;
熊犍(1965—),男,教授,博士,研究方向:食品科学与工程。
甘蔗糖蜜,又称桔水,是一种深棕色黏稠状液体。糖蜜成分十分复杂,糖是其主要成分,约占糖蜜重量的50%。除此之外,糖蜜中还富含多酚、有机酸、无机盐、氨基酸、色素等[1]。甘蔗中多酚类化合物包括酚酸类(没食子酸、咖啡酸、阿魏酸和绿原酸等)、黄酮类(芹菜素、槲皮素、儿茶素和小麦黄酮等)、木质素、芪类和单宁类[2-3]。糖蜜来源丰富、价格低廉,但自身开发难度大,目前多用作动物饲料、建材填料、微生物发酵原料或用于回收糖分,经济价值低。
甘蔗多酚类物质主要从甘蔗皮、甘蔗叶或甘蔗渣中提取[4],回收利用甘蔗糖蜜中多酚类化合物的研究并不多。常用的提取方法有溶剂萃取法、超声波辅助提取法、微波辅助提取法、大孔树脂吸附法等[4]。大孔树脂吸附法具有工艺简单、能耗少、绿色高效等优点,因此在天然产物工业化分离中应用广泛。多酚类化合物具有抗氧化[5-11]、降血糖[12-17]、抗菌[18]和抗癌[19-22]等多种生理活性。研究发现甘蔗多酚是天然、抗氧化活性高的抗氧化剂,提取物的抗氧化能力与其多酚、黄酮含量息息相关。甘蔗糖蜜因蒸发浓缩效应,其酚类和黄酮类化合物含量比甘蔗汁更高,被认为是提取天然抗氧化剂的优质原料[7]。
本文以甘蔗糖蜜为原料,采用大孔树脂吸附法,以乙醇-水溶液为洗脱剂提取多酚。试验中以多酚提取量为指标,采取单因素试验结合响应面分析法探究其最佳提取工艺条件,并测定所提取多酚的抗氧化活性。本文旨在为甘蔗糖蜜的高值化利用和甘蔗多酚的提取提供参考和借鉴。
1 材料和方法
1.1 材料与试剂
甘蔗糖蜜:广西贵糖集团股份有限公司;ADS-600树脂:科海思(北京)科技有限公司;福林酚、1,1-二苯基-2-三硝基苯肼(DPPH):上海麦克林生化科技有限公司;维生素C:美国Sigma公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS):上海源叶生物科技有限公司;以上试剂均为分析纯。
1.2 仪器与设备
GL21M型高速冷冻离心机 长沙湘智离心机仪器有限公司;RE-52A型旋转蒸发仪 上海亚荣生化仪器厂;THZ-C型恒温培养箱 太仓市华美生化仪器厂;HL-2型恒流泵、XW-80A型旋涡混合器 上海精科实业有限公司;SuperMax 3100型多功能酶标仪 上海闪谱生物科技有限公司;PHS-3E型pH计 上海仪电科学仪器股份有限公司;ME204E型电子分析天平 梅特勒-托利多仪器(上海)有限公司;UV-765型紫外可见分光光度计 上海佑科仪器仪表有限公司;Scientz-18N型冷冻干燥机 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 总多酚含量的测定
总多酚含量的测定按照国家卫生健康委员会《关于莱茵衣藻等36种“三新食品”的公告》(2022年第2号)附录A规定的方法进行。
1.3.2 大孔吸附树脂提取甘蔗多酚
甘蔗多酚的提取方法参考李晶博[23]的方法。经过澄清处理的甘蔗糖蜜溶液通过大孔树脂进行吸附,采用超纯水洗涤树脂至流出液清澈透明,利用一定体积分数的乙醇溶液作为洗脱剂将糖蜜中的多酚洗脱;将洗脱液定容或浓缩冻干后测定多酚含量。
1.3.3 多酚提取单因素试验
1.3.3.1 不同乙醇浓度对多酚提取量的影响
称取5份ADS-600树脂置于锥形瓶中,加入甘蔗糖蜜稀释液10 mL,于37 ℃恒温振荡6 h;过滤取树脂,用一定量蒸馏水冲洗树脂,加入100 mL 40%、50%、60%、70%、80%乙醇进行洗脱,37 ℃恒温振荡6 h。将获得的洗脱液定容后,测定溶液中的多酚浓度,计算多酚提取量。
1.3.3.2 不同pH值对多酚提取量的影响
称取5份ADS-600树脂置于锥形瓶中,加入甘蔗糖蜜稀释液10 mL,用HCl溶液和NaOH溶液调节各溶液的pH值分别为2,3,4,5,6,于37 ℃恒温振荡6 h;过滤取树脂,用一定量蒸馏水冲洗树脂,加入100 mL 50%乙醇进行洗脱,于37 ℃恒温振荡6 h。将获得的洗脱液定容后,测定溶液中多酚浓度,计算多酚提取量。
1.3.3.3 不同稀释倍数对多酚提取量的影响
称取5份ADS-600树脂置于锥形瓶中,分别加入稀释倍数为2.5,5,7.5,10,12.5的甘蔗糖蜜稀释液,于37 ℃恒温振荡6 h;过滤取树脂,用一定量蒸馏水冲洗树脂,加入100 mL 50%乙醇进行洗脱,于37 ℃恒温振荡6 h。将获得的洗脱液定容后,测定溶液中多酚浓度,计算多酚提取量。
1.3.3.4 不同洗脱流速对多酚提取量的影响
称取5份ADS-600树脂填充于层析柱中,取一定量糖蜜稀释液湿法上样,进行柱层析分离,用一定量蒸馏水冲洗树脂,使用100 mL 50%乙醇分别以1,2,3,4,5 mL/min的流速进行洗脱。将获得的洗脱液定容后,测定洗脱液中多酚浓度,计算多酚提取量。
1.3.4 响应面优化试验
依据单因素试验结果,将糖蜜稀释液的pH值、洗脱液的乙醇浓度、洗脱流速作为动态吸附考察的3个因素,每个因素设定3个考察水平,通过Design-Expert 12.0软件中响应面法设计程序中的Box-Behnken方法进行工艺优化,试验因素和水平见表1。
1.3.5 甘蔗多酚的抗氧化活性分析
1.3.5.1 ABTS自由基清除能力测定
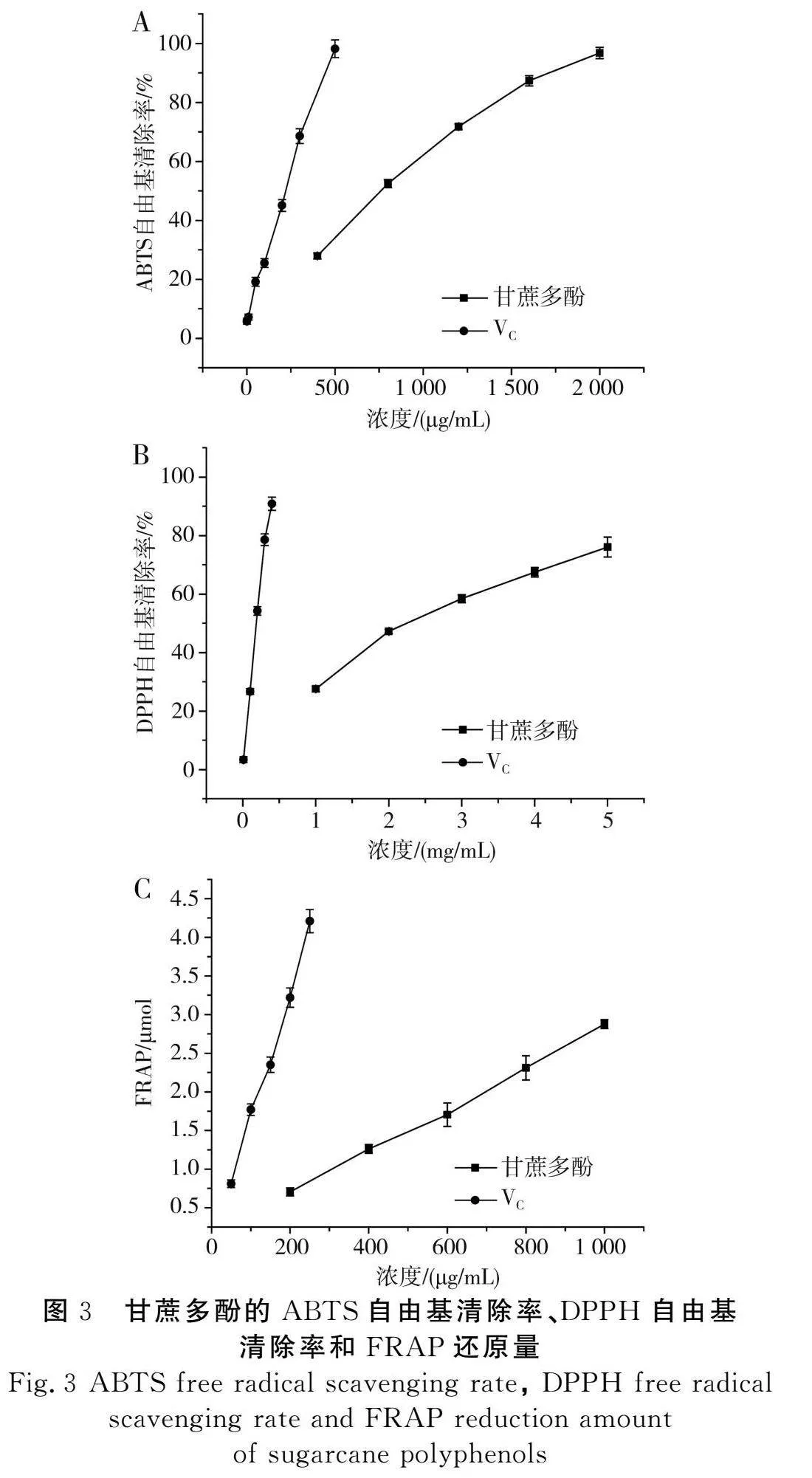
ABTS自由基清除能力的测定参照Asikin等[5]的方法。使用pH 7.4的PBS溶液配制5 mmol/L的ABTS母液,经过95%乙醇稀释后,使其在734 nm处的吸光度值为0.7±0.2(ABTS溶液现配现用)。随后分别将 1 mL ABTS溶液和20 μL不同浓度梯度(400,800,1 200,1 600,2 000 μg/mL)的样品溶液混匀,于室温下避光放置 30 min,然后使用多功能酶标仪测量其在波长734 nm处的吸光度值,其中以蒸馏水作为空白组,以抗坏血酸作为阳性对照组。ABTS自由基清除率计算公式如下:
ABTS自由基清除率(%)=1-A1-A2A0×100%。
式中:A0为空白组的吸光度值;A1为样品组的吸光度值;A2为对照组的吸光度值。
1.3.5.2 DPPH自由基清除能力测定
DPPH自由基清除能力的测定参照Dargham等[15]的方法,分别将20 μL不同浓度梯度(1,2,3,4,5 mg/mL)的样品溶液加入到1 mL DPPH乙醇溶液中混匀,在室温下避光静置30 min。随后使用多功能酶标仪测量其在波长517 nm处的吸光度值,其中以蒸馏水作为空白组,以抗坏血酸作为阳性对照组。DPPH自由基清除率计算公式如下:
DPPH自由基清除率(%)=1-A1-A2A0×100%。
式中:A0为空白组的吸光度值;A1为样品组的吸光度值;A2为对照组的吸光度值。
1.3.5.3 FRAP总抗氧化能力测定
FRAP总抗氧化能力的测定参照Ali等[7]的方法并略作修改。首先分别取100 μL不同浓度梯度(200,400,600,800,1 000 μg/mL)的样品溶液加入到3 mL FRAP工作液中,混合均匀后避光反应30 min,然后测定其在593 nm处的吸光度值。以硫酸亚铁溶液作标准曲线,计算样品的抗氧化能力。
1.4 数据分析
所有结果用“平均值±标准差”的形式表示,每次试验重复3次取平均值,采用SPSS 25.0、Origin 2019等作图分析,以Tukey法在置信区间为95%下进行显著性分析。不同字母代表相同因素之间有显著性差异(P<0.05)。
2 结果与分析
2.1 单因素试验结果
不同单因素对多酚提取量的影响见图1。
2.1.1 乙醇浓度对多酚提取量的影响
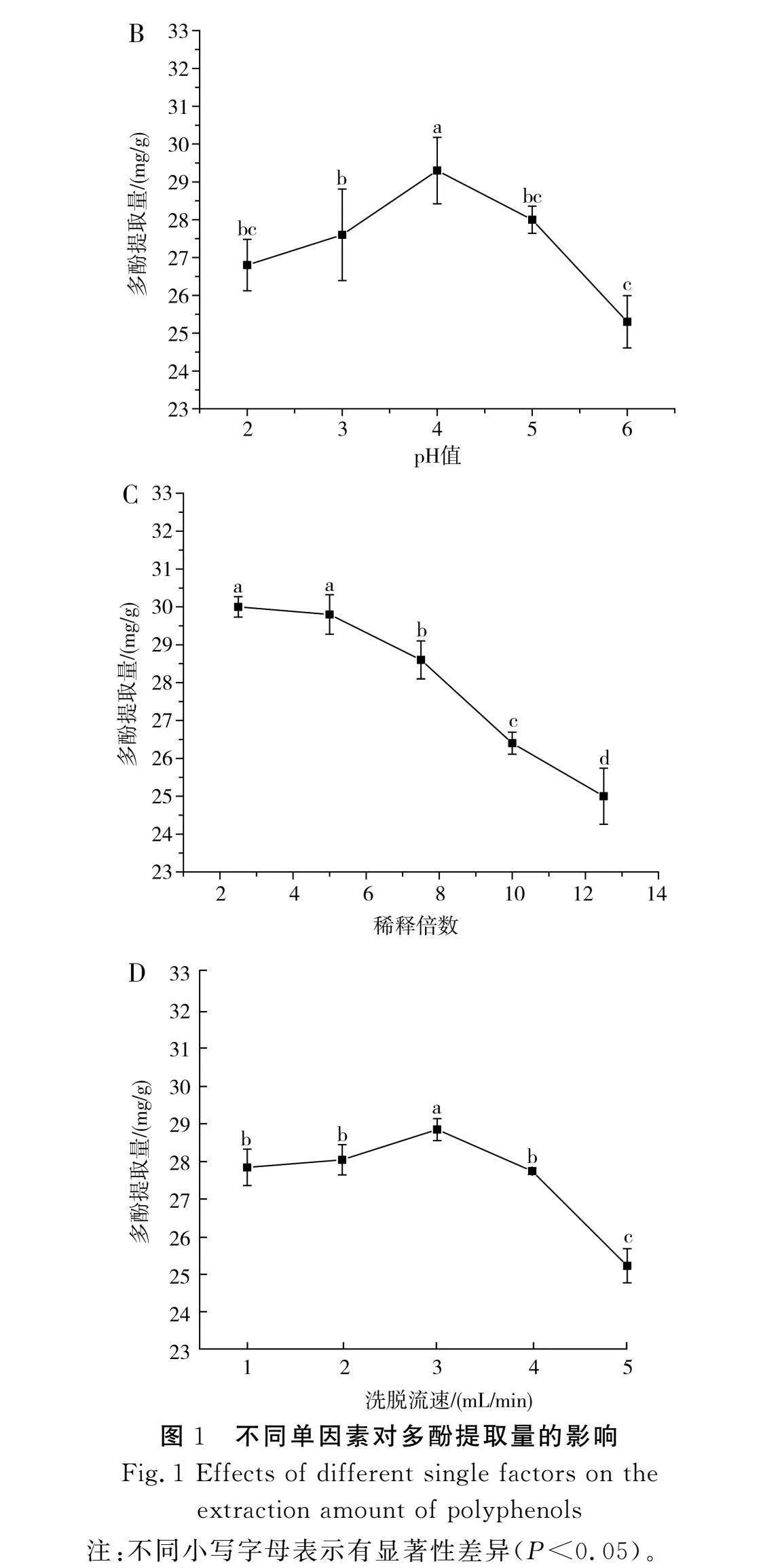
由图1中A可知,当以不同浓度的乙醇溶液洗脱甘蔗多酚时,多酚提取量呈现先上升后下降的趋势,当乙醇浓度为50%时达到最大值31.35 mg/g。当乙醇浓度由40%升至50%时,更多中极性多酚成分被提取出来;当乙醇浓度继续增加时,洗脱剂与多酚极性差异增大,使得多酚类物质不能充分溶解,提取量反而减少[3,24]。总的来看,乙醇浓度对多酚提取量的影响较小。
2.1.2 pH值对多酚提取量的影响
由图1中B可知,ADS-600树脂在不同pH值的糖蜜稀释液中吸附多酚时,多酚提取量呈现先上升后下降的趋势,当pH值为4时达到最大值29.32 mg/g。由于酚类化合物呈现出弱酸性,因此其在弱酸性环境下更容易被吸附[14]。
2.1.3 不同稀释倍数对多酚提取量的影响
由图1中C可知,多酚提取量随着甘蔗糖蜜稀释倍数的升高而降低。糖蜜进行预处理后的稀释倍数为2.5倍,此时多酚提取量达到最大值,为30.02 mg/g;在吸附公式中,浓度与吸附量之间存在正相关性,稀释倍数越小,浓度越大,多酚提取量越高[25]。
2.1.4 不同洗脱流速对多酚提取量的影响
由图1中D可知,当以不同的流速洗脱甘蔗多酚时,多酚提取量呈现先上升后下降的趋势,在3 mL/min的流速条件下可达到最大值28.8 mg/g。一般来说,流速过小会降低生产效率,增加生产成本;而流速过大容易使大孔树脂吸附多酚的效率降低,从而导致未被吸附的多酚流出层析柱[14]。
2.2 响应面设计ADS-600树脂对甘蔗多酚动态吸附洗脱工艺优化的试验结果
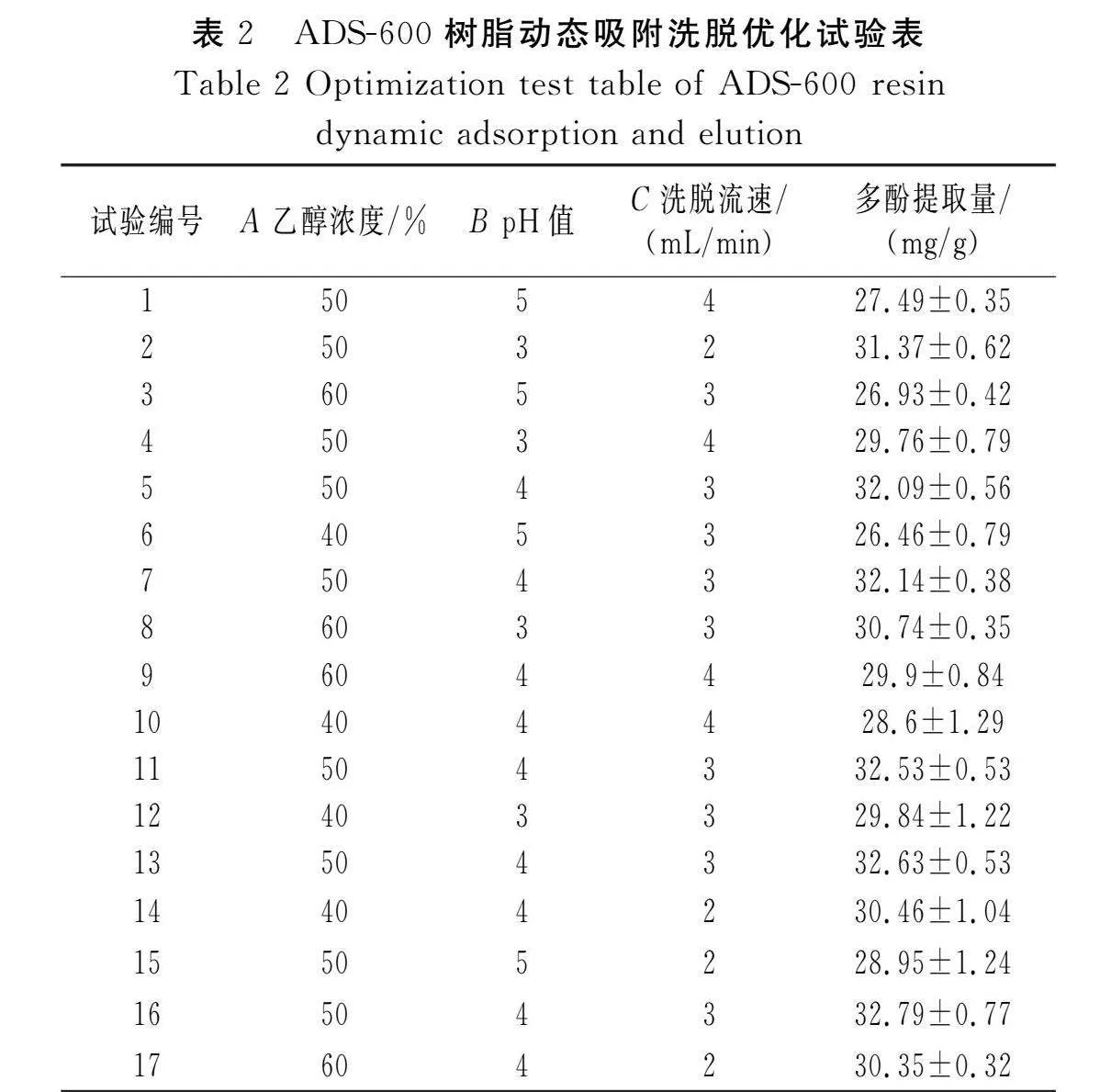
根据单因素试验结果,选取乙醇浓度(A)、pH值(B)和洗脱流速(C)设计三因素三水平的响应面分析试验。试验设计及结果见表2。
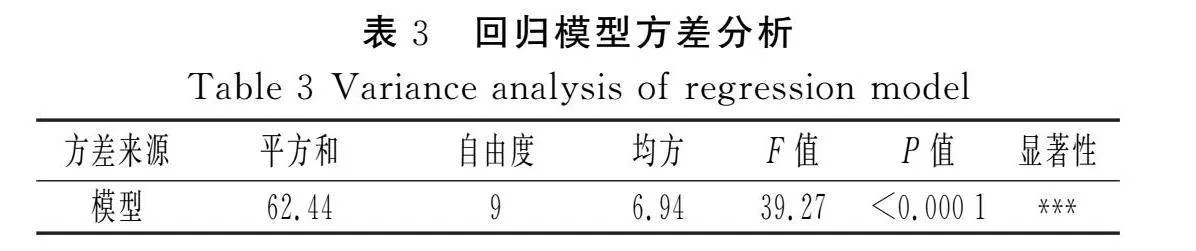
对表2中试验数据进行二次多项式回归拟合,获得多酚提取量对乙醇浓度(A)、pH值(B)、洗脱流速(C)的多元回归方程:Y=32.44+0.32A-1.48B-0.672 5C-0.107 5AB+0.352 5AC+0.037 5BC-1.75A2-2.19B2-0.854 2C2。
该回归模型的方差分析结果见表3。
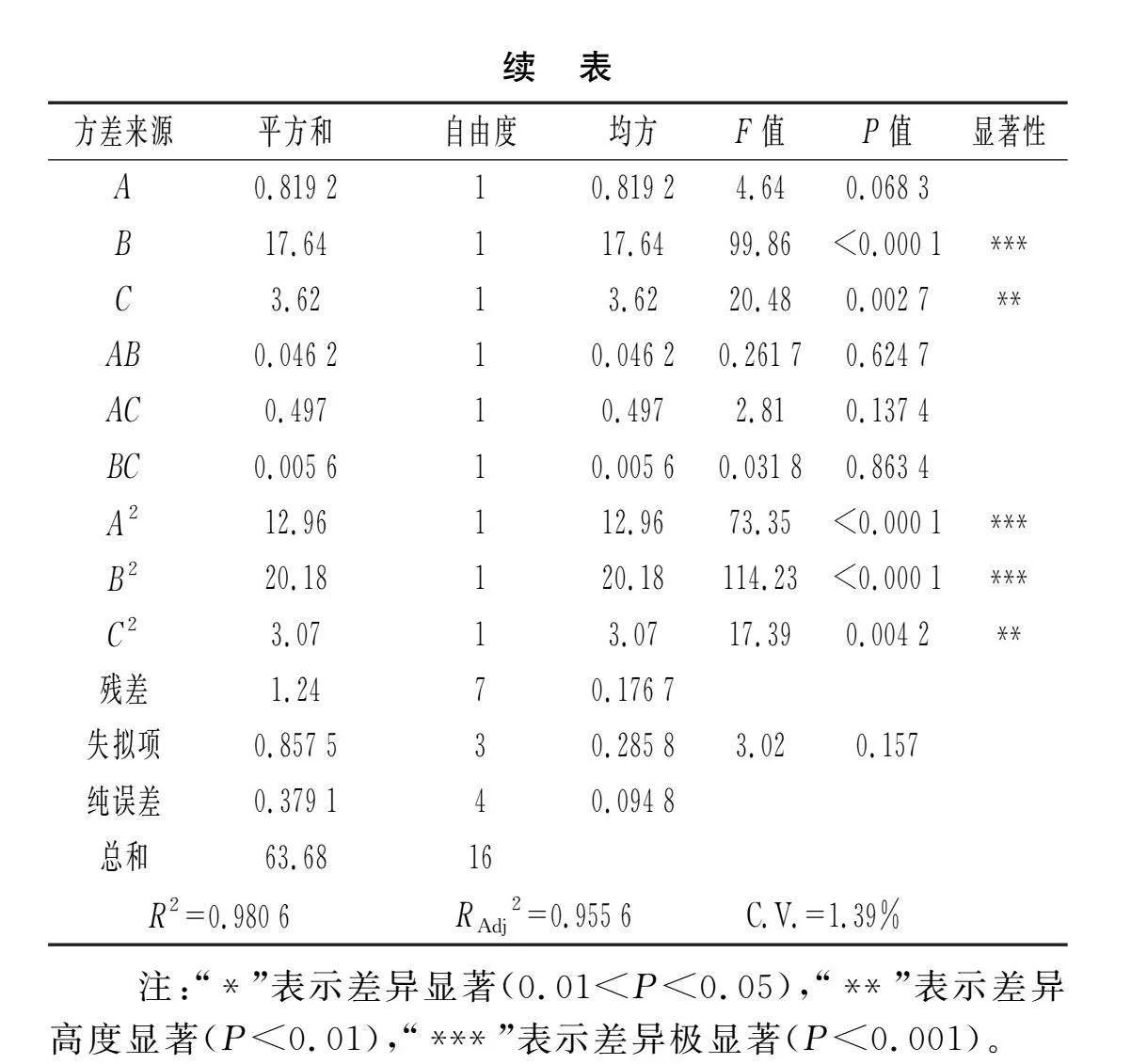
由表3可知,模型极显著(P<0.000 1),失拟项不显著(P>0.05),方程的拟合性良好,操作误差小,模型的重现性良好(R2=0.980 6,RAdj2=0.955 6,C.V.=1.39%),因此该响应面设计可以用于优化多酚动态吸附洗脱工艺。由表3中各因素水平的显著性可知,对多酚吸附洗脱工艺的影响主次顺序为pH值(B)>洗脱流速(C)>乙醇浓度(A)。
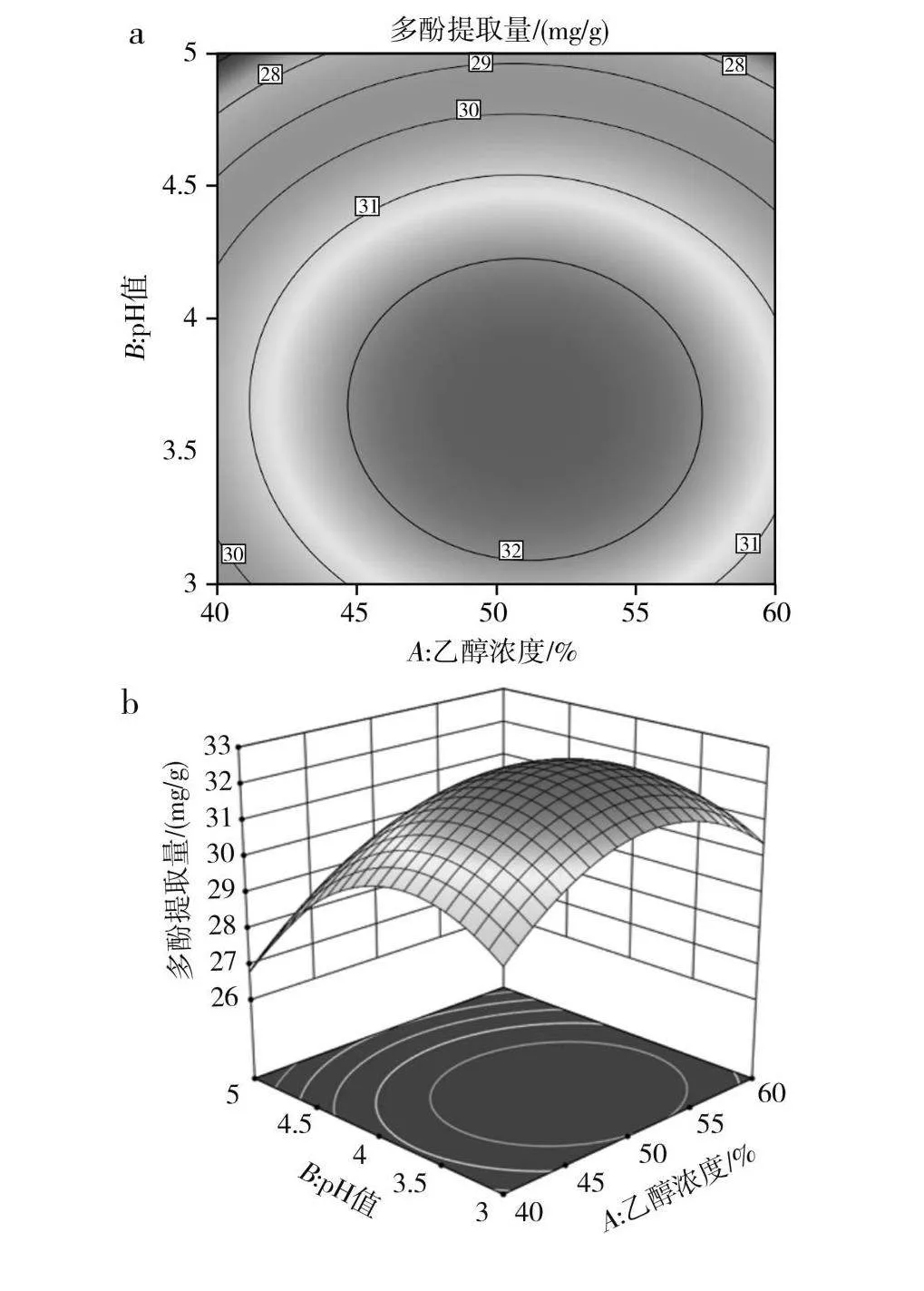
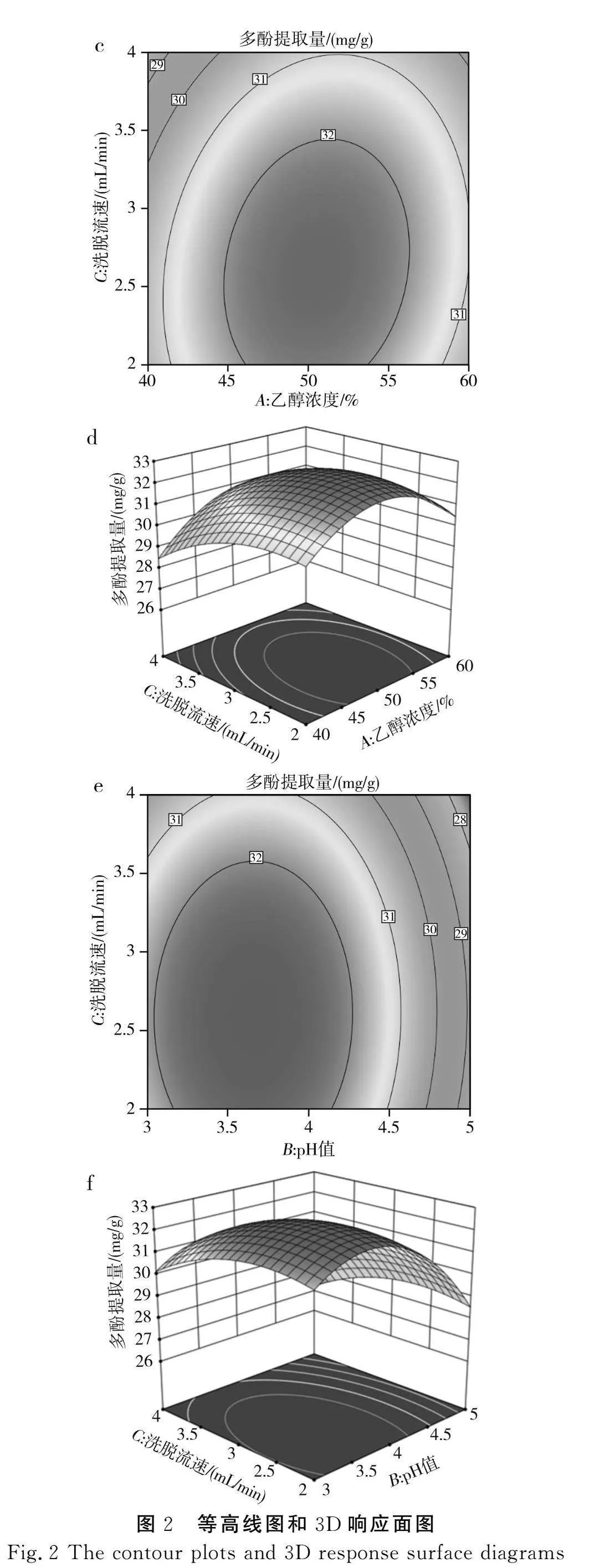
根据回归方程得到的不同因素的二维等高线图和3D响应面图见图2。
图2a中等高线图呈近圆形,说明pH值和乙醇浓度的交互作用不明显,P=0.624 7;图2c中等高线图呈近椭圆形,说明乙醇浓度与洗脱流速的交互作用不明显,P=0.137 4;图2e中等高线图呈近椭圆形,说明pH值与洗脱流速的交互作用不明显,P=0.863 4;与模型中F值的分析结果一致。
2.3 验证试验结果
通过回归方程模型拟合分析,得到ADS-600大孔树脂动态提取甘蔗多酚的最佳工艺条件为pH值3.72、乙醇浓度50.69%、洗脱流速2.49 mL/min,该理论情况下多酚提取量为32.81 mg/g。综合考虑,在实际操作中选择pH值3.5、乙醇浓度50%和洗脱流速2.50 mL/min进行洗脱。经过3次重复验证试验,得到的多酚提取量为(33.48±0.24) mg/g,与响应面预测的结果比较接近,相对误差仅为2.04%(lt;5%),试验值与理论值基本吻合。因此,该回归方程模型可用于预测ADS-600大孔树脂动态提取甘蔗多酚。
2.4 甘蔗多酚的抗氧化活性分析
将甘蔗糖蜜在pH值3.5、乙醇浓度50%和洗脱流速2.50 mL/min的条件下进行多酚的提取,经浓缩冷冻干燥得到甘蔗多酚,置于4 ℃冰箱中保存备用。经测定,甘蔗多酚中总多酚含量为21.5%。
在甘蔗多酚的抗氧化活性测试中,由图3可知,甘蔗多酚与VC对ABTS自由基的清除率、DPPH自由基的清除率和FRAP值均随着质量浓度的增加而升高,具有一定量效关系。甘蔗多酚与VC对ABTS自由基清除率的IC50值分别为824,228 μg/mL;对DPPH自由基清除率的IC50值分别为2.51 mg/mL和199 μg/mL;当甘蔗多酚浓度为1 mg/mL时可还原2.88 μmol的铁离子当量。甘蔗多酚对ABTS、DPPH自由基的清除能力和FRAP还原能力略低于阳性对照VC,但仍具有一定的抗氧化能力。
3 结论
本文以甘蔗糖蜜为原料,通过大孔树脂吸附法提取甘蔗多酚。以多酚提取量为指标,通过单因素试验获得较优提取条件,并在单因素试验的基础上进一步通过响应面法优化提取工艺,并对提取得到的甘蔗多酚进行抗氧化活性测试。单因素试验结果表明,较优的提取条件为pH值4、糖蜜稀释倍数越小越好、洗脱溶液乙醇浓度50%、洗脱流速3 mL/min。响应面优化试验结果表明,最佳提取工艺为pH值3.5、乙醇溶液浓度50%、洗脱流速2.50 mL/min,在此条件下获得的甘蔗多酚提取量为(33.48±0.24) mg/g,与预测值的相对误差仅为2.04%。此外,经测定,获得的甘蔗多酚粉体中总多酚含量为21.5%。
甘蔗多酚抗氧化试验表明,ABTS和DPPH自由基清除率随着甘蔗多酚质量浓度的增加而升高,IC50值分别为824 μg/mL和2.51 mg/mL,甘蔗多酚为1 mg/mL时可还原2.88 μmol的铁离子当量,以上结果表明甘蔗多酚具有体外抗氧化活性。本研究结果为甘蔗糖蜜的高值化利用和甘蔗多酚的开发利用提供了参考。
参考文献:
[1]杨强剑.膜分离技术在糖蜜澄清和脱色中的应用基础研究[D].北京:中国科学院大学(中国科学院过程工程研究所),2019.
[2]赵毅.甘蔗多酚分离鉴定及生物活性研究[D].广州:华南理工大学,2015.
[3]陈纯.甘蔗皮多酚的提取、分离鉴定及抗氧化活性研究[D].杭州:浙江大学,2013.
[4]杜瑜欣,李玉铭,高焌茹,等.甘蔗多酚提取工艺及其在食品工业中的应用进展[J].中国调味品,2018,43(7):173-177.
[5]ASIKIN Y, TAKAHASHI M, MISHIMA T, et al. Antioxidant activity of sugarcane molasses against 2,2'-azobis(2-amidinopropane) dihydrochloride-induced peroxyl radicals[J].Food Chemistry,2013,141(1):466-472.
[6]ZHENG R, SU S, LI J B, et al.Recovery of phenolics from the ethanolic extract of sugarcane (Saccharum officinarum L.) baggase and evaluation of the antioxidant and antiproliferative activities[J].Industrial Crops and Products,2017,107:360-369.
[7]ALI S E, EL GEDAILY R A, MOCAN A, et al.Profiling metabolites and biological activities of sugarcane (Saccharum officinarum Linn.) juice and its product molasses via a multiplex metabolomics approach[J].Molecules (Basel, Switzerland),2019,24(5):934.
[8]ZHENG R, SU S, ZHOU H F, et al. Antioxidant/antihyperglycemic activity of phenolics from sugarcane (Saccharum officinarum L.) bagasse and identification by UHPLC-HR-TOFMS[J].Industrial Crops and Products,2017,101:104-114.
[9]VALLI V, GO'MEZ-CARAVACA A M, DI NUNZIO M, et al. Sugar cane and sugar beet molasses, antioxidant-rich alternatives to refined sugar[J].Journal of Agricultural and Food Chemistry,2012,60(51):12508-12515.
[10]DESEO M A, ELKINS A, ROCHFORT S, et al. Antioxidant activity and polyphenol composition of sugarcane molasses extract[J].Food Chemistry,2020,314:126180.
[11]潘振辉,董宇豪,陈显伟,等.桑葚、甘蔗糖蜜多酚的成分鉴定及其复配物的抗氧化活性[J].现代食品科技,2023,39(7):246-254.
[12]JI J, YANG X, FLAVEL M, et al. Antioxidant and anti-diabetic functions of a polyphenol-rich sugarcane extract[J].Journal of the American College of Nutrition,2019,38(8):670-680.
[13]KONG F S, YU S J, ZENG F, et al. Phenolics content and inhibitory effect of sugarcane molasses on α-glucosidase and α-amylase in vitro[J].Sugar Tech,2016,18(4):333-339.
[14]孔繁晟.甘蔗糖蜜中活性因子降血糖血脂作用及机理研究[D].广州:华南理工大学,2015.
[15]DARGHAM M B, BOUMOSLEH J M, FARHAT A, et al.Antioxidant and anti-diabetic activities in commercial and homemade pomegranate molasses in Lebanon[J].Food Bioscience,2022,46(1):101540.
[16]蔡玮琦.药用红糖中酚类成分研究及产品开发[D].南京:南京中医药大学,2021.
[17]YOON S A, KANG S I, SHIN H S, et al. p-Coumaric acid modulates glucose and lipid metabolism via AMP-activated protein kinase in L6 skeletal muscle cells[J].Biochemical and Biophysical Research Communications,2013,432(4):553-557.
[18]VELAZQUEZ-MARTINEZ V, VALLES-ROSALES D, RODRIGUEZ-URIBE L, et al. Antimicrobial, shelf-life stability, and effect of maltodextrin and gum arabic on the encapsulation efficiency of sugarcane bagasse bioactive compounds[J].Foods,2021,10(1):116.
[19]张凯.甘蔗糖蜜挥发性成分的活性研究及缓释驱蚊乳膏的制备[D].广州:广东药科大学,2021.
[20]ALI S E, YUAN Q, WANG S, et al. More than sweet: a phytochemical and pharmacological review of sugarcane (Saccharum of ficinarum L.)[J].Food Bioscience,2021,44(5):101431.
[21]郑瑞.甘蔗多酚抗氧化、降血糖、抗肿瘤细胞增殖活性研究[D].广州:华南理工大学,2017.
[22]PRAKASH M D, STOJANOVSKA L, FEEHAN J, et al. Anti-cancer effects of polyphenol-rich sugarcane extract[J].PLoS One,2021,16(3):247492.
[23]李晶博.甘蔗汁酒精废液色素提取及特性研究[D].广州:华南理工大学,2010.
[24]迟茹.糖蜜酒精废液中酚类色素的提取研究[D].柳州:广西科技大学,2013.
[25]张新林,龙为,于淑娟,等.大孔树脂对甘蔗糖蜜色素的吸附性能和动力学[J].食品工业科技,2015,36(22):111-114.

