土壤改良措施对参田土壤微生物群落结构的影响




摘要:为探究土壤改良措施对参田土壤微生物群落结构的影响,筛选老参田土壤改良最优方案,进行大田种植土壤改良试验,设置3个处理组,即棉隆土壤熏蒸组(A)、高锰酸钾化学消毒组(B)、微生物菌肥组(C),并以未改良土壤为空白对照组(CK)。通过高通量测序技术分析不同处理方式下土壤微生物群落结构变化,综合评价不同参田土壤改良措施。结果表明,在12个改良参田土壤中共检测537 766个细菌有效序列,701 028个真菌有效序列;土壤细菌在门分类水平上,改良组放线菌门、绿弯菌门、厚壁菌门等的相对丰度均大于空白对照组,土壤真菌在门分类水平上,被孢霉门的相对丰度明显高于空白对照组。在微生物属分类水平上,处理组有益菌芽孢杆菌属、鞘氨醇单胞菌属、热酸菌属、青霉菌、毛壳菌属的相对丰度明显高于空白对照组,而引起植物病害的镰刀菌属、芽枝霉属在处理组中的相对丰度呈下降趋势。空白对照组土壤中鞘氨醇单胞菌属、热酸菌属的相对丰度高于处理组,在西洋参短期连作体系中,预测土壤中微生物可产生抵御病害的生防菌,维持植物正常生长。总之,在土壤改良措施中,3种处理方法都有利于有益菌和生防菌丰度的增加,土壤修复以C组最好,A组次之,B组效果较差。
关键词:西洋参;高通量测序;土壤改良;连作障碍;微生物
中图分类号:S567.5+30.61 文献标志码:A
文章编号:1002-1302(2024)12-0261-08
西洋参(Panax quinquefolium L.),为五加科人参属多年生草本植物,原产于北美洲,我国自1970年引种成功后,开始规模化种植。经过长时间的发展,我国已形成三大西洋参种植基地,主要分布在东北、华北、西北等地区[1]。连作的集约化、现代化农业生产模式是最常见的耕作制度,人参属植物在种植过程中易产生严重的连作障碍,这极大地制约了西洋参产业的发展[2]。
目前,引起西洋参连作障碍的发生机制已基本明确。老参田土壤微生物群落失衡是导致西洋参再植过程中土传病害发生的直接原因,而土壤微生物群落的结构组成是衡量参田土壤健康情况的重要指标[3]。研究表明,在西洋参连续种植土壤中,假单胞菌(Pseudomonas spp.)、芽孢杆菌(Bacillus)显著减少,而引起植物根腐病的主要病原菌镰刀菌(Fusarium)呈现增加的趋势[4-6]。土壤微生物群落结构与土壤理化性质、施肥方式、土壤质地等有关[7]。本研究通过高通量测序技术分析不同改良措施对老参田土壤微生物群落结构的影响,以期筛选出最佳改良方法以及土壤中抵抗连作障碍的优势菌群,为西洋参连作障碍防治提供数据支持。
1 材料与方法
1.1 试验地概况
试验在山东省威海市文登区大水泊镇大水泊村西洋参种植基地(37°10′N,122°13′E)进行,该地处于山东半岛东部,年平均气温13 ℃,年平均降水量767.8 mm,种植方式主要以一年两作(冬小麦、夏玉米)为主。供试土壤类型为沙质壤土。试验用地为2020年10月收获后的西洋参参田。
1.2 材料与试验设计
供试西洋参种质由威海市文登传福参业有限公司提供。供试药剂98%棉隆微粒剂(土壤熏蒸剂)、高锰酸钾(化学消毒)、微生物菌肥(有效活菌数≥2.0 亿个/mL EM浓缩菌)均购自济南兆龙科技发展有限公司。
选取当年收获西洋参的土壤作为试验用地,在种植西洋参之前对土壤进行处理。试验共设计4组,即棉隆土壤熏蒸组(A组)、高锰酸钾化学消毒组(B组)、微生物菌肥组(C组)、采参后未作处理的土壤为空白对照组(CK)。A组药剂施用量为30 g/m2,熏蒸剂施用完成后立即覆盖塑料薄膜,密闭熏蒸 30 d 后,揭膜晾晒30 d。B组使用喷雾器将0.1%高锰酸钾均匀喷于土壤表面,然后立即用塑料薄膜覆盖密封,曝晒7 d。C组施用菌肥用量为 6 mL/m2,一次性施入西洋参种植垄内。每个处理3次重复,共12个小区,小区面积50 m2,每个小区间隔1 m缓冲区。除处理方式不同外,田间管理参照西洋参山东地区种植时间结合西洋参生长习性进行统一管理。
1.3 土壤样品采集
土壤样品于2021年10月,按照随机、同质、多点混合的原则,用不锈钢采样器从耕作层(0~20 cm)采集,过2 mm网格后,去除土壤中石头等杂质。每个处理组采集9份土壤样品,混匀后,分别装在3个无菌袋中,放在液氮中,-80 ℃ 保存。
1.4 土壤微生物PCR扩增与高通量测序
对土壤样品基因组DNA进行抽提,利用1%琼脂糖凝胶电泳检测抽提DNA,检测DNA完整性后,进行PCR扩增(TransStart Fastpfu DNA Polymerase),每个样本3个重复,将同一样本的PCR产物混合后,利用2%琼脂糖凝胶进行电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,并利用Tris-HCl进行洗脱;将同一样本的PCR产物混合后用2%琼脂糖凝胶进行电泳检测,使用荧光定量计检测提取的DNA浓度,当浓度检测合格后,进入下一步基因文库的构建。
以特异性引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对土壤细菌16S V3~V4区进行PCR扩增;选择PCR扩增通用引物ITS1F和ITS2R(ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′;ITS2R:5′-GCTGCGTTCTTCATCGATGC-3′)对土壤真菌ITS区进行扩增。DNA片段的一端与引物碱基互补,以DNA片段为模板进行PCR合成;经过变性、退火,DNA片段的另一端随机与附近的另外一个引物互补,形成“桥(bridge)”;经过PCR扩增,产生DNA簇;DNA扩增子线性化成为单链。加入改造过的DNA聚合酶和带有4种荧光标记的dNTP,每次循环只合成1个碱基;用激光扫描反应板表面,读取每条模板序列第1轮反应所聚合上去的核苷酸种类;将“荧光基团”和“终止基团”进行化学切割,恢复3′端黏性,继续聚合第2个核苷酸;统计每轮收集到的荧光信号结果,获知模板DNA片段的序列。构建MiSeq文库将其用于Illumina MiSeq PE300平台进行高通量测序。
1.5 数据分析
通过高通量测序得到的双端序列经拼接与质控抽平得到优化序列,采用Usearch(http://www.drive5.com/usearch/)对优化序列进行OTU统计,对97%相似水平的用uparse(http://www.drive5.com/uparse/)与RDP Classifier(https://sourceforge.net/projects/)进行OTU聚类、序列分类注释;采用Mothur(https://www.mothur.org/wiki/Down)进行α多样性分析[8];采用Qiime计算β多样性距离矩阵,然后用R语言(version 3.3.1)绘制可视化树状图。运用R语言配合vegan包进行数据多样性分析;用PICRUST软件进行土壤细菌功能预测[9]。
2 结果与分析
2.1 参田土壤细菌的组成及多样性分析
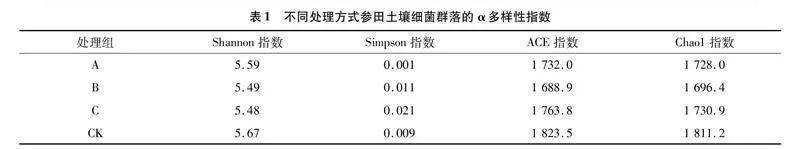
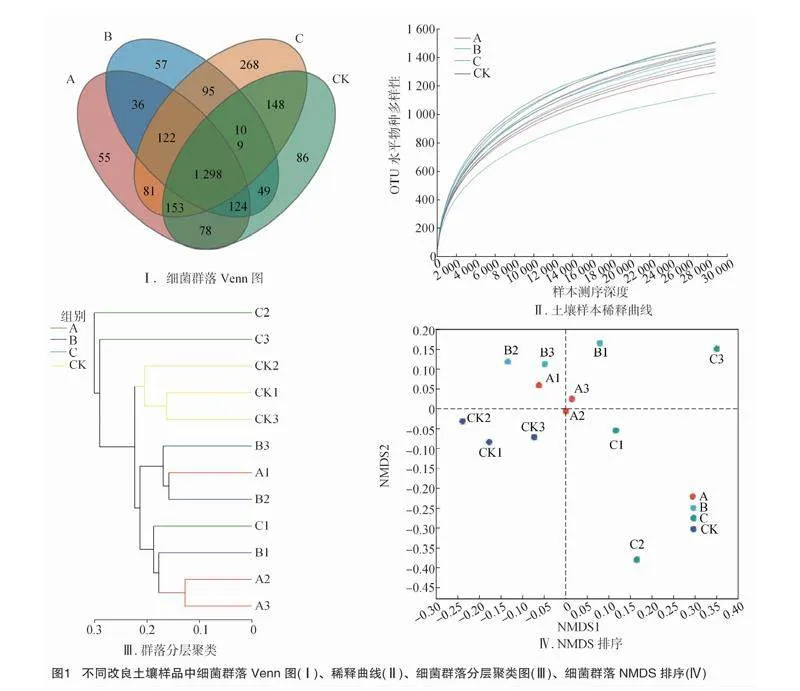
运用16S RNA、ITS对改良土壤中的细菌、真菌进行测序,从12个土壤样品中共获得537 766个有效序列,平均长度为414 bp。在97%的高通量序列相似性水平上进行聚类,共检测到2 759个OTU,其中C组的OTU数量高于其他3组(图1-Ⅰ)。通过绘制土壤细菌稀释曲线[10]发现,每个样品的OTU稀释曲线随着读取样本量的增加趋近平缓,测序数据逐渐达到饱和(图1-Ⅱ)。目前的测序量能够覆盖样本中的绝大多数物种,测序数据可用于后续土壤细菌多样性分析。由表1可知,3个处理组参田Shannon指数与CK相比数值均降低,C组的Simpson指数高于其他3组。与其他处理相比,CK组的Chao1指数和ACE指数较高,但B组处理土壤Chao指数和ACE指数较低。
基于Bray-Curtis距离进行分层聚类分析[11],结果(图1-Ⅲ)显示,样品可划分为4个高度聚集群,说明不同改良处理土壤样品中的细菌群落比较相似。此外,A组、B组、CK组的细菌群落基本聚集,而C组的土壤样品与其他组分离。基于OTU丰度的非度量多维尺度分析(NMDS)[12](stress=0.112)结果(图1-Ⅳ)表明,A组、B组、CK组样品高度相似并聚集,与C组的样品明显分离,与层次聚类分析的结果相似。
在97%的相似度水平上对测序土壤样品OTU代表序列进行分类学分析,参田土壤在细菌序列中共分出34门、104纲、230目、365科、643属、1 189 种。在门水平上,将相对丰度小于1%的土壤细菌归于其他(others),共得到34个类群,在相对丰度排名前10的物种中,各组群落结构的丰富度差异明显(图2-Ⅰ),其中放线菌门(Actinobacteriota,26.23%~39.06%)为4组土壤中的优势菌门,其他优势菌门依次为变形菌门(Proteobacteria,10.62%~2.83%)、绿弯菌门(Chloroflexi,10.45%~17.08%)、酸杆菌门(Acidobacteriota,9.17%~15.48%)、厚壁菌门(Firmicutes,3.53%~13.92%)、芽单胞菌门(Gemmatimonadota,1.99%~4.56%)、Patescibacteria(1.48%~6.55%)、拟杆菌门(Bacteroidota,0.66%~4.98%)、WPS-2(0.56%~1.79%)、黏球菌门(Myxococcota,0.62%~1.09%),占各组序列的90%以上。其中3个土壤改良组的放线菌门、绿弯菌门、厚壁菌门的相对丰度均大于空白对照组,而变形菌门、Patescibacteria、拟杆菌门、WPS-2、黏球菌门的相对丰度在空白对照组土壤中高于其他3个处理组。
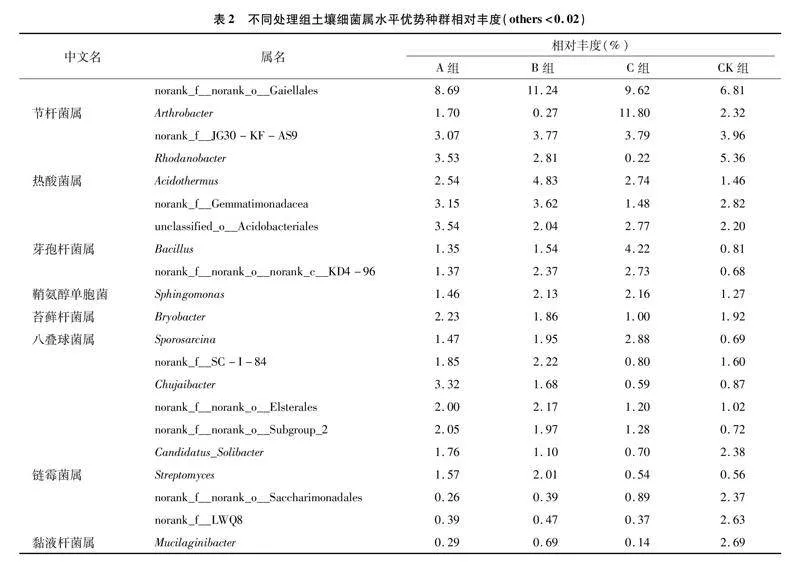
在属水平上,共检测到21个细菌属(图2-Ⅱ),平均相对丰度高于2%。由表2可知,CK组中norank_f__JG30-KF-AS9(3.96%)、Rhodanobacter(5.36%)、Candidatus_Solibacter(2.38%)、norank_f__norank_o__Saccharimonadales(2.37%)、norank_f__LWQ8(2.63%)、黏液杆菌属(Mucilaginibacter,2.69%)等6个属的相对丰度高于A、B、C组。A组中unclassified_o__Acidobacteriales(3.54%)、苔藓杆菌属(Bryobacter,2.23%)、Chujaibacter(3.32%)、orank_f__norank_o__Subgroup_2(2.05%)等4个属的相对丰度较高。B组中norank_f__norank_o__Gaiellales(11.24%)、热酸菌属(Acidothermus,4.83%)、norank_f__Gemmatimonadacea(3.62%)、norank_f__SC-I-84(2.22%)、norank_f__norank_o__Elsterales(2.17%)、链霉菌属(Streptomyces,2.01%)等6个属的相对丰度较高。C组中节杆菌属(Arthrobacter,11.80%)、芽孢杆菌属(Bacillus,4.22%)、norank_f__norank_o__norank_c__KD4-96(2.73%)、鞘氨醇单胞菌(Sphingomonas,2.16%)、八叠球菌属(Sporosarcina,2.88%)等5个属的相对丰度较高。
2.2 改良参田土壤真菌的组成及多样性分析
12个土壤样品经过质量过滤后,共获得 701 028 个真菌有效序列。真菌序列的平均长度为232 bp,在97%的高通量序列相似性水平上进行聚类,共获得1 448个OTU,由图3-Ⅰ可知,4组土壤真菌共享322个OTU,其中A组与空白对照组土壤真菌共享87个OTU,B组与空白对照组土壤真菌共享73个OTU,C组与空白对照组土壤真菌共享30个OTU。A组土壤真菌独有142个OTU,B组土壤真菌独有299个OTU,C组土壤真菌独有91个OTU,CK组土壤真菌独有93个OTU。基于OTU的所有样品稀释曲线均达到其渐近线(图3-Ⅱ),表明本研究中产生的数据足以分析真菌多样性。
α多样性分析结果(表3)表明,与空白对照组相比,3个处理组参田土壤的Shannon指数相对较高。此外,空白对照组土壤的Simpson指数高于其他土壤,而A组、C组土壤中的ACE指数和Chao1指数低于CK组。分层聚类分析结果(图3-Ⅲ)表明,A组、C组、CK组土壤样品中的真菌群落更为相似且较为聚集,与B组中的真菌群落明显分离。此外,在不同改良方法中,B组的参田土壤真菌群落成簇,与空白对照组土壤分离明显,但B1、C3、CK2处理组土壤由于重现性差除外。基于OTU丰度进行NMDS(stress=0.081),结果(图3-Ⅳ)表明,所有样品分为4类。A组、C组、CK组的土壤样品高度相似并聚集,与B组土壤样品分离。这一结果与层次聚类分析结果相似。
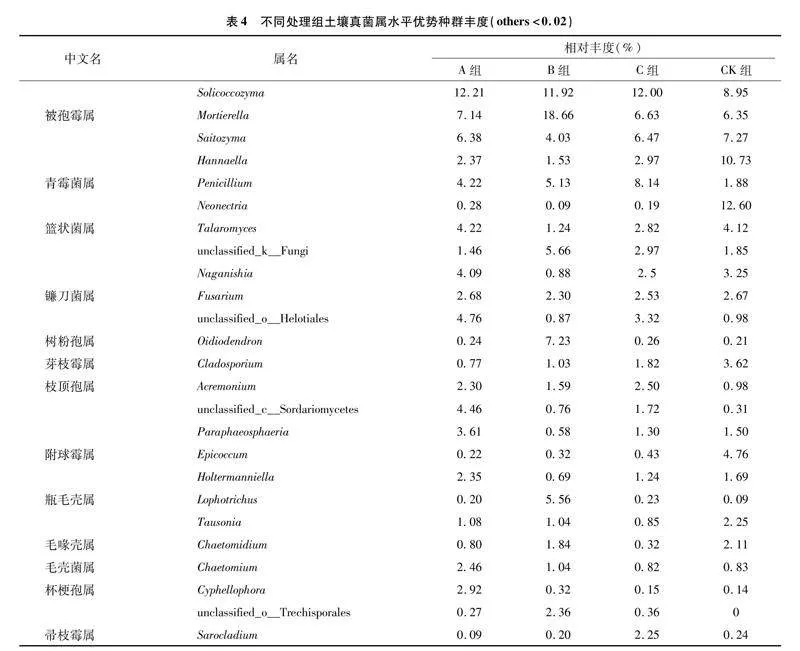
老参田土壤真菌在门水平上,将相对丰度小于1%的土壤真菌归于others,检测到的参田土壤真菌涵盖6个类群、14门、44纲、97目、205科、369属、577种。在所有样品中,子囊菌门(Ascomycota,48.50%~58.49%)的相对丰度最高(图4-Ⅰ),其次是担子菌门(Basidiomycota,25.16%~38.19%)、被孢霉门(Mortierellomycota,7.04%~17.9%)、unclassified_k__Fungi(1.48%~5.26%)、罗兹菌门(Rozellomycota,0.23%~1.87%)、壶菌门(Chytridiomycota,0.43%~1.05%)。A组子囊菌门的相对丰度高于其他3组,而unclassified_k__Fungi、罗兹菌门的相对丰度明显低于其他3组。CK组担子菌门的相对丰度高于其他各组。
在属水平上,共检测到25个真菌属(图4-Ⅱ、表4)。不同改良方法处理下土壤中优势真菌群落的相对丰度不同,空白对照组土壤中有7个属[Saitozyma、Hannaella、Neonectria、芽枝霉属(Cladosporium)、附球霉属(Epicoccum)、Tausonia、毛喙壳属(Chaetomidium)]的相对丰度高于其他3个处理组。A组中Solicoccozyma、篮状菌属(Talaromyces)、Naganishia、镰刀菌属(Fusarium)、unclassified_o__Helotiales、unclassified_c__Sordariomycetes、Paraphaeosphaeria、Holtermanniella、毛壳菌属(Chaetomium)、杯梗孢属(Cyphellophora)的相对丰度均高于B组、C组、CK组。此外,被孢霉属(Mortierella)、unclassified_k__Fungi、树粉孢属(Oidiodendron)、瓶毛壳属(Lophotrichus)、unclassified_o__Trechisporales的相对丰度在B组中最高。青霉菌(Penicillium)、枝顶孢属(Acremonium)、帚枝霉属(Sarocladium)的相对丰度在C组中最高。
3 讨论
土壤是微生物的生存环境,土壤微生物参与调节大部分的土壤活动,尤其在土壤养分的转化和循环中发挥着重要作用[13-14]。在西洋参连作系统中,根系不断向土壤中分泌相同类型的分泌物, 可能会促进某些微生物物种在土壤中定殖,最终引起土壤微生物多样性降低[15]。从土壤α多样性分析结果可以看出,土壤改良可以增加参田土壤中细菌和真菌的相对丰度和多样性。 β多样性分析(NMDS)结果再次验证了不同土壤改良措施对参田土壤微生物菌群结构的影响。A组、B组、C组土壤中的细菌和真菌群落存在明显差异,其中A组与CK组的土壤细菌、真菌群落结构相似度较高,说明土壤熏蒸在短时间内对土壤微生物有一定的灭活作用,随着植物生长时间的延长,其作用随着主要物质的分解而逐渐失效。
土壤改良可显著改善参田土壤细菌和真菌群落结构。在细菌主要的21个属中,C组芽孢杆菌属的相对丰度显著高于A组、B组和CK组,而芽孢杆菌是促进植物生长的细菌[4],它不仅对番茄病原菌尖孢镰刀菌和番茄早疫病病菌具有抑制作用,还可产生吲哚-3-乙酸和其他促生长因子,促进离体植物生长[4]。B组、C组中的鞘氨醇单胞菌属、热酸菌属的相对丰度明显高于A组、CK组,其中鞘氨醇单胞菌属细菌作为土壤中的生防菌,有助于抑制病原体入侵,而热酸菌属细菌可促进土壤中的微生物分解有机质、利用碳源[2]。对于真菌,所有处理中的优势属为青霉菌属、Tausonia、毛壳菌属、镰刀菌属、芽枝霉属等,其中青霉菌属、Tausonia、毛壳菌是具有生物防治效果的有益真菌[11],镰刀菌属、芽枝霉属真菌是引起植物病害的主要植物病原菌[6]。镰刀菌是被广泛报道的主要土传病害的病原菌,可引起西洋参褐色根腐病和枯萎病。由此可以看出,在土壤改良中,3种处理方法都有利于有益菌和生防菌相对丰度的增加,但各处理效果有所差异,其中C组最好,A组次之,B组效果较差,主要是由于C组用于改良土壤的微生物菌肥含有益生防菌,在西洋参再植过程中土壤中的青霉菌属等的相对丰度增加,可促进土壤微生物修复。土壤微生物的能量代谢,特别是矿质养分代谢过程,对植物的生长极为关键。同时,参与碳循环的微生物需通过高能量的代谢途径,获得生长所需的营养物质[16]。
4 结论
西洋参连续再植经过土壤修复对土壤微生物群落结构有一定的影响,不同处理方式与空白组之间存在明显差异。对比空白组,在不同处理后的老参田土壤中试剂组细菌和真菌的多样性指数相对较低。此外,不同处理方式短期处理连坐土壤西洋参再植后,处理组中潜在的植物病原真菌和有益细菌表现出协同增加的趋势。相反,在不进行处理的土壤中连续种植西洋参后,土壤中的有益细菌和真菌数量有所减少,推测这2类微生物之间可能存在相互制约的关系。结合棉隆、高锰酸钾化学属性推测,大田试验中棉隆土壤熏蒸、高锰酸钾土壤消毒处理可能在土壤处理初期抑制或杀灭部分有害菌或有益菌,但随着时间的延长试剂挥发或者分解,其抑菌效果逐渐减弱。微生物菌肥可补充土壤有益菌群,微生物菌肥可改善重茬土壤菌群结构及多样性,结合检测菌群丰度与空白组对比可推测随着种植时间的延长需要持续补充菌群以维持再植西洋参正常生长。基于上述结果,推测再植后植物的生长可能取决于致病微生物和有益微生物之间的竞争。然而,致病菌和有益菌是否以及如何相互作用还需要进一步进行研究。
参考文献:
[1]Chen J,Zhou L T,Din I U,et al. Antagonistic activity of Trichoderma spp.against Fusarium oxysporum in rhizosphere of Radix pseudostellariae triggers the expression of host defense genes and improves its growth under long-term monoculture system[J]. Frontiers in Microbiology,2021,12:579920.
[2]孙子欣,蔡柏岩. 连作对土壤微生物菌群影响及修复研究进展[J]. 作物杂志,2022(6):7-13.
[3]Wu H M,Fang C X,Malacrinò A,et al. Editorial:rhizosphere conversation among the plant-plant microbiome-soil under consecutive monoculture regimes[J]. Frontiers in Microbiology,2022,13:1061427.
[4]Liu Q W,Wang S X,Li K,et al. Responses of soil bacterial and fungal communities to the long-term monoculture of grapevine[J]. Applied Microbiology and Biotechnology,2021,105(18):7035-7050.
[5]Xu X J,Luo Q Y,Wei Q C,et al. The deterioration of agronomical traits of the continuous cropping of Stevia is associated with the dynamics of soil bacterial community[J]. Frontiers in Microbiology,2022,13:917000.
[6]刘丽娟,佟爱仔,秦佳梅. 天然阔叶林下不同年生人参根际微生物群落多样性[J]. 吉林农业大学学报,2024,46(2):246-254.
[7]游浩宇,陈大刚,徐开未,等. 不同改良措施对猕猴桃园土壤理化性质变化的影响[J]. 四川农业大学学报,2022,40(6):826-837.
[8]杨艾华. 西洋参栽培过程中土壤微生物群落、养分和酶活性的变化及其相互关系[D]. 西安:陕西师范大学,2017.
[9]刘亮亮. 强还原土壤消毒防控土传病害效果及其微生物学机制研究[D]. 南京:南京师范大学,2019.
[10]Semenov M V,Krasnov G S,Semenov V M,et al. Does fresh farmyard manure introduce surviving microbes into soil or activate soil-borne microbiota?[J]. Journal of Environmental Management,2021,294:113018.[HJ2mm]
[11]聂扬眉,步连燕,陈文峰,等. 高量秸秆还田配施芽孢杆菌对沙化土壤细菌群落及肥力的影响[J]. 环境科学,2023,44(9):5176-5185.
[12]付宽宽,王小兵,汪晓丽,等. 不同改良措施对设施芹菜根际土壤微生物群落结构的影响[J]. 中国瓜菜,202 5(8):42-49.
[13]朱 怡,吴永波,安玉亭. 基于高通量测序的禁牧对土壤微生物群落结构的影响[J]. 生态学报,2022,42(17):7137-7146.
[14]李荣飞,杨仕品,王爱华,等. 不同调控措施对草莓连作大棚土壤微生物群落的影响[J]. 江苏农业科学,2023,51(3):197-204.
[15]闫 宁,战 宇,谢昊臻,等. 不同改土方式对连作人参生长发育的影响[J]. 江苏农业科学,2022,50(6):120-125.
[16]孙鹏洲,罗珠珠,李玲玲,等. 黄土高原紫花苜蓿种植对土壤反硝化细菌群落的影响[J]. 中国生态农业学报(中英文),2023,31(1):67-78.
收稿日期:2023-07-13
基金项目:中央转移支付项目(编号:202219);济南市农业应用技术创新计划(编号:CX202112);山东省科技型中小企业创新能力提升工程(编号:2022TSGC1059);山东省中医药科技发展计划(编号:2021Q125);中央本级重大增减支项目(编号:2060302);国家重点研发计划(编号:2017YFC1701500、2017YFC1701502、2017YFC1701504)。
作者简介:郭瑞齐(1989—),女,山东菏泽人,硕士,助理研究员,从事中药质量与资源研究。E-mail:guoruiqi14@163.com。
通信作者:林慧彬,博士,研究员,从事中药质量与资源研究。E-mail:linhuibin68@163.com。

