稻瘟病拮抗菌短小芽孢杆菌NDY-10的功能特性与全基因组分析
摘要:短小芽孢杆菌(Bacillus pumilus)NDY-10对植物病原菌具有广谱拮抗活性,其中对稻瘟病菌的抑菌率最高。从NDY-10菌株对稻瘟病菌的拮抗特性和全基因组分析2个方面进行研究,结果表明,NDY-10菌株对稻瘟病病菌具有非常强的抑制作用,其无菌发酵液对稻瘟病菌的抑制率可达100%,且与添加量呈正相关。NDY-10菌株无菌发酵液对温度、紫外线辐射不敏感,强酸或强碱会影响其拮抗活性。经3种蛋白酶处理后,NDY-10菌株对稻瘟病病菌的抑制率下降,说明短小芽孢杆菌NDY-10菌株对稻瘟病病菌的拮抗物质是一种蛋白。NDY-10菌株的完整基因组大小为3 736 781 bp(含41.63%的G+C),包括3 893个编码序列(CDS)。从该基因组中鉴定出9条基因簇,其中大部分负责抑制代谢物的合成,并且发现了tasA拮抗基因(801对碱基)。根据之前的研究,推测其为稻瘟病接抗菌NDY-10菌株的关键功能基因。由本研究结果可知,NDY-10菌株可以作为潜在的优秀的生防制剂用于防治稻瘟病。
关键词:短小芽孢杆菌;稻瘟病菌;拮抗作用;生物防治;全基因组
中图分类号:S182;S435.111.4+1 文献标志码:A
文章编号:1002-1302(2024)12-0277-08
水稻是世界上最重要的粮食作物之一,但在生产过程中常常受到各种病虫的危害而造成减产。由稻瘟病病菌引发的稻瘟病是全球范围内最具破坏性的植物病害之一,每年造成的水稻产量损失高达10%~35%[1]。目前常用于防治植物病原菌的方法主要有化学杀菌剂防治法、生物防治剂防治法等。化学杀菌剂的长期过度使用,导致作物对其产生抗药性和并引发了环境污染问题[2]。自20世纪50年代以来,稻瘟病的生物防治方法得到了广泛研究,并取得了明显进展。到目前为止,有利用细菌[3]、真菌[4]和放线菌[5]菌株对稻瘟病进行生物防治的研究报道。其中,芽孢杆菌是研究最多的菌属之一,在抑制多种植物病原菌中发挥着重要作用[6],且其用于生物防治的某些菌株已被商业化应用[7]。短小芽孢杆菌(Bacillus pumilus)是芽孢杆菌属的一员,具有广泛的拮抗活性,是各种植物病原菌拮抗微生物的重要来源[8-12]。据报道,短小芽孢杆菌 64-1 菌株的的全基因组可能包括至少12个潜在的生物合成基因簇,从中发现了细菌素合成的基因,并可能与其抗菌功能相关[12]。短小芽孢杆菌NDY-10已被证实能够抑制土壤芽孢杆菌[13],本研究进一步分析其抑菌功能,利用全基因组分析有助于获得NDY-10菌株的相关拮抗基因。
尽管短小芽孢杆菌菌株在生物防治方面具有巨大的应用潜力,但关于短小芽孢杆菌生物防治稻瘟病的研究却较少,针对短小芽孢杆菌对稻瘟病菌的拮抗基因和拮抗物质的研究也很少。因此,本研究分析短小芽孢杆菌NDY-10对稻瘟病菌的拮抗特性及其全基因组对稻瘟病生物防治具有重要意义。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 短小芽孢杆菌NDY-10由笔者所在实验室分离筛选并保存。供试病原菌菌株包括灰葡萄孢菌(Botrytis cinerea)、禾旋孢腔菌(Cochlioboluss ativus)、大斑凸脐蠕孢菌(Exserohilum turcicum)、禾谷镰刀菌(Fusarium graminearum)、稻瘟病菌(Magnaporthe grisea)、瓜果腐霉病菌(Pythium aphanidermatum)和立枯丝核菌(Rhizoctonia solani),由南京农业大学、沈阳农业大学提供。本试验于2020年3月至2021年5月在内蒙古自治区环境污染控制与废物资源化重点实验室开展。
1.1.2 培养基 (1)LB液体培养基。10 g胰蛋白胨,5 g 酵母提取物,10 g NaCl,补充蒸馏水至 1 000 mL,将pH值调至7.0,在此基础上添加16 g琼脂粉,形成固体培养基。(2)马铃薯葡萄糖琼脂(PDA)培养基。200 g马铃薯,20 g葡萄糖,18 g琼脂粉,补充蒸馏水至1 000 mL,将pH值调至7.0。所有培养基均在121 ℃下灭菌20 min。
1.1.3 主要仪器 ROTINA 380R型高速离心机,北京莱比信科技发展有限公司;LGT-50A型冷冻干燥机,上海贺帆仪器有限公司;EPOCH2TS型酶标仪,美国伯腾仪器有限公司;PHS-2F型pH计,上海仪电科学仪器股份有限公司。
1.2 试验方法
1.2.1 短小芽孢杆菌NDY-10无菌发酵液的制备 将保存于-80 ℃冰箱的NDY-10菌株用接种环在LB培养基上划线活化,在30 ℃恒温条件下培养24 h。将纯化后的单菌落挑取到试管LB液体培养基中,在150 r/min、30 ℃条件下振荡培养12 h。然后,将体积分数为3%种子液转移到新鲜培养基中,在相同条件下于摇床中培养。发酵8 h后,用紫外分光光度计测得菌液D600 nm为1.15。将发酵液摇匀,于4 000 r/min下离心15 min,取上清液,通过0.22 μm细菌滤膜过滤得到无菌发酵液。
1.2.2 短小芽孢杆菌NDY-10拮抗作用的测定 将5 mL短小芽孢杆菌NDY-10无菌发酵上清液倒入灭菌后冷却至50 ℃左右的20 mL PDA培养基中。在固体培养基中心接入直径为6 mm的各供试植物病原菌菌饼,菌丝一面贴近培养基作为试验组。同时,以5 mL的LB液体培养基代替5 mL的无菌发酵上清液作为对照组。所有处理均重复3次。在30 ℃条件下恒温静置培养,待CK组中植物病原菌生长到覆盖整块平板或较大时,用“十”字交叉法测量菌落直径,使用如下公式计算抑菌率:
抑菌率=对照组菌落直径-试验组菌落直径/对照组菌落直径-菌饼直径×100%。
为了确定无菌发酵上清液添加量对稻瘟病菌抑制率的影响,将不同量的短小芽孢杆菌NDY-10的无菌发酵上清液(5.000、2.500、1.250、0.625、0.313 mL,不足5 mL的用空白培养基补足)与 20 mL PDA固体培养基混合(混合比例分别为 1 ∶4、1 ∶8、1 ∶16、1 ∶32、1 ∶64),在平板中心接入稻瘟病菌,观察并记录菌饼生长情况,计算抑菌率。
1.2.3 不同条件下短小芽孢杆菌NDY-10无菌发酵液的拮抗稳定性 测试短小芽孢杆菌NDY-10在不同pH值、温度、紫外线照射时间和蛋白酶处理下无菌发酵液的拮抗稳定性。用1 mol/L HCl、1 mol/L NaOH溶液调节发酵滤液的pH值至3、5、7、9、11,调节对照组无菌滤液的pH值至6.8,不进行酸碱处理。所有样品在4 ℃冰箱中放置20 h后重新调整至初始pH值6.8,通过0.22 μm滤膜过滤,得到相应的无菌滤液。将离心后并过滤得到的无菌滤液样品在4、30、40、60、80、100 ℃的不同温度下处理30 min,再于超净工作台中用紫外灯照射2、4、6、8、10 h,然后于37 ℃恒温水浴中分别用3种100 μg/mL蛋白酶(蛋白酶K、胰蛋白酶、木瓜蛋白酶)酶解2 h。CK组为没有经过处理的无菌发酵液,所有处理组重复3次。
1.2.4 短小芽孢杆菌NDY-10对稻瘟病菌拮抗物质的初步分析 为了提取短小芽孢杆菌NDY-10中可能存在的脂肽类抑菌物质,用6 mol/L HCl调节无菌发酵液的pH值至2.0,产生白色絮状沉淀,在 4 ℃ 冰箱中沉淀过夜。在4 ℃、12 000 r/min下离心10 min,弃上清,沉淀经pH值为2.0的HCl溶液洗涤3次,用无菌水溶解,再将溶液的pH值调至7.0。冷冻干燥后得到的粗提物用无菌水溶解,过滤后测定抑菌效果。
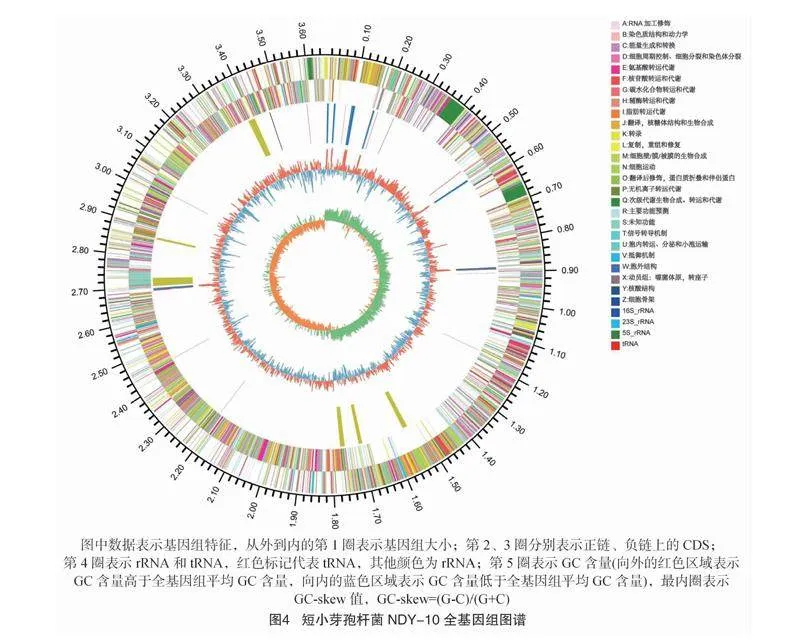
1.2.5 短小芽孢杆菌NDY-10的全基因组测序及组装 使用普洛麦格(北京)生物技术有限公司的试剂盒提取基因组DNA,将质量和浓度合格的基因组DNA用于文库构建和测序(D260 nm/D280 nm=1.8~2.0,DNA总量≥15 μg,DNA浓度≥50 ng/μL)。将样品送至上海美吉生物技术有限公司,使用PacBio RSⅡ和Illumina HiSeq X仪器对全基因组进行PacBio单分子实时DNA测序和Illumina测序。用SOAPdenovo 2.04、unicycler 0.4.8 进行基因组组装,用Circos 0.69软件绘制基因组圈图,从外到内的圆圈依次展示基因组大小、正链上的基因信息、负链上的基因信息、ncRNA、GC含量、GC-Skew。
1.2.6 重复序列分析、基因预测及注释 Tandem Repeats Finder 4.07版软件用于预测基因组中的串联重复序列。基因组中的基因和编码序列(CDS)分别由Gene Marks 4.3和Glimmer 3.02预测。Barrnap 0.8、tRNAscanSE 2.0分别用于预测rRNA、tRNA相关基因。CDS对应的蛋白功能通过BLAST+2.3.0、Diamond 0.8.35、HMMER 3.1等工具进行注释,参考数据库包括NR、Swiss-Prot、Pfam、COG、GO和KEGG等。基因组岛和前噬菌体分别通过IslandPath-DIMOB 1.0.0和PHAST进行预测。此外,使用antiSMASH 4.0(https://antismash.secondarymetabolites.org/#!/start)预测次生代谢物生物合成的基因簇。
1.2.7 稻瘟病菌的抑菌基因分析 将短小芽孢杆菌NDY-10在NCBI上进行基因比对查询,预测与抑制稻瘟病菌相关的基因。
1.2.8 统计分析 每组试验的所有处理至少重复3次。用Excel、SPSS 24.0软件进行方差分析(ANOVA)和显著性分析(α=0.05),并用Duncan's检验比较数据结果。
2 结果与分析
2.1 短小芽孢杆菌NDY-10的抑菌谱
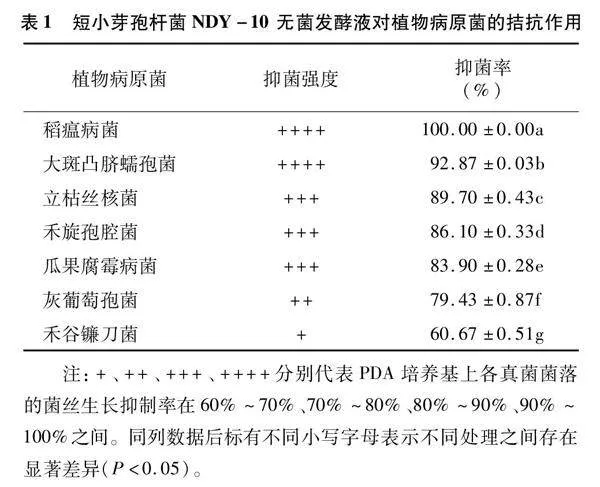
由表1可以看出,短小芽孢杆菌NDY-10的无菌发酵液对多种植物病原菌表现出优良的拮抗作用,尤其是对稻瘟病菌的抑制率达到100%。对稻瘟病菌、大斑凸脐蠕孢菌的拮抗作用较好,抑制率为90%~100%;对立枯丝核菌、禾旋孢腔菌、瓜果腐霉菌的拮抗作用较好,抑制率为80%~90%。尽管在受试菌株中,短小芽孢杆菌NDY-10对禾谷镰刀菌的拮抗作用最差,但抑菌率仍在60%以上。上述结果说明短小芽孢杆菌NDY-10对植物病原菌具有广谱拮抗活性。
2.2 无菌发酵液添加量对稻瘟病菌抑制率的影响
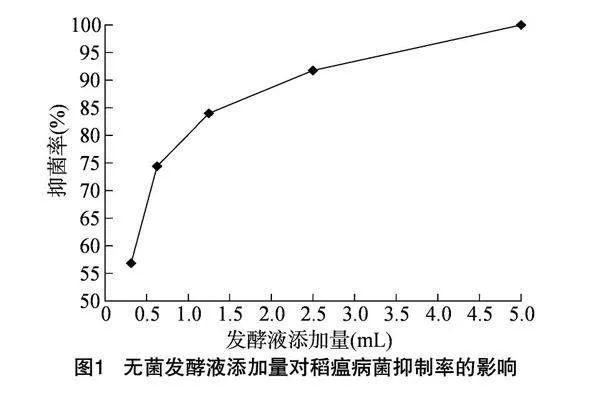
由图1可以看出,当短小芽孢杆菌NDY-10无菌发酵液的添加量为 0.313 mL 时,抑菌率为56.84%;当短小芽孢杆菌 NDY-10 无菌发酵液的添加量为0.625 mL时,抑菌率提高至74.41%;当短小芽孢杆菌NDY-10无菌发酵液添加量为1.250 mL时,抑菌率提高至84.00%;当短小芽孢杆菌NDY-10无菌发酵液的添加量为 2.500 mL时,抑菌率达到91.76%,此时稻瘟病菌的生长几乎暂停;当短小芽孢杆菌NDY-10无菌发酵液的添加量为5.000 mL时,抑菌率达到100.00%,稻瘟病菌的生长完全被抑制。由此可见,抑菌率与发酵液混合液的添加量呈正相关。此外,当发酵液添加量从0.313 mL增加到 0.625 mL 时,抑菌率的增加速度比发酵液添加量为 0.625 mL 以上时更快。
2.3 短小芽孢杆菌NDY-10对无菌发酵液拮抗稳定性的影响
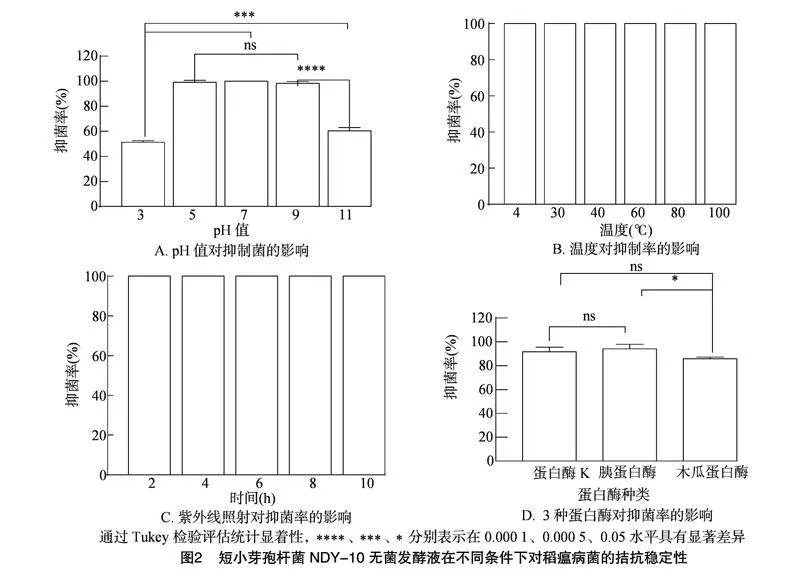
当pH值为5~9时,短小芽孢杆菌NDY-10的无菌发酵液表现出较强的拮抗活性(图2-A)。当短小芽孢杆菌NDY-10的无菌发酵液的pH值为5、7、9时,抑菌率分别为99.17%、100.00%、98.33%,与对照组(pH值为6.8)的100%抑菌率相比保持稳定。然而,当pH值高于9或低于5时,抑菌率迅速下降,即当pH值为3、11时,抑菌率分别为51.25%、60.42%,与对照组相比分别降低48.75、39.58百分点。上述结果说明菌株NDY-10无菌发酵液中的抗真菌物质在强酸或强碱条件下受到较大影响。
短小芽孢杆菌NDY-10的无菌发酵液在4~100" ℃ 温度处理下对稻瘟病菌的抑制率均为100%,表明其抑菌物质对各种温度,特别是高温具有良好的耐受性(图2-B)。随紫外线照射时间的延长,抑菌率保持在100%,与对照组相比没有变化,表明该抗真菌物质对紫外线照射不敏感(图2-C)。
经蛋白酶K、胰蛋白酶、木瓜蛋白酶处理后,无菌发酵液的抑菌率分别为91.67%、94.17%、85.83%,其中木瓜蛋白酶对抑菌作用的影响最大(图2-D)。根据所受蛋白酶的影响,推测短小芽孢杆菌NDY-10产生的针对稻瘟病菌的抑菌物质属于蛋白类物质。此外,通过脂肽提取法制备的粗提取物对稻瘟病菌没有抑制作用,表明其抑菌物质不是脂肽,进一步支持了其为蛋白的假设。
2.4 短小芽孢杆菌NDY-10的基因组特征
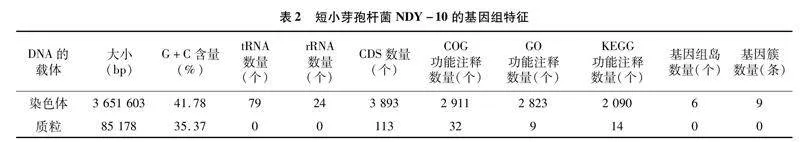
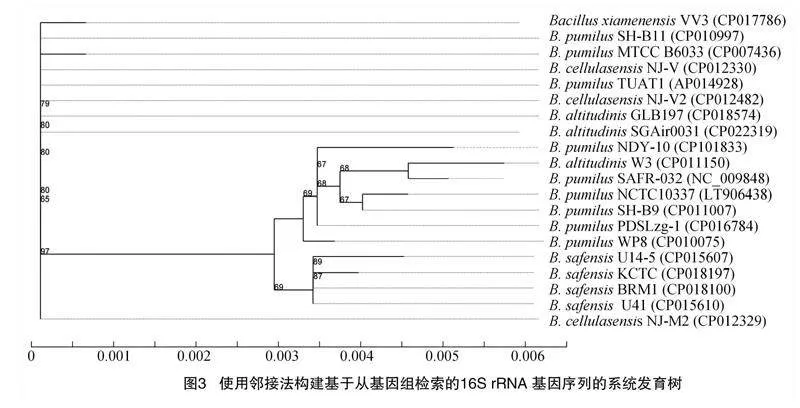
结合3代PacBio RSⅡ平台和2代Illumina获得的测序结果,基因组测序深度为100×。基于从基因组中搜索到的16S rRNA基因序列系统进化树,发现菌株NDY-10属于短小芽孢杆菌(图3)。短小芽孢杆菌NDY-10基因组由1条环形染色体和1个环形质粒组成,总大小为3 736 781 bp。G+C含量为41.63%,基因组包含8个16S rRNA、8个23S rRNA、8个5S rRNA、79个tRNA和3 893个CDS,编码基因总长度为3 280 458 bp。短小芽孢杆菌NDY-10基因组的一般特征如表2所示。基于全基因组特征与全基因组序列相结合绘制基因圈图,从外到内依次为基因组大小、正链、负链上的基因信息、ncRNA、GC含量、GC-Skew(图4)。
2.5 基因预测与功能注释
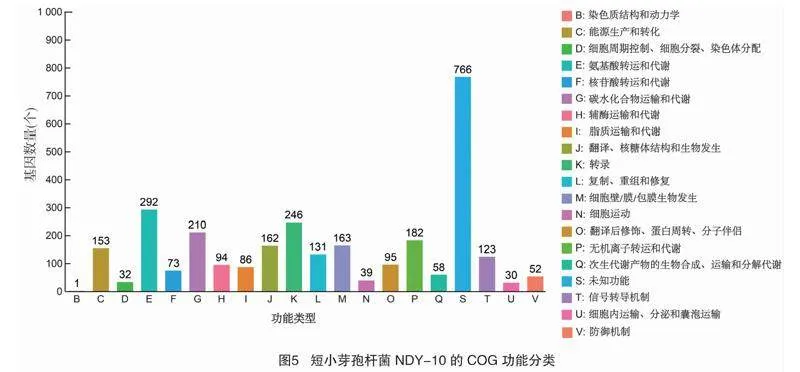
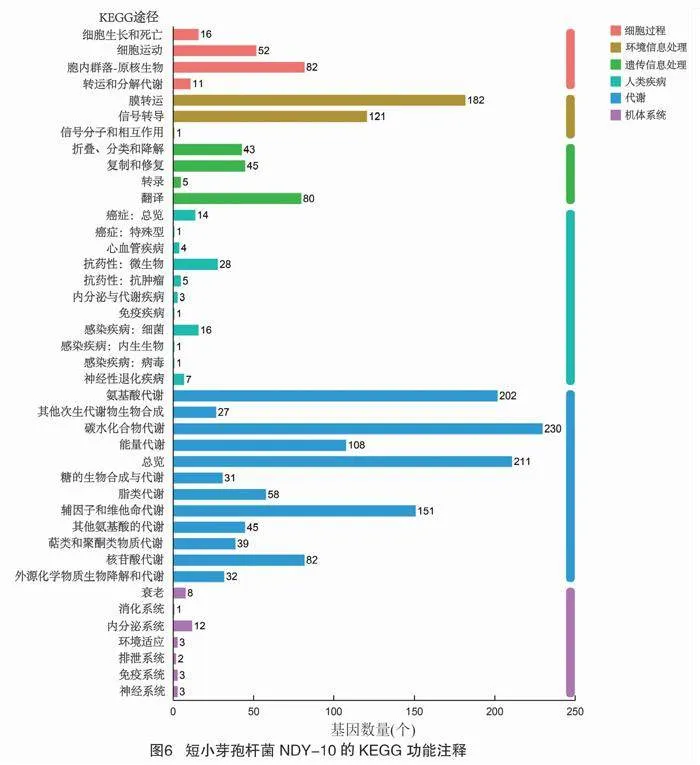
短小芽孢杆菌NDY-10基因组包含18个串联重复序列。如图5所示,根据蛋白序列比对结果在COG数据库中注释到2 943个基因,数量最多的是与氨基酸转运代谢相关的基因,有292个。基因组GO分类统计结果表明,短小芽孢杆菌NDY-10有生物过程、细胞组成和分子功能三大类,分子功能相关的GO 注释结果最多,有2 193个。通过KEGG数据库对短小芽孢杆菌NDY-10基因组进行注释,结果注释到六大类功能区中,包括细胞过程、代谢、人类疾病、遗传信息处理、环境信息处理和机体系统,其中与代谢相关的基因数量最多,达1 216个(图6)。短小芽孢杆菌NDY-10基因组存在9条次级代谢产物基因簇,大部分与非核糖体肽合成酶(non-ribosomal peptide synthetase,NRPS)、聚酮化合物、细菌素、抗菌肽等抑菌物质的合成有关,表明菌株NDY- 10对植物病原菌具有广泛的拮抗活性。
2.6 短小芽孢杆菌NDY-10对稻瘟病菌的拮抗基因
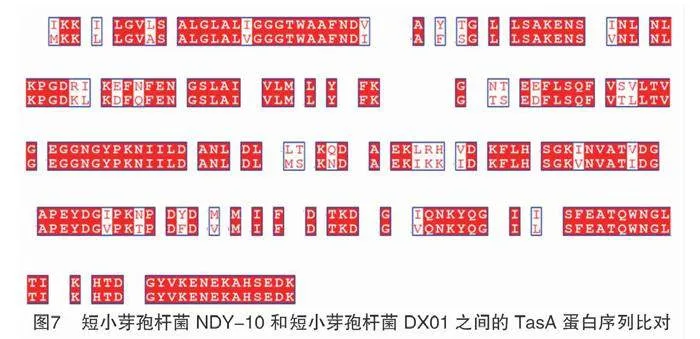
TasA是芽孢杆菌中普遍存在的抑菌蛋白,是一种芽孢结合蛋白,具有广泛的拮抗活性[14]。已有研究结果显示,短小芽孢杆菌DX01的TasA蛋白通过在大肠杆菌中异源表达,对稻瘟病菌表现出高度的拮抗作用[15]。目前已从短小芽孢杆菌NDY-10的编码区发现了1个基因编号为BP2328的tasA基因,位置为2 195 410~2 194 610 bp,编码266个氨基酸。结合之前的结论,得出菌株NDY-10针对稻瘟病发挥抑菌功能的是一种蛋白,并推测其拮抗基因为tasA(801对碱基)。短小芽孢杆菌DX01异源表达的tasA蛋白对稻瘟病菌具有良好的拮抗活性,在短小芽孢杆菌NDY-10中也找到了tasA基因。短小芽孢杆菌NDY-10与短小芽孢杆菌DX01的TasA蛋白一级序列相似度为62.55%,差异如图7所示。
3 结论与讨论
拮抗微生物一直被认为是一种环境友好、经济性好和可持续的生物制剂[16],其中部分拮抗微生物有益于植物生长[17]。芽孢杆菌对多种植物病原菌的拮抗活性使其成为重要的农业生物防治剂[18]。本研究发现,短小芽孢杆菌NDY-10对多种植物病原菌具有显著的拮抗作用,特别是对稻瘟病菌的抑制率达到了100%。但是,目前利用短小芽孢杆菌防治稻瘟病的研究还很少。
先前的研究报道了一些短小芽孢杆菌菌株可用于防治稻瘟病。Sha等从非根际水稻土壤中分离出能够定殖于水稻茎组织的短小芽孢杆菌S9,对稻瘟病菌有很高的抑制率(80%~90%)[19]。在液体改性的BPY培养基中生长72 h后,短小芽孢杆菌 LM-031 的高度拮抗作用使稻瘟病菌抑制区的直径达到22 mm[20]。来自芽孢杆菌属的其他菌株对稻瘟病菌也有很好的抑菌活性。贝莱斯芽孢杆菌(B. velezensis)ZW-10的无菌发酵液对稻瘟病菌的抑制作用与发酵液浓度成正比,其拮抗物质在酸性或高温条件下仍能保持活性。ZW-10无菌发酵液对稻瘟病菌的相对抗抑菌活性最高,为(76.27±3.36)%[21]。解淀粉芽孢杆菌Rdx5分离自白芷中,其抑菌活性与生长状态成正比,当滤液浓度为 66.7 μL/mL 时,无菌发酵液对稻瘟病菌的相对抑制率达55.9%[22]。短小芽孢杆菌NDY-10可以强烈抑制稻瘟病菌菌丝体的生长,抑制率可高达100%,表明该菌株是潜在优良的稻瘟病生防菌。
芽孢杆菌菌株能够产生多种针对植物病原菌的抗菌化合物,包括脂肽(LP)、抗生素和酶,这些化合物通常具有良好的热稳定性和pH值稳定性[17,23-25]。多项研究发现,来自芽孢杆菌的抗菌肽可以作为良好的生防制剂[26]。但是,研究者在制备了针对脂肽的菌株NDY-10粗提物后,发现其对稻瘟病菌并没有抑制作用,表明其抑菌物质不是脂肽。NDY-10 无菌发酵液的拮抗稳定性研究结果表明,发酵液受木瓜蛋白酶、蛋白酶K和胰蛋白酶的影响明显,表明该抑菌物质应为蛋白。
芽孢杆菌菌株能够分泌具有抗真菌特性的蛋白[27-28]。有研究发现,在芽孢杆菌属的几种生防制剂中检测到了与拮抗活性相关的TasA蛋白[14,29]。尽管多种菌株已被证实具有抑制稻瘟病菌的特性,但少见关于其拮抗基因的报道。Wu等从水稻根际土壤中分离出1株莫氏假单胞菌(Pseudomonas mosselii)BS011,它能够显著抑制稻瘟病菌生长,基因缺失试验结果表明,基因簇c-xtl是影响稻瘟病菌活性的关键基因簇[3]。基于对短小芽孢杆菌SG2的2种几丁质酶(ChiS和ChiL)能抑制稻瘟病菌生长的研究,研究者尚未在短小芽孢杆菌NDY-10的基因组中寻找到相应基因。短小芽孢杆菌DX01异源表达的TasA蛋白虽然对稻瘟病菌具有良好的抑制作用,但抑制率未能达到100%。相比之下,短小芽孢杆菌NDY-10可以完全抑制其生长,其TasA蛋白结构引起的拮抗活性差异有待进一步研究。
参考文献:
[1]Asibi A E,Chai Q,Coulter J A. Rice blast:a disease with implications for global food security[J]. Agronomy,2019,9(8):451.
[2]Srivastava D A,Harris R,Breuer G,et al. Secretion-based modes of action of biocontrol agents with a focus on Pseudozyma aphidis[J]. Plants,2021,10(2):210.
[3]Wu L J,Xiao W,Chen G Q,et al. Identification of Pseudomonas mosselii BS011 gene clusters required for suppression of rice blast fungus Magnaporthe oryzae[J]. Journal of Biotechnology,2018,282:1-9.
[4]Ohtaka N,Kawamata H,Narisawa K. Suppression of rice blast using freeze-killed mycelia of biocontrol fungal candidate MKP5111B[J]. Journal of General Plant Pathology,2008,74(2):101-108.
[5]Law J W F,Ser H L,Khan T M,et al. The potential of Streptomyces as biocontrol agents against the rice blast fungus,Magnaporthe oryzae (Pyricularia oryzae)[J]. Frontiers in Microbiology,2017,8:3.
[6]Cawoy H,Debois D,Franzil L,et al. Lipopeptides as main ingredients for inhibition of fungal phytopathogens by Bacillus subtilis/amyloliquefaciens[J]. Microbial Biotechnology,2015,8(2):281-295.
[7]Hassan M N,Namood-E S,Zia-Ul-Husnain Shah S,et al. Suppression of red rot disease by Bacillus sp.based biopesticide formulated in non-sterilized sugarcane filter cake[J]. BioControl,2015,60(5):691-702.
[8]Swadling I R,Jeffries P. Antagonistic properties of two bacterial biocontrol agents of grey mould disease[J]. Biocontrol Science and Technology,1998,8(3):439-448.
[9]Ghasemi S,Ahmadian G,Sadeghi M,et al. First report of a bifunctional chitinase/lysozyme produced by Bacillus pumilus SG2[J]. Enzyme and Microbial Technology,2011,48(3):225-231.
[10]Rishad K S,Rebello S,Shabanamol P S,et al. Biocontrol potential of halotolerant bacterial chitinase from high yielding novel Bacillus pumilus MCB-7 autochthonous to mangrove ecosystem[J]. Pesticide Biochemistry and Physiology,2017,137:36-41.
[11]Sharma A,Kashyap P L,Srivastava A K,et al. Isolation and characterization of halotolerant bacilli from chickpea (Cicer arietinum L.) rhizosphere for plant growth promotion and biocontrol traits[J]. European Journal of Plant Pathology,2019,153(3):787-800.
[12]Freitas-Silva J,de Oliveira B F R,Vigoder F M,et al. Peeling the layers away:the genomic characterization of Bacillus pumilus 64-1,an isolate with antimicrobial activity from the marine sponge Plakina cyanorosea (Porifera,Homoscleromorpha)[J]. Frontiers in Microbiology,2021,11:592735.
[13]李静泉,高 坤,许继飞,等.土壤芽孢杆菌NDD-1及其拮抗菌短小芽孢杆菌NDY-10的分离、鉴定和抑菌特性[J]. 江苏农业科学,2017,45(15):91-95.
[14]Yin X T,Xu L N,Xu L,et al. Evaluation of the efficacy of endophytic Bacillus amyloliquefaciens against Botryosphaeria dothidea and other phytopathogenic microorganisms[J]. African Journal of Microbiology Research,2011,5(4):340-345.. [HJ2mm]
[15]刘 通,陈云鹏,李琼洁,等. 短小芽胞杆菌抑菌蛋白tasA基因克隆及功能分析[J]. 上海交通大学学报(农业科学版),2014,32(5):48-52,56.
[16]Tariq M,Khan A,Asif M,et al. Biological control:a sustainable and practical approach for plant disease management[J]. Acta Agriculturae Scandinavica(Section B:Soil amp; Plant Science),2020,70(6):507-524.
[17]ben Abdallah D,Frikha-Gargouri O,Tounsi S. Rizhospheric competence,plant growth promotion and biocontrol efficacy of Bacillus amyloliquefaciens subsp. plantarum strain 32a[J]. Biological Control,2018,124:61-67.
[18]Shafi J,Tian H,Ji M S. Bacillus species as versatile weapons for plant pathogens:a review[J]. Biotechnology amp; Biotechnological Equipment,2017,31(3):446-459.
[19]Sha Y X,Zeng Q C,Sui S T.Screening and application of Bacillus strains isolated from nonrhizospheric rice soil for the biocontrol of rice blast[J]. The Plant Pathology Journal,2020,36(3):231-243.
[20]Zhang W J,Guo P,Liu M,et al. Isolation,identification,and optimal cultivation of a marine bacterium antagonistic to Magnaporthe grisea[J]. Genetics and Molecular Research,2016,15(2):15028646.
[21]Chen Z,Zhao L,Chen W Q,et al. Isolation and evaluation of Bacillus velezensis ZW-10 as a potential biological control agent against Magnaporthe oryzae[J]. Biotechnology amp; Biotechnological Equipment,2020,34(1):714-724.
[22]Dong Y L,Li H,Rong S H,et al. Isolation and evaluation of Bacillus amyloliquefaciens Rdx5 as a potential biocontrol agent against Magnaporthe oryzae[J]. Biotechnology amp; Biotechnological Equipment,2019,33(1):408-418.
[23]Ali G S,El-Sayed A S A,Patel J S,et al. Ex vivo application of secreted metabolites produced by soil-inhabiting Bacillus spp.efficiently controls foliar diseases caused by Alternaria spp[J]. Applied and Environmental Microbiology,2015,82(2):478-490.
[24]Ma Z W,Zhang S Y,Sun K,et al. Identification and characterization of a cyclic lipopeptide iturin A from a marine-derived Bacillus velezensis 11-5 as a fungicidal agent to Magnaporthe oryzae in rice[J]. Journal of Plant Diseases and Protection,2020,127(1):15-24.
[25]Zhu Z Y,Peng Q,Man Y L,et al. Analysis of the antifungal properties of Bacillus velezensis B-4 through a bioassay and complete-genome sequencing[J]. Frontiers in Genetics,2020,11:703.
[26]Dehghanifar S,Keyhanfar M,Emtiazi G. Production and partial purification of thermostable bacteriocins from Bacillus pumilus ZED17 and DFAR8 strains with antifungal activity[J]. Molecular Biology Research Communications,2019,8(1):41-49.
[27]Liu Y F,Chen Z Y,Ng T B,et al. Bacisubin,an antifungal protein with ribonuclease and hemagglutinating activities from Bacillus subtilis strain B-916[J]. Peptides,2007,28(3):553-559.
[28]Zhu H M,Pan Y Z. A novel antimicrobial protein of the endophytic Bacillus amyloliquefaciens and its control effect against Fusarium chlamydosporum[J]. BioControl,2019,64(6):737-748.
[29]Zhu J X,Tan T M,Shen A R,et al. Biocontrol potential of Bacillus subtilis IBFCBF-4 against Fusarium wilt of watermelon[J]. Journal of Plant Pathology,2020,102(2):433-441.
收稿日期:2023-07-18
基金项目:内蒙古自治区自然科学基金(编号:2018MS03074、2022MS03049)。
作者简介:魏浩卓(1998—),女,内蒙古通辽人,硕士研究生,研究方向为环境微生物学。E-mail:wee74893@163.com。
通信作者:李静泉,博士,讲师,研究方向为环境微生物学。E-mail:ljq198327@163.com。

