山顶、山腰、山脚茶园土壤细菌群落结构及功能预测分析

摘要:为探明豫南山地茶园山顶、山腰、山脚茶园土壤理化性质及细菌群落特征,同时探究土壤细菌与土壤环境因子的相关性,以信阳市浉河区山地茶园为研究对象,利用高通量测序技术,研究山顶、山腰、山脚茶园土壤细菌的群落结构及多样性,以及土壤微生物功能特点,并开展土壤微生物与环境因子的RDA冗余分析。结果表明,山脚茶园土壤中细菌丰富度显著高于山顶和山腰;山脚土壤中细菌物种多样性显著高于山顶,与山腰土壤中细菌多样性没有显著差异;山脚茶园土壤中细菌群落多样性高于山顶。山体不同位置,在门水平上的组成和相对丰度存在差异,其中山顶茶园土壤变形菌门、放线菌门、髌骨菌等相对丰度高于山腰、山脚,而山腰、山脚茶园土壤细菌相对丰度相似。山顶、山腰、山脚茶园土壤细菌在属分类水平上的组成和相对丰度均存在差异。其中,酸杆菌属相对丰度为山顶(4.48%)gt;山腰(2.91%)gt;山脚(1.08%),而山腰和山脚处土壤中苔藓杆菌属的相对丰度分别为2.44%和2.51%,其相对丰度是山顶的2倍左右。山顶、山腰、山脚茶园土壤细菌菌群功能不存在显著差异。土壤微生物最主要的功能是新陈代谢,其次是环境信息处理。山顶、山腰和山脚茶园土壤细菌功能类型存在差异,山顶茶园具有化学异养型、好氧化学异养型、纤维素分解的细菌相对丰度高于山脚;山脚处掠食性或外寄生性型、细胞内寄生虫、人类病原体、硝酸盐还原型、光异养型细菌相对丰度高于山顶。固氮作用的细菌则以山腰处相对丰度最高。
关键词:茶园;山体位置;土壤细菌;群落结构;功能预测分析
中图分类号:S571.106.1 文献标志码:A
文章编号:1002-1302(2024)12-0239-06
茶树是我国热带、亚热带重要的经济作物,为多年生常绿植物,不仅是茶叶生产的鲜叶原料,还具有促进文化旅游的功能。河南省信阳市是我国重要的产茶市,是江北茶区最大的茶叶产区,茶园面积为14万hm2,所产信阳毛尖茶为我国十大名茶之一。环境对茶叶品质影响较大,自古有“高山云雾出好茶”的说法,土壤是茶树吸收养分、水分以及生长发育的必要场所,土壤环境的优劣对茶叶品质和产量有直接或间接的影响[1]。土壤微生物是土壤生态系统中不可或缺的关键组成部分,其在土壤的形成与发育、有机物质及养分分解与转化的过程中扮演着重要角色[2-4]。有研究发现,海拔梯度、土壤温湿度、土壤理化性质及酶活性的变化,会影响土壤的呼吸、土壤生态系统的能量流动与物质循环和土壤微生物代谢功能,造成土壤中细菌群落结构和功能的差异[5]。Bryant等研究表明,在落基山脉,随着海拔高度的升高,土壤微生物多样性呈下降趋势[6],而Singh等的研究却表明,在富士山,土壤微生物的功能多样性随海拔的升高展现出单峰模型的变化趋势[7]。这些研究结果表明,海拔对土壤微生物的影响可能会因地理位置和生态系统的不同而有所差异。对于种植在山体不同位置的茶树而言,其根系周围的土壤微生物组成及分布情况也会有所不同。郑雪芳等开展福建省不同海拔(525、603、717、834 m)的铁观音茶园微生物群落多样性研究,发现不同海拔茶树根系土壤中细菌、真菌、放线菌分布量明显不同,而茶树的生长不仅受海拔高度的影响,茶树所在位置对茶树的影响也非常重要,如山顶、山腰、山脚处所受光照、风向、降雨及水分流动、空气湿度等均不相同,茶园小气候必然有所差异[8]。茶山不同位置土壤养分也存在差异,山顶处的碳氮养分状况优于山脚处。豫南茶区茶园以山地、丘陵为主,开展山体茶园不同位置土壤养分及微生物群落多样性研究有重要意义[9]。目前,已有关于不同海拔茶园土壤养分及土壤微生物多样性研究,而关于北方茶区茶园山顶、山腰、山脚土壤细菌多样性及群落结构特点的研究还未见报道。基于此,本研究以豫南山地茶园山顶、山腰、山脚土壤为研究对象,采用Illumina MiSeq高通量测序技术,对山顶、山腰、山脚茶园土壤化学性质及细菌的群落结构及功能特点进行分析,探讨山顶、山腰、山脚茶园土壤细菌群落结构及功能特点,以期对山区茶园管理及生态茶园建设提供科学的理论指导。
1 材料与方法
1.1 试验区概况及样品采集
供试茶园位于信阳市浉河区浉河港乡龙潭村文新茶村生态茶园,该地为信阳毛尖茶的核心产区之一,茶树品种为信阳群体种,此处茶园多为海拔低于200 m的山坡茶园,供试茶山海拔185 m,山体坡度约35°,选取山顶(xin yang shan ding,XYSD)海拔高度为185 m、山腰(xin yang shan yao,XYSY)海拔高度140 m、山脚(xin yang shan jiao,XYSJ)海拔高度96 m为采样点,采样点均为阳坡,除海拔高度外,其他生态条件及茶园管理方式相似。于2023年11月,对供试茶园土壤进行采集,每个采样点设置3个重复,均采用五点取样法,去除表层腐殖层后,采集0~20 cm土层土壤,采样时避开施肥沟,并贴近茶树根部取样,采集约 1 kg 混合土样装于无菌自封袋,采用冷藏条件带回实验室中进行分析。
1.2 土壤DNA提取、PCR扩增及高通量测序
土壤基因组DNA的提取采用试剂盒进行,纯化后的DNA分装并保存在-80 ℃冰箱中备用。使用细菌16S rRNA通用引物338F 5′-ACTCCTACGGGAGGCAGCA-3′和806R 5′-GGACTACHVGGGTWTCTAAT-3′对供试样品进行PCR扩增。扩增后PCR产物经回收纯化后利用Illumina HiSeq 2500高通量测序平台测序。使用北京百迈客云科技有限公司云平台进行数据处理和根际土壤细菌多样性分析。
1.3 数据统计与分析
数据录入及方差分析基于SPSS 22.0和Excel 2010软件进行。采用Trimmomatic v0.33软件对测序的数据进行筛选、过滤;使用UCHIME V4.2软件去除样品序列中的嵌合体序列,得到最终有效数据文件。利用QIIME软件绘制群落结构图及丰度表。用Canoco 5.0软件进行环境因子与微生物群落冗余分析(redun dancy analysis,RDA)。供试土壤样品的Alpha多样性指数使用QIIME 2软件进行评估;Beta多样性(beta diversity)分析使用QIIME软件进行评估,利用基于Bray-Curtis加权PCoA方法分析不同样品间的群落多样性。利用KEGG(京都基因与基因组百科全书)数据库对测序数据进行比对,使用PICRUSt2开展细菌群落一级功能预测,细菌群落生态功能预测利用faprotax程序进行。组间差异显著性分析采用ANOVA方差分析。
2 结果与分析
2.1 山顶、山腰和山脚茶园土壤细菌多样性分析
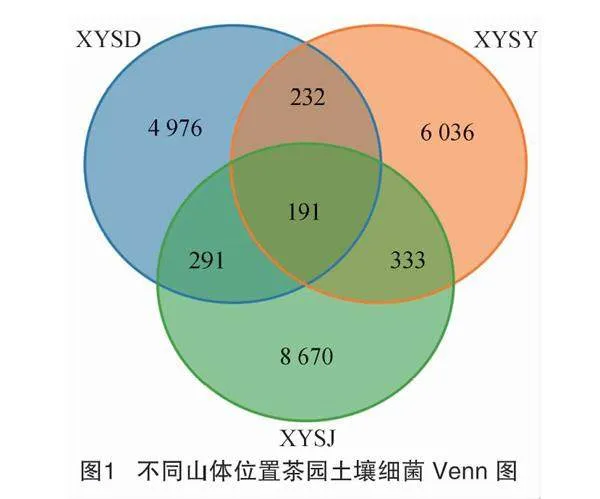
山顶、山腰、山脚土壤获得的细菌OTU数分别为2 089、2 380、3 383个。所测生物序列覆盖度达99.96%~99.99%,表明测序结果囊括了供试土壤样本中绝大多数细菌的生物学信息,能准确反映茶树根际土壤细菌群落结构及多样性特点。使用Venn图分析山顶、山腰、山脚茶园土壤共有和特有的OTUs,如图1所示,山顶、山腰、山脚茶园土壤共有的细菌OTUs为191个,细菌山腰和山脚共有OTUs最多,山顶和山腰共有OTUs最少,而山脚土壤中特有OTUs最多,山顶最少。
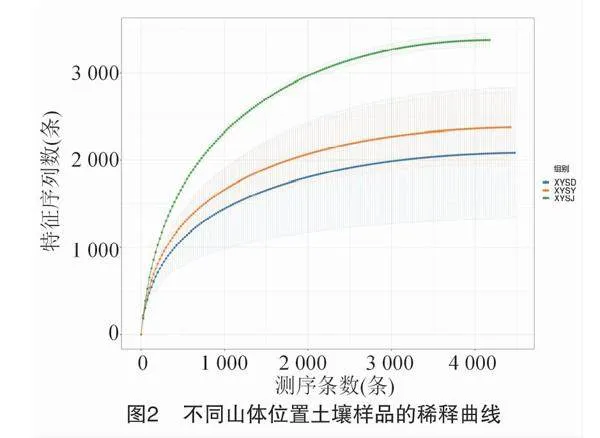
由图2可知,供试茶园土壤测序数据的稀释曲线表明,随着样品测序数量的增多,OTUs数量的增加越来越缓慢,曲线逐渐趋于平缓,因此,测序深度能够反映供试样品土壤中的全部微生物,能反映样品中的物种多样性。
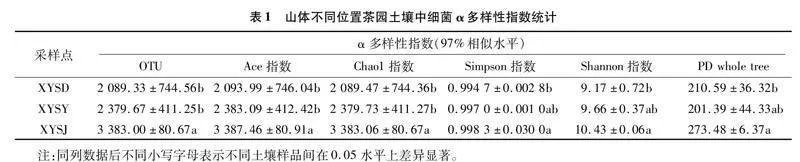
由表1可知,对于细菌而言,山脚土壤Ace指数和Chao1指数均显著高于山顶和山腰, 说明山脚茶园土壤中细菌的丰富度显著高于山顶和山腰;而山脚茶园土壤中Shannon指数和Simpson指数显著高于山顶,与山腰没有显著性差异,说明山脚土壤中细菌物种多样性显著高于山顶,与山腰土壤中细菌多样性没有显著差异;PD whole tree数值越大,表明群落多样性越高,表1数据说明山脚茶园土壤中细菌群落多样性显著高于山顶。
2.2 PCoA分析
PCoA分析土壤细菌群落β多样性差异结果(图3)表明,山顶、山腰和山脚茶园土壤中细菌组成存在一定的分离趋势,且各组间的差异性显著大于组内的差异性,表明山顶、山腰、山脚茶园土壤中细菌群落结构存在极显著差异(r2=0.378;P=0.001)。山顶和山腰之间的样品存在少量聚集在一起,并明显与山脚样品分开,说明山顶与山腰细菌群落结构相似性大。
2.3 群落差异分析
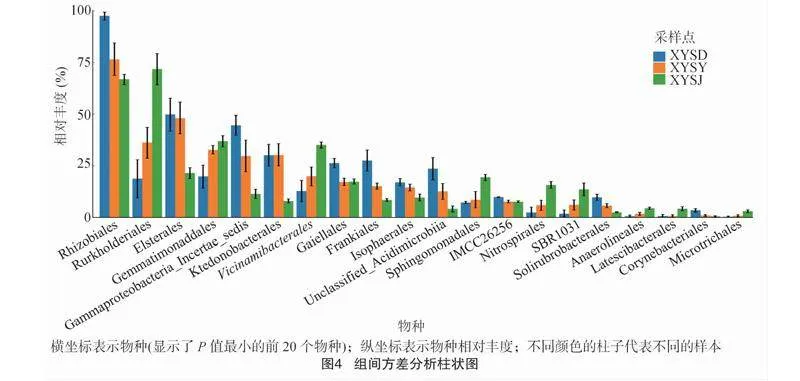
采用ANOVA(方差分析)开展山顶、山腰、山脚茶园土壤组间细菌差异显著性分析,图4显示了差异显著性大的前20个物种,发现各组间根瘤菌目(Rhizobiales)、伯克氏菌目(Burkholderiales)、Elsterales、芽单胞菌目(Gemmatimonadales)、Gammaproteobacteria_Incertae_Sedis、纤线杆菌目(Ktedonobacterales)、硫黄球菌属(Vicinamibacterales)、弗兰克氏菌目(Frankiales)、球菌目(Isosphaerales)等相对丰度均表现出显著差异,其中,山顶茶园土壤中根瘤菌目、Gammaproteobacteria_Incertae_Sedis、弗兰克氏菌目、unclassified_Acidimicrobiia相对丰度显著高于山腰和山脚,而伯克氏菌目、芽单胞菌目、硫黄球菌属等相对丰度显著低于山腰和山脚。山顶、山腰、山脚茶园土壤组间细菌差异显著。
2.4 土壤微生物的群落组成及物种分布
2.4.1 土壤细菌门水平上的群落组成
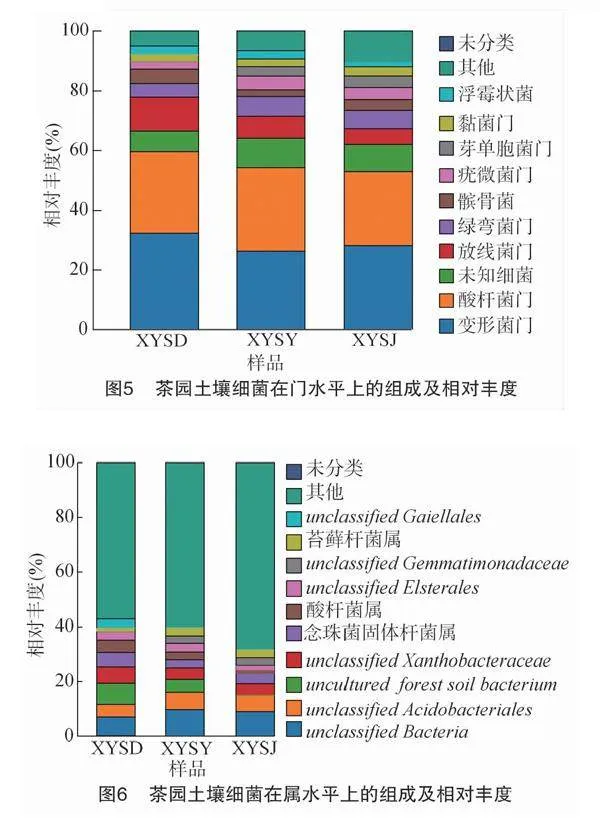
供试茶园根际土壤细菌测序所获得的20 729个OTUs隶属于41门、102纲、266目、530科、913属。如图5所示,在门水平上,变形菌门(Proteobacteria)、未知细菌(unclassified_Bacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、髌骨菌(Patescibacteria)、疣微菌门(Verrucomicrobia)、黏菌门(Myxococcota)、芽单胞菌门(Gemmatimonadetes)、浮霉状菌(Planctomycetes)相对丰度排名前10,其中变形菌门、酸杆菌门丰度最高,为优势菌门。山体不同位置,在门水平上的组成和相对丰度存在差异,其中山顶茶园土壤变形菌门、放线菌门、髌骨菌等相对丰度高于山腰、山脚,山腰和山脚绿弯菌门、疣微菌门相对丰度高于山顶,且山腰、山脚茶园土壤细菌相对丰度相似。
2.4.2 土壤细菌在属水平上的群落组成
由图6可知,在属分类水平上,供试样品共检测出913个属的土壤细菌,其中相对丰度最高的10个类群包括unclassified_Bacteria、unclassified_Acidobacteriales、uncultured_forest_soil_bacterium、unclassified_Xanthobacteraceae、念珠菌固体杆菌属(Candidatus_Solibacter)、不动杆菌属(Acidibacter)、unclassified_Elsterales、unclassified_Gemmatimonadaceae、苔藓杆菌属(Bryobacter)、unclassified_Gaiellales。山顶、山腰、山脚茶园土壤细菌在属分类水平上的组成和相对丰度均存在差异。其中,酸杆菌属相对丰度为山顶(4.48%)gt;山腰(2.91%)gt;山脚(1.08%),而山腰和山脚处土壤中苔藓杆菌属的相对丰度分别为2.44%和2.51%,其相对丰度是山顶的2倍左右。
2.5 土壤细菌功能预测
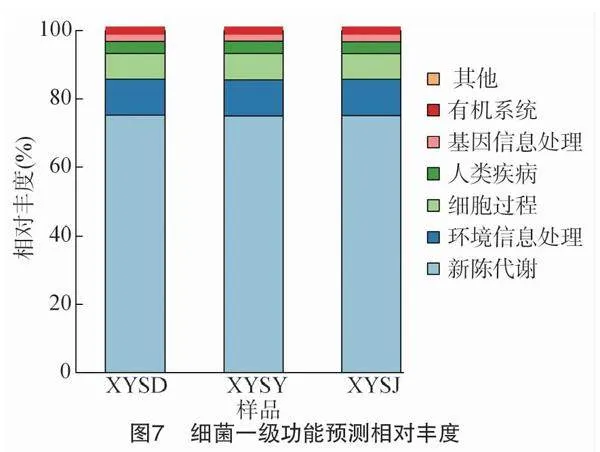
开展基于tax4fun的细菌菌群一级功能预测,利用KEGG数据库对测序数据进行比对,发现供试样本共涉及可识别生物代谢通路6类(图7),包括新陈代谢、环境信息处理、细胞过程、人类疾病、基因信息处理、有机系统、其他。其中,新陈代谢为最主要的功能,其次是环境信息处理功能,然后依次是细胞过程、人类疾病、基因信息处理、有机系统等功能。山顶、山腰、山脚茶园土壤细菌菌群功能不存在显著差异。
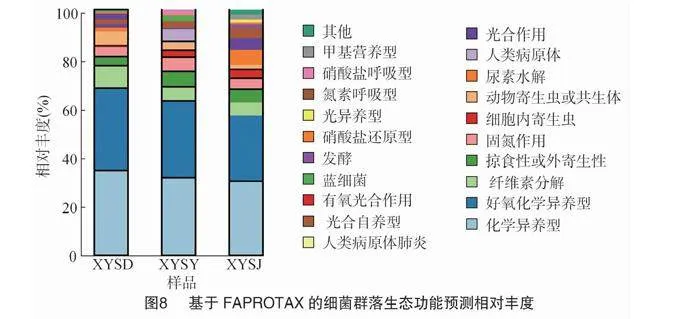
基于FAPROTAX软件平台的细菌群落生态功能预测,共发现52种代谢功能,图8显示了相对丰度前20位的生态功能,其中以化学异养型(相对丰度为30.27%~34.66%)、好氧化学异养型(相对丰度为28.64%~33.47%)、纤维素分解型(相对丰度1.21%~9.03%)、掠食性或外寄生性型(相对丰度3.70%~7.59%)、固氮作用(相对丰度4.31%~5.89%)相对丰度最高,相对丰度前10位的按相对丰度从高到低分别为细胞内寄生虫、动物寄生虫或共生体、尿素水解、全部人类病原体、光合作用等生态功能。其中,化学异养型、好氧化学异养型、纤维素分解、蓝细菌均表现为山顶gt;山腰gt;山脚;掠食性或外寄生性型、细胞内寄生虫、人类病原体、硝酸盐还原型、光异养型等表现为山脚gt;山腰gt;山顶。固氮作用的细菌则以山腰处相对丰度最高。
3 讨论与结论
土壤是茶树赖以生存、获取水分以及养分的场所,茶园生态环境、茶园地形和地势、茶园管理方式等对土壤有重要影响[10-12]。土壤微生物是形成土壤及土壤养分转化的驱动力,其种类及物种多样性是评估土壤肥力状况及土壤质量的重要生物学指标[13]。大量研究发现,茶根际微生物群落具有较高的多样性[14-16]。我国茶园多为山地或丘陵茶园,信阳茶园也以山地为主,其中车云山、天云山、集云山、连云山、云雾山以及黑龙潭、白龙潭、何家寨等八大名山茶园所产信阳毛尖茶品质最优。有研究表明,海拔高度、坡位坡向等对茶园土壤养分以及土壤微生物群落结构有一定的影响,不同海拔、不同坡位茶园土壤细菌、真菌存在差异[8,17]。
一般而言,山顶、山腰、山脚均有茶园分布,而山体不同位置茶园小气候不同,特别是坡面土壤中养分会随降雨进行再分配,此过程会造成山顶、山腰和山脚土壤理化及微生物的分布发生改变[18]。本研究中山脚茶园土壤中细菌的丰富度显著高于山顶和山腰,山脚茶园土壤中细菌物种多样性显著高于山顶,与山腰土壤中细菌多样性没有显著差异。王峰等研究表明,从坡面尺度上看,茶园土壤细菌多样性最高的是山体的中坡位[17],这与本研究中的结果略有不同,这可能与茶园坡度、所在茶区、管理方式等有关,这些因素均是微生物变化的重要因素[18]。
土壤微生物群落结构、丰度及其多样性水平对维持土壤生态系统可持续发展至关重要[19]。茶园土壤微生物能够在一定程度上促进土壤有机质分解和矿物质循环、增加茶园土壤肥力、改善土壤微生态等[20]。细菌作为土壤微生物的重要组成部分,占微生物总量的70%~90%,细菌群落组成对土壤理化性质有重要影响[21-22]。本研究中山顶、山腰、山脚茶园土壤细菌群落组成及相对丰度均存在差异,山顶和山腰细菌群落存在交集,他们相对更相似,这可能是山顶受降雨和养分再分配与山腰、山脚等坡面不同造成的。在门水平物种组成上,本研究中山顶、山腰和山脚茶园土壤中相对丰度最高的均为变形菌门和酸杆菌门,且2个菌门的相对丰度合计均超过70%,为优势菌,王峰等对福建山区茶园细菌群落分析发现,相对丰度最高的为绿弯菌门、放线菌门、变形菌门和酸杆菌门,这与本研究不同,可能与茶园所处的气候条件、土壤条件及茶园管理方式不同有关[17]。在属分类水平上,山顶、山腰、山脚茶园土壤细菌的组成和相对丰度均存在差异,其中,山顶土壤中酸杆菌属相对丰度高于山腰,而山腰又高于山脚,但山腰和山脚土壤中苔藓杆菌属的相对丰度高于山顶。
土壤细菌群落功能组成受种植模式、土壤养分水平等影响[23],此外,土壤微生物种类会受到植物根系分泌物的影响,植物的根与微生物间相互作用,从而增加了微生物的多样性,同时土壤微生物群落功能也会影响土壤养分[24-26]。本研究采用PICRUSt2软件平台中的KEGG代谢途径对山顶、山腰和山脚处茶园土壤中细菌群落的功能进行预测,发现茶园土壤细菌群落功能涉及6个代谢通路,包括新陈代谢、细胞过程、环境信息处理等,其中代谢功能占比70%以上,表明新陈代谢功能对茶园土壤细菌生长起着至关重要的作用,这一结果与前人研究成果[17,24]一致。山顶、山腰、山脚茶园土壤细菌菌群此类功能不存在显著差异。从细菌群落生态功能上看,山顶茶园以化学异养型、纤维素分解相对丰度高,此类细菌参与土壤中有机质、不溶矿质元素的水解等作用密切相关[27-28]。而山脚处掠食性或外寄生性、细胞内寄生虫、人类病原体、硝酸盐还原型、光异养型等细菌相对丰度高,此类细菌可能具有抗病作用、将硝酸盐还原为亚硝酸盐、氨或氮气等作用,对茶园既有益,也可能有害,如抗病作用能够提高茶树抗病性;茶树属于喜铵耐铵型植物,对铵态氮吸收利用能力远强于硝态氮[12],细菌将硝酸盐转化为氨,溶于水或进一步转化更有利于茶树吸收,而转化为氮气则会减少茶园土壤中的氮元素含量[29]。当然此方法获得的细菌功能特征只是预测,要想获得实际的细菌群落功能特点,需要结合转录组学、代谢组学和蛋白质组学等组学技术[30]。
综上,山顶、山腰和山脚茶园土壤细菌群落结构及其多样性均存在差异。其中,山脚茶园土壤中细菌的丰富度和多样性均高于山顶。山顶、山腰和山脚茶园土壤均以变形菌门、酸杆菌门为主,相对丰度超过50%,为优势菌。山顶以变形菌门、放线菌门相对丰度高于山腰和山脚,山腰和山脚土壤中绿弯菌门、疣微菌门相对丰度高于山顶,而山腰、山脚茶园土壤细菌相对丰度相似。山顶、山腰、山脚茶园土壤细菌在属分类水平上的组成和相对丰度均存在差异。山顶、山腰、山脚茶园土壤细菌菌群功能不存在显著差异。
参考文献:
[1]陈玉真,王 峰,吴志丹,等. 林地转变为茶园对土壤细菌群落结构与多样性的影响[J]. 西北农林科技大学学报(自然科学版),2020,48(4):97-106.
[2]Ramakrishna W,Yadav R,Li K F. Plant growth promoting bacteria in agriculture:two sides of a coin[J]. Applied Soil Ecology,2019,138:10-18.
[3]Teng Y,Wang X M,Li L N,et al. Rhizobia and their bio-partners as novel drivers for functional remediation in contaminated soils[J]. Frontiers in Plant Science,2015,6:32.
[4]范瑞英,杨小燕,王恩姮,等. 黑土区不同林龄落叶松人工林土壤微生物群落功能多样性的对比研究[J]. 北京林业大学学报,2013,35(2):63-68.
[5]赵盼盼,周嘉聪,林开淼,等. 海拔梯度变化对中亚热带黄山松土壤微生物生物量和群落结构的影响[J]. 生态学报,2019,39(6):2215-2225.
[6]Bryant J A,Lamanna C,Morlon H,et al. Microbes on mountainsides:contrasting elevational patterns of bacterial and plant diversity[J]. Proceedings of the National Academy of Sciences of the United States of America,2008,105(S1):11505-11511.
[7]Singh D,Takahashi K,Kim M,et al. A hump-backed trend in bacterial diversity with elevation on mount Fuji,Japan[J]. Microbial Ecology,2012,63(2):429-437.
[8]郑雪芳,苏远科,刘 波,等. 不同海拔茶树根系土壤微生物群落多样性分析[J]. 中国生态农业学报,2010,18(4):866-871.
[9]胡志娥,肖谋良,王 双,等. 地膜覆盖对农田土壤养分和生态酶计量学特征的影响[J]. 环境科学,2022,43(3):1649-1656.
[10]鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社,2000.
[11]彭金根,龚金玉,范玉海,等. 毛棉杜鹃根际与非根际土壤微生物群落多样性[J]. 林业科学,2022,58(2):89-99.
[12]骆耀平. 茶树栽培学[M]. 5版.北京:中国农业出版社,2015.
[13]Bossio D A,Fleck J A,Scow K M,et al. Alteration of soil microbial communities and water quality in restored wetlands[J]. Soil Biology and Biochemistry,2006,38(6):1223-1233.
[14]Bag S,Mondal A,Banik A. Exploring tea (Camellia sinensis) microbiome:insights into the functional characteristics and their impact on tea growth promotion[J]. Microbiological Research,2022,254:126890.
[15]Xie H T,Feng X X,Wang M C,et al. Implications of endophytic microbiota in Camellia sinensis:a review on current understanding and future insights[J]. Bioengineered,2020,11(1):1001-1015.
[16]Wu Z Z,Su Q Q,Cui Y C,et al. Temporal and spatial pattern of endophytic fungi diversity of Camellia sinensis (cv.Shu Cha Zao)[J]. BMC Microbiology,2020,20(1):270.
[17]王 峰,陈玉真,吴志丹,等. 种植模式和坡位对茶园土壤细菌群落结构及功能类群的影响[J]. 生态学报,2022,42(20):8435-8452.
[18]姚雪玲,傅伯杰,吕一河. 黄土丘陵沟壑区坡面尺度土壤水分空间变异及影响因子[J]. 生态学报,201 2(16):4961-4968.
[19]Saleem M,Hu J,Jousset A. More than the sum of its parts:microbiome biodiversity as a driver of plant growth and soil health[J]. Annual Review of Ecology,Evolution,and Systematics,2019,50:145-168.
[20]周才碧,陈文品. 茶园土壤微生物的研究进展[J]. 中国茶叶,2014,36(3):14-15.
[21]Delgado-Baquerizo M,Maestre F T,Reich P B,et al. Microbial diversity drives multifunctionality in terrestrial ecosystems[J]. Nature Communications,2016,7:10541.
[22]Zhu Y G,Zhao Y,Zhu D,et al. Soil biota,antimicrobial resistance and planetary health[J]. Environment International,2019,131:105059.
[23]王 悦,杨贝贝,王 浩,等. 不同种植模式下丹参根际土壤微生物群落结构变化[J]. 生态学报,2019,39(13):4832-4843.
[24]王莉莉,殷丛培,李 峰,等. 马铃薯根际土壤细菌群落结构及其对干旱胁迫的响应[J]. 中国农业科技导报,2022,24(6):58-69.
[25]连文慧,董 雷,李文均. 土壤环境下的根际微生物和植物互作关系研究进展[J]. 微生物学杂志,2021,41(4):74-83.
[26]Chen Y X,Fu W J,Xiao H,et al. A review on rhizosphere microbiota of tea plant (Camellia sinensis L):recent insights and future perspectives[J]. Journal of Agricultural and Food Chemistry,2023,71(49):19165-19188.
[27]丁钰珮,杜宇佳,高广磊,等. 呼伦贝尔沙地樟子松人工林土壤细菌群落结构与功能预测[J]. 生态学报,2021,41(10):4131-4139.
[28]杨 盼,翟亚萍,赵 祥,等. 丛枝菌根真菌和根瘤菌互作对苜蓿根际土壤细菌群落结构的影响及PICRUSt功能预测分析[J]. 微生物学通报,2020,47(11):3868-3879.
[29]何 帅,王国栋,张 磊. 生物炭和氮肥互作对盐渍化土壤氨挥发的影响[J]. 灌溉排水学报,2023,42(9):87-91,144.
[30]孙 楠,梁方方,陈建华,等. 韭菜不同生态位微生物群落组成及功能特征[J]. 中国农业大学学报,2023,28(3):61-73.
收稿日期:2024-01-25
基金项目:国家重点研发计划(编号:2021YFD1601103);河南省科技攻关项目(编号:232102110212);河南省自然科学基金(编号:222300420270);信阳生态研究院开放基金(编号:2023XYQN23)。
作者简介:刘 威(1985—),男,河南上蔡人,硕士,讲师,主要从事茶树生理生态与质量安全研究。E-mail:liuweitea@163.com。
通信作者:孙慕芳,博士,教授,主要从事茶叶品质形成理论研究。E-mail:xynzsmf@163.com。

